Толуол метилхлорид: Толуол, структурная формула, химические, физические свойства
Содержание
Толуол, структурная формула, химические, физические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Минимальные диапазоны измерения основных компонентов
В таблице приведены минимально возможные диапазоны измерения основных компонентов.
Измерения в больших диапазонах вплоть до 100 % возможны, если не оговорено обратное.
Все перечисленные компоненты, кроме кислорода O2, измеряются
по фотометрической технологии, типичная погрешность измерений составляет 1 % от диапазона.
| в воздухе и азоте | 0…1000 млн−1 | ||
| в азоте | 0…200 млн−1 | −30
°C | |
| Уксусная кислота CH3CO2H в азоте | 0…200 млн−1 | ||
| Уксусный ангидрид | 0…50 млн−1 | ||
| Ацетон СН2COCH3 в воздухе и азоте | 0…400 млн−1 | ||
| в воздухе и азоте | 0…500 млн−1 | −20 °C | |
| в аммиаке и ацетоне | 0…5 % | ||
| в этилене и этане | 0…100 млн−1 | −20 °C | |
| Акрилонитрил CH2CHCN в воздухе и азоте | 0…1500 млн−1 | ||
| Аммиак NH3 в воздухе и азоте | 0…800 млн−1 | ||
| в воздухе и азоте | 0…250 млн−1 | 0 °C | |
| в жидких углеводородах | 0…5 % | проба не содержит воды | |
| Бензол C6H6 в воздухе и азоте | 0…250 млн−1 | 0 °C | |
| 1,3-бутадиен C4H6 в воздухе и азоте | 0…500 млн−1 | ||
| Н-бутан и изобутан C4H10 в воздухе и азоте | 0…100 млн−1 | ||
| Бутилацетат CH3CO2C4 в воздухе и азоте | 0…500 млн−1 | ||
| в воздухе, азоте и водороде | 0…20 млн−1 | ||
| в углеводородах С1—С4 | 0…50 млн−1 | −5 °C | |
| в воздухе и азоте | 0…10 млн−1 | на 5 °C ниже температуры окр. 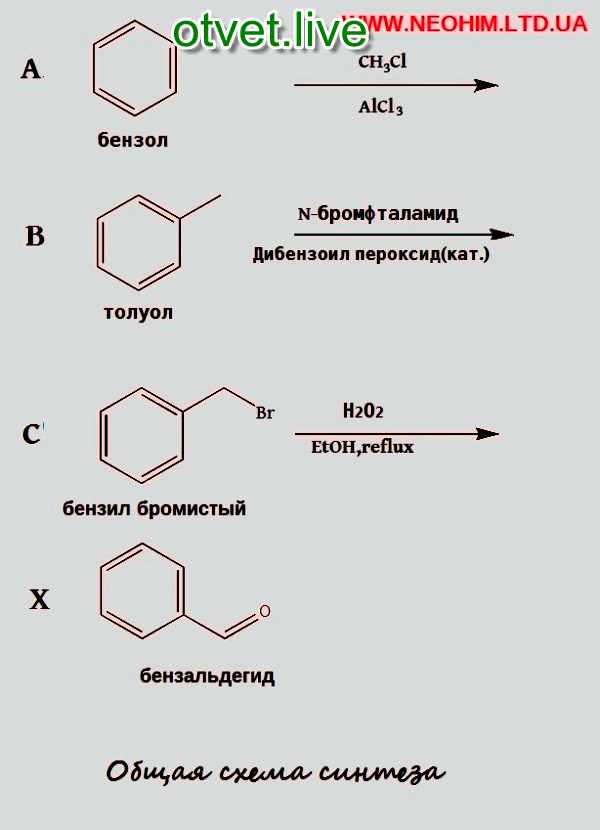 среды среды | Сервомекс 4100 |
| в дымовых газах | 0…0,25 % | Сервомекс 4900 | |
| Сероуглерод CS2 в воздухе и азоте | 0…50 млн−1 | −30 °C | |
| в воздухе и азоте, CO2 | 0…10 млн−1 | на 5 °C ниже температуры окр. среды | Сервомекс 4100 |
| в водороде | 0…50 млн−1 | −20 °C | |
| в дымовых газах | 0…100 млн−1 | −5 °C | |
| в углеводородах | 0…1000 млн−1 | −5 °C | |
| Четыреххлористый углерод CCl4 в воздухе и азоте | 0…25 млн−1 | ||
| в воздухе и азоте | 0…25 млн−1 | ||
| в углеводородах, CO | 0…0,5 % | ||
| Хлор Cl2 в воздухе и азоте | 0…100 млн−1 | ||
| (Моно-)хлоробензол C6H5Cl в воздухе и азоте | 0…250 млн−1 | −0 °C | |
Хлорэтан — см. этилхлорид этилхлорид | |||
| Хлороформ CHCl3 в воздухе и азоте | 0…100 млн−1 | ||
| Хлорметан — см. метилхлорид | |||
| Циклогексанон С6H10O в воздухе и азоте | 0…200 млн−1 | ||
| Циклопентан C6H10 в воздухе и азоте | 0…250 млн−1 | ||
| Oксид дейтерия D2O | 0…5 % | ||
| Oксид дейтерия D2O | 0…2500 млн−1 | ||
| Дихлорэтан C2H4Cl2 в воздухе и азоте | 0…5000 млн−1 | ||
| Дихлорметан | 0…400 млн−1 | ||
| Диэтилэфир | 0…100 млн−1 | ||
| Диметилэфир CH3OCH3 в воздухе и азотe | 0…200 млн−1 | ||
| Диметилсульфид | 0…300 млн−1 | ||
| в воздухе и азотe | 0…3500 млн−1 | ||
| в этилене | 0…5 % | ||
| в метане | 0…5000 млн−1 | −30 °C | |
| в природном газе | 0…1,5 % | ||
| Этанол C2H5OH в воздухе и азотe | 0…200 млн−1 | ||
| Этилацетат СH3CO2C2H5 в воздухе и азотe | 0…500 млн−1 | ||
| Этилбензол C6H5C2H5 в воздухе и азотe | 0…250 млн−1 | ||
| Этилхлорид | 0…500 млн−1 | −20 °C | |
| в воздухе и азотe | 0…500 млн−1 | ||
| в легких углеводородах | 0…1 % | −0 °C | |
| Формальдегид HCHO в воздухе и азотe | 0…500 млн−1 | ||
| в воздухе и азотe | 0…200 млн−1 | ||
| в воздухе и азотe | 0…50 млн−1 | −30 °C | |
| Фреоны | 0…50 млн−1 | ||
| Фреон 134A в воздухе и азотe | 0…20 млн−1 | ||
| Фреон 1301/13B1 в воздухе и азотe | 0…750 млн−1 | ||
| Фторотан | 0…50 млн−1 | ||
| Гексан C6H14 в воздухе и азотe | 0…50 млн−1 | ||
| Гексен C6H12 в воздухе и азотe | 0…100 млн−1 | ||
| Бромистый водород HBr в воздухе и азотe | 0…2 % | ||
| Соляная кислота HCl в воздухе, азотe, дымовых газах | 0…100 млн−1 | ||
| Синильная кислота HCN в воздухе и азотe | 0…500 млн−1 | −30 °C | |
| Плавиковая кислота HF в воздухе и азотe | 0…1 % | −30 °C | |
| Сероводород H2S в воздухе, азоте, легких углеводородах | 0…5 % | −30 °C | |
| Гидроксильные ионы OH– в воде | 0…50 млн−1 | ||
| в углеводородах C1—C4 | 0…5 % | −30 °C | |
| в водороде | 0…5000 млн−1 | −30 °C | |
| в воздухе и азотe | 0…10 млн−1 | на 5 °C ниже температуры окр. 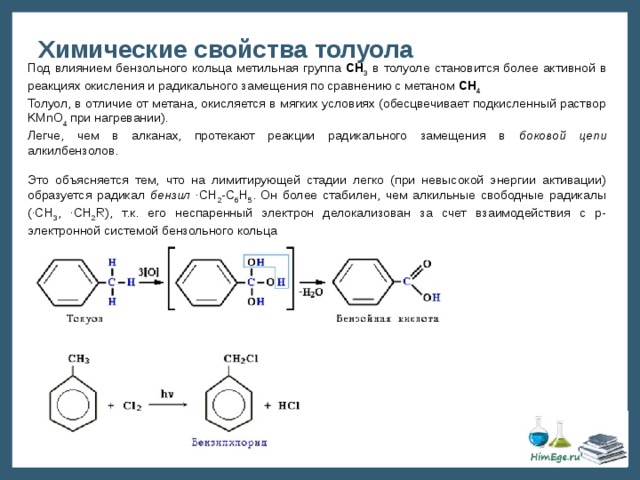 среды среды | |
| в воздухе и азотe | 0…350 млн−1 | ||
| в жидких углеводородах | 0…5 % | проба не содержит воды | |
| Метилацетат CH3CO2CH3 в воздухе и азотe | 0…500 млн−1 | −20 °C | |
| Метилацетилен CH3CCH в углеводородах С1—С4 | 0…1000 млн−1 | −20 °C | |
| Метилбромид CH3Br в воздухе и азотe | 0…500 млн−1 | ||
| Метилхлорид CH3Cl в воздухе и азотe | 0…1000 млн−1 | ||
| Метилдиоксолан C4H8O2 в воздухе и азотe | 0…250 млн−1 | ||
Метилен хлорид — см.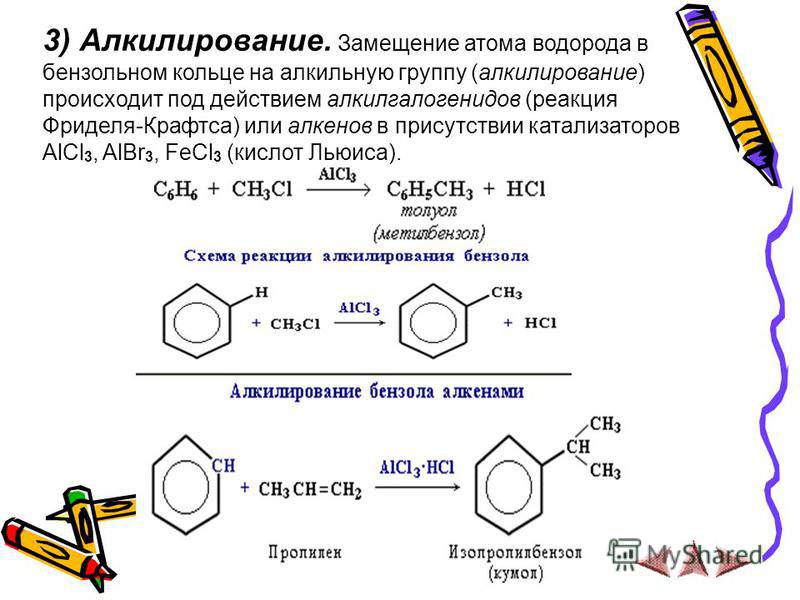 дихлорметан дихлорметан | |||
| Метилэтилкетон | 0…250 млн−1 | ||
| Метилизобутилкетон | 0…200 млн−1 | ||
| Метилмеркаптан CH3SH в воздухе и азоте | 0…300 млн−1 | ||
| в водороде | 0…5000 млн−1 | −30 °C | |
| в воздухе, азотe, дымовых газах | 0…100 млн−1 | Сервомекс 4900 | |
| Диоксид азота NO2 в воздухе, азоте, дымовых газах | 0…100 млн−1 | −30 °C | |
| в воздухе, азотe, дымовых газах | 0…100 млн−1 | −0 °C | Требуется NOx-конвертер |
| в воздухе, азотe, дымовых газах | 0…100 млн−1 | Сервомекс 4900 NOx расчитывается на основе измеренного NO | |
| Закись азота N2O в воздухе и азотe | 0…500 млн−1 | Сервомекс 4100 | |
| в воздухе, азотe, инертных газах | 0…10 млн−1 | на 5 °C ниже температуры окр. 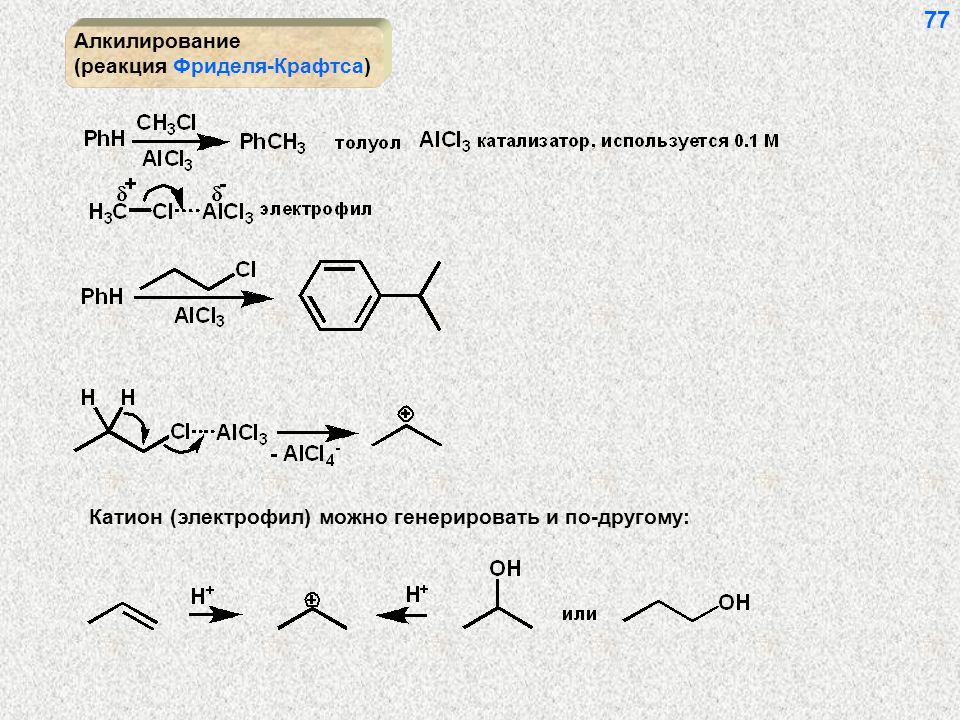 среды среды | Сервомекс 4100 |
| в дымовых газах | 0…1 % | ||
| в водороде, углеводородах | 0…0,5 % | ||
| Октен C8H16 в жидких углеводородах | 0…40 % | проба не содержит воды | |
| Пентан C5H12 в воздухе и азотe | 0…50 млн−1 | ||
| Перхлорэтилен C2Cl4 в воздухе и азотe | 0…100 млн−1 | ||
| Бензин | 0…50 млн−1 | ||
| Фосген COCl2 в воздухе и азотe | 0…500 млн−1 | −30 °C | |
| в воздухе и азотe | 0…100 млн−1 | ||
| в метане, природном газе | 0…2 % | ||
| в углеводородах С2—С4 | 0…1 % | ||
| в воздухе и азотe | 0…200 млн−1 | ||
| в жидких углеводородах | 0…5 % | проба не содержит воды | |
| в воздухе и азоте | 0…500 млн−1 | ||
| в легких углеводородах | 0…1 % | −0 °C | |
| Оксид пропилена CH3CHOCH2 в воздухе и азотe | 0…500 млн−1 | ||
| Карбонат натрия Na2CO3 в воде | 0…1 % | ||
| Стирол C8H8 в воздухе и азотe | 0…250 млн−1 | −0 °C | |
| Диоксид серы SO2 в воздухе, азотe, дымовых газах | 0…100 млн−1 | −30 °C | |
| Гексафторид серы SF6 в воздухе и азотe | 0…100 млн−1 | −30 °C | |
| Тетрагидрофуран C4H8O в воздухе и азотe | 0…250 млн−1 | ||
| Тионил хлорид SOCl2 в воздухе и азотe | 0…500 млн−1 | ||
| Толуол C7H8 в воздухе и азотe | 0…350 млн−1 | −0 °C | |
| Толуолдиизоцианат CH3C6H3(NCO)2 | 0…50 млн−1 | ||
| Трихлорэтилен C2HCl3 в воздухе и азотe | 0…250 млн−1 | ||
| Трихлорсилан SiCl3Н в водороде | 0…100 млн−1 | ||
| Винилацетат С4Н6О2 в воздухе и азотe | 0…50 млн−1 | ||
| Винилхлорид C2H3Cl в воздухе и азотe | 0…500 млн−1 | −50 °C | |
в органических жидкостях ч. спиртах) ч. спиртах) | 0…5000 млн−1 | ||
| в хлоросодержащих растворителях | 0…50 млн−1 | ||
| в триоксане, тетрагидрофуране, оксиде пропилена | 0…50 млн−1 | ||
| в этиленгликоле | 0…5000 млн−1 | ||
| в воздухе, азотe, водороде | 0…1500 млн−1 | ||
| в метане, природном газе | 0…2,5 % | ||
| Ксилол C8H10 в воздухе и азотe | 0…500 млн−1 |
Летучие органические соединения в вашем доме
Летучие органические соединения (ЛОС) — это большая группа химических веществ, которые содержатся во многих продуктах, которые мы используем для строительства и обслуживания наших домов. Как только эти химические вещества попадают в наши дома, они выделяются или выделяются в воздух в помещении, которым мы дышим. Они могут или не могут чувствовать запах, и обоняние не является хорошим индикатором риска для здоровья.
Как только эти химические вещества попадают в наши дома, они выделяются или выделяются в воздух в помещении, которым мы дышим. Они могут или не могут чувствовать запах, и обоняние не является хорошим индикатором риска для здоровья.
Типичными примерами летучих органических соединений, которые могут присутствовать в нашей повседневной жизни, являются: бензол, этиленгликоль, формальдегид, метиленхлорид, тетрахлорэтилен, толуол, ксилол и 1,3-бутадиен.
Источники ЛОС
| Строительные материалы | Товары для дома и личной гигиены | Деятельность |
|---|---|---|
| Краски, лаки, герметики, клеи | Освежители воздуха, чистящие средства | Курение |
| Ковер, виниловое напольное покрытие | Косметика | Химчистка, копировальные аппараты |
| Изделия из композитной древесины | Мазут, бензин | Кулинария, хобби |
| Обивка и поролон | Сжигание дров |
Физические лица могут проверить Базу данных товаров для дома, чтобы узнать больше о том, что является обычными предметами домашнего обихода.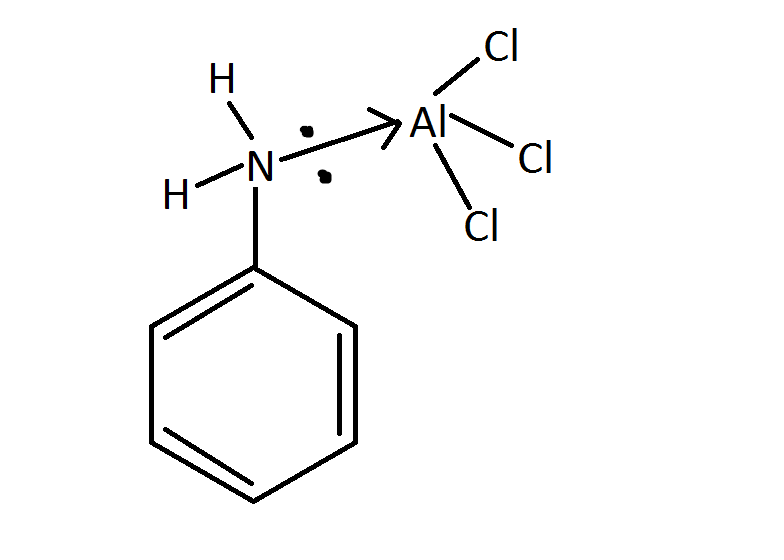
Последствия воздействия ЛОС на здоровье
Риск воздействия на здоровье при вдыхании любого химического вещества зависит от того, сколько его находится в воздухе, как долго и как часто человек его вдыхает.
Вдыхание низких концентраций летучих органических соединений в течение длительного периода времени может увеличить риск возникновения проблем со здоровьем у некоторых людей. Несколько исследований показывают, что воздействие ЛОС может ухудшить симптомы у людей, страдающих астмой или особенно чувствительных к химическим веществам. Это совсем другие воздействия, чем профессиональные воздействия.
Важно помнить, что летучие органические соединения относятся к группе химических веществ. Каждое химическое вещество имеет свою токсичность и способность вызывать различные последствия для здоровья.
Общие симптомы воздействия ВЫСОКОГО уровня ЛОС включают:
| Острое/кратковременное воздействие (от часов до дней) | Хроническое облучение (лет на всю жизнь) |
|---|---|
| Раздражение глаз, носа и горла | Рак |
| Головные боли | Поражение печени и почек |
| Тошнота/рвота | Поражение центральной нервной системы |
| Головокружение | |
| Ухудшение симптомов астмы |
Каков безопасный уровень ЛОС?
Чтобы защитить свое здоровье, лучше ограничить воздействие продуктов и материалов, содержащих летучие органические соединения. Если вы считаете, что у вас могут быть проблемы со здоровьем, вызванные летучими органическими соединениями, попробуйте снизить их уровень в своем доме. Если симптомы сохраняются, проконсультируйтесь с врачом, чтобы исключить другие серьезные заболевания, которые могут иметь аналогичные симптомы.
Если вы считаете, что у вас могут быть проблемы со здоровьем, вызванные летучими органическими соединениями, попробуйте снизить их уровень в своем доме. Если симптомы сохраняются, проконсультируйтесь с врачом, чтобы исключить другие серьезные заболевания, которые могут иметь аналогичные симптомы.
Большинство исследований, связанных со здоровьем, проводились на отдельных химических веществах. Меньше известно о влиянии на здоровье воздействия комбинаций химических веществ. Поскольку токсичность ЛОС различается для каждого отдельного химического вещества, не существует Миннесотского или федерального санитарного стандарта для ЛОС как группы.
Подвержены ли некоторые люди большему риску воздействия ЛОС?
Люди с респираторными заболеваниями, такими как астма, маленькие дети, пожилые люди и люди с повышенной чувствительностью к химическим веществам могут быть более восприимчивы к раздражению и заболеваниям от летучих органических соединений.
Как снизить уровень ЛОС в доме?
Во-первых, проведите осмотр своего дома на наличие распространенных источников летучих органических соединений. Ищите запасы неиспользованных химикатов, таких как краски, лаки, растворители, клеи и герметики. Предметы домашнего обихода, такие как ковер, мягкая мебель или предметы из композитного дерева, имеют тенденцию выделять больше летучих органических соединений, когда они новые.
Ищите запасы неиспользованных химикатов, таких как краски, лаки, растворители, клеи и герметики. Предметы домашнего обихода, такие как ковер, мягкая мебель или предметы из композитного дерева, имеют тенденцию выделять больше летучих органических соединений, когда они новые.
Некоторые меры по уменьшению воздействия включают:
- Контроль источника : Удалите или сократите количество продуктов в вашем доме, которые выделяют летучие органические соединения.
- Покупайте только то, что вам нужно, когда речь идет о красках, растворителях, клеях и герметиках. Неиспользованные химические вещества, хранящиеся дома, иногда могут «протекать» и выделять летучие органические соединения в воздух.
- Храните неиспользованные химикаты в гараже или сарае, где люди не проводят много времени.
- Утилизируйте неиспользованные химикаты, хранящиеся у вас дома или в гараже. Узнайте в своем городе или округе о местах сбора опасных бытовых отходов.

- Рассмотрите возможность приобретения красок и предметов интерьера с низким содержанием летучих органических соединений.
- При покупке новых предметов ищите напольные модели, у которых в магазине разрешено выделение газа. Изделия из цельного дерева с отделкой с низким уровнем выбросов будут содержать меньше летучих органических соединений, чем изделия из композитной древесины.
- Вентиляция и климат-контроль : Увеличение количества свежего воздуха в вашем доме поможет снизить концентрацию ЛОС в помещении.
- Увеличьте вентиляцию, открыв двери и окна. Используйте вентиляторы, чтобы максимизировать приток воздуха извне.
- Поддерживайте температуру и относительную влажность как можно ниже или комфортнее. Химикаты выделяют больше газов при высоких температурах и влажности.
- Старайтесь выполнять ремонт дома, когда в доме никого нет, или в сезоны, когда вы можете открывать двери и окна, чтобы улучшить вентиляцию.

Должен ли я проверить свой дом на наличие летучих органических соединений?
Федеральных или государственных стандартов для уровней летучих органических соединений в непромышленных условиях не существует. Если вас беспокоят летучие органические соединения, лучше всего попытаться уменьшить или исключить продукты, которые приносят летучие органические соединения в ваш дом.
Толуол – Основы химии – Полезная информация
Наименование продукта: Толуол
Синонимы: Метилбензол; толуол; Фенилметан
Краткая история : Впервые о толуоле сообщил польский химик Филип Вальтер в 1837 году. Он произвел толуол путем перегонки соснового масла и назвал его ретинафтой. Это название было заменено термином толуол, производным от «толуол». Первоначально он был назван Йонсом Якобом Берцелиусом.
О продукте : Толуол – это химическое вещество, которое встречается в природе в сырой нефти и извлекается в процессе ее переработки. Толуол используется во многих промышленных процессах и коммерческих продуктах, от красок и типографских красок до покрытий для тканей, искусственных подсластителей, косметики, гибких пенопластов и автомобильных деталей.
Толуол используется во многих промышленных процессах и коммерческих продуктах, от красок и типографских красок до покрытий для тканей, искусственных подсластителей, косметики, гибких пенопластов и автомобильных деталей.
Идентификационные характеристики продукта:
Номер CAS: 108-88-3
H.S. Код: 2707.20
Химическая формула: C7H8
Химические свойства:
Печата плавления: -95C
Точка болигирования: 111C
Специфическая гравита: 0,87
SLEABILITY в WATER: 0,87
SLEABILITY в WATER: 0,87
.
Плотность пара: 3,2
Краткая история:
Использование :
| Химическое использование | Использование продукта |
|
|
|
|
Процесс производства: Толуол можно производить с использованием различных процессов. При взаимодействии бензола с метилхлоридом в присутствии безводного хлорида алюминия образуется толуол.
При взаимодействии бензола с метилхлоридом в присутствии безводного хлорида алюминия образуется толуол.
Ch4Cl + AlCl3 → Ch4+ + AlCl4-
C6H5H + Ch4+ + AlCl4- → C6H5Ch4 + HCl + AlCl3’
Эта реакция известна как реакция Фриделя-Крафтса.
Когда происходит реакция между арилгалогенидом и алкилгалогенидом в присутствии металлического натрия с образованием ароматических соединений, таких как бромбензол и бромистый метил, которые затем реагируют с металлическим натрием в сухом эфирном растворе с образованием толуола. Эта реакция известна как реакция Вюрца-Фиттига.
C6H5Br + Ch4Br + 2Na → C6H5Ch4 + 2NaBr
Натриевая соль толуиловой кислоты при нагревании с натронной известью дает толуол готовится толуол.
C6h5Ch4OH (крезол) + Zn → C6H5Ch4 (толуол) + ZnO
Толуолсульфокислота при обработке перегретым паром или кипячении с HCl дает толуол.
Ch4C6h5SO3H (толуолсульфокислота) + HOH (пар) → C6H5Ch4 (толуол) + h3SO4 (серная кислота)
Толуол также можно получить из толуидина и реактива Гриньяра.
Резюме: Глобальный рынок толуола до 2020 г. — Азиатско-Тихоокеанский регион будет обеспечивать 50% мирового спроса к 2018 г. за счет применения растворителей, рынков бензола и ксилола Pacific будет составлять 50% мирового спроса к 2018 году, чему способствует применение растворителей, рынки бензола и ксилола» — это подробный отчет, посвященный спросу в мировой индустрии толуола. Отчет предоставляет читателю подробный анализ и прогнозы основных экономических и рыночных тенденций, влияющих на глобальный спрос на толуол во всех основных регионах мира. Он также содержит анализ и описание основных движущих сил и ограничений, влияющих на спрос на толуол в различных регионах. Глобальный спрос на толуол оценивается с точки зрения сегментов конечных пользователей и цен, а также предоставляется конкурентная среда как на региональном, так и на страновом уровне. В целом отчет представляет собой всесторонний анализ мирового рынка толуола, охватывающий все основные параметры. Отчет построен с использованием данных и информации, полученных из собственных баз данных, первичных и вторичных исследований и внутреннего анализа, проведенного группой отраслевых экспертов GBI Research.
В целом отчет представляет собой всесторонний анализ мирового рынка толуола, охватывающий все основные параметры. Отчет построен с использованием данных и информации, полученных из собственных баз данных, первичных и вторичных исследований и внутреннего анализа, проведенного группой отраслевых экспертов GBI Research.
Объем:
Факторы, ограничения и проблемы, влияющие на рост рынка толуола во всех основных регионах: Азиатско-Тихоокеанский регион, Европа, Северная Америка, Ближний Восток и Африка, Южная и Центральная Америка.
Прогнозы спроса и объемов производства на рынках толуола всех основных стран: США, Канады, Великобритании, Германии, Франции, России, Италии, Китая, Японии, Южной Кореи, Индии, Таиланда, Тайваня, Саудовской Аравии, Ирана, Бразилии , Мексика и Аргентина.
Прогнозы объемов спроса основных приложений для конечных пользователей с выделением тенденций и анализом доли объема для каждого из этих приложений во всех основных странах.

Ценовые прогнозы и анализ основных стран и регионов.
Анализ доли мощностей ключевых производителей во всех основных странах.
Динамика импорта и экспорта толуола во всех основных странах.
Причины купить :
Этот отчет является полезным инструментом как для профессионалов отрасли, так и для начинающих, желающих получить представление о динамике мирового рынка толуола.
Чтобы получить подробное представление о факторах, которые, как ожидается, повлияют на рост рынка толуола в разных регионах мира.
Чтобы определить наиболее привлекательные регионы, сегменты продуктов и приложения для конечных пользователей, чтобы увеличить доход от бизнеса.
Разработка индивидуальных стратегий на основе текущих и прогнозируемых тенденций производства и потребления толуола.