Запишите относительную атомную массу азота калия. Атомная масса азота
Молярная масса азота
Азот относится к 15-й группе (по старой классификации – к главной подгруппе 5-ой группы), 2-го периода под 7 атомным номером в периодической системе химических элементов и обозначен символом N. Молярная масса азота равна 14 кг/моль.
Азот как простое вещество представляет собой в нормальных условиях инертный двухатомный газ, не имеющий ни цвета, ни вкуса, ни запаха. Из этого газа частично состоит атмосфера Земли. Молекулярная масса азота равна 28. Слово «азот» в переводе с греческого языка означает «безжизненный».
В природе молекулы газа состоят из стабильных изотопов, в которых молярная масса азота составляет 14кг/моль (99.635%) и 15кг/моль (0.365%). За пределами земной атмосферы он обнаружен в составе газовых туманностей, в атмосфере Солнца, межзвездном пространстве, на планетах Нептун, Уран и так далее. Он является четвертым в Солнечной системе по распространению после таких элементов, как водород, гелий, кислород. Искусственно получены радиоактивные изотопы, в которых молярная масса азота – от 10кг/моль и до 13кг/моль, а также от 16кг/моль и до 25кг/моль. Они все относятся к короткоживущим элементам. Самый стабильный из изотопов, в котором молярная масса азота составляет 13кг/моль, имеет десятиминутный период полураспада.
Биологическая роль этого газа огромна, ведь он является одним из основных элементов, из которых складываются нуклеиновые кислоты, белки, нуклеопротеиды, хлорофилл, гемоглобин и другие важные вещества. Оба стабильных изотопа и молярная масса азота в 14кг/моль и в 15кг/моль участвует в азотном обмене. По этой причине колоссальное количество связанного азота содержат живые организмы, «мертвая» органика и дисперсное вещество океанов и морей. А в дальнейшем, как результат процессов разложения и гниения органики, содержащей азот, образовываются залежи азотсодержащей органики такой, как, например, селитра.
Азот из атмосферы способны связать и превратить в усваиваемые формы, например, соединения аммония, около 160 видов микроорганизмов, в основном состоящие в симбиотической связи с высшими растениями, обеспечивая их азотными удобрениями, и дальше по пищевой цепочке попадает к травоядным организмам и хищникам.
В лабораторных условиях азот получают при помощи реакции разложения аммония нитрита. В результате получают смесь газа с аммиаком, кислорода и оксида азота (I). Его очистку производят, пропуская полученную смесь вначале через раствор серной кислоты, потом сульфата железа (II), а потом над раскаленной медью. Другой способ получения его в лаборатории заключается в пропускании над оксидом меди (II) аммиака при температуре около 700 градусов Цельсия.
В промышленных масштабах азот получают, пропуская воздух над раскаленным коксом, но образуется не чистый продукт, а опять-таки смесь, но уже с благородными газами и углекислым газом, так называемый «воздушный» или «генераторный» газ. Он является сырьем для химического синтеза и топливом. Также из «генераторного» газа можно выделять азот, для этого проводят поглощение оксида углерода. Второй способ получения азота в промышленности – фракционная перегонка жидкого воздуха.
Есть также такие методы, как мембранное и адсорбционное газоразделение. Возможно получение атомарного азота, он намного активнее, чем молекулярный, способен, к примеру, реагировать при обычных условиях с фосфором, серой, мышьяком, металлами. Азотные соединения широко применяются в промышленности, из них делают удобрения, взрывчатку, медикаменты, красители и так далее. В нефтехимической промышленности им продувают трубопроводы, проверяют их работу под давлением. В горнодобывающем комплексе с его помощью создают внутри шахт взрывобезопасную среду, распирают им пласты породы. В электронике им обдувают сборки, в которых недопустимо малейшее окисление кислородом, который содержится в воздухе.
fb.ru
Молярная масса азота
Азот относится к 15-й группе (по старой классификации – к главной подгруппе 5-ой группы), 2-го периода под 7 атомным номером в периодической системе химических элементов и обозначен символом N. Молярная масса азота равна 14 кг/моль.
Азот как простое вещество представляет собой в нормальных условиях инертный двухатомный газ, не имеющий ни цвета, ни вкуса, ни запаха. Из этого газа частично состоит атмосфера Земли. Молекулярная масса азота равна 28. Слово «азот» в переводе с греческого языка означает «безжизненный».
В природе молекулы газа состоят из стабильных изотопов, в которых молярная масса азота составляет 14кг/моль (99.635%) и 15кг/моль (0.365%). За пределами земной атмосферы он обнаружен в составе газовых туманностей, в атмосфере Солнца, межзвездном пространстве, на планетах Нептун, Уран и так далее. Он является четвертым в Солнечной системе по распространению после таких элементов, как водород, гелий, кислород. Искусственно получены радиоактивные изотопы, в которых молярная масса азота – от 10кг/моль и до 13кг/моль, а также от 16кг/моль и до 25кг/моль. Они все относятся к короткоживущим элементам. Самый стабильный из изотопов, в котором молярная масса азота составляет 13кг/моль, имеет десятиминутный период полураспада.
Биологическая роль этого газа огромна, ведь он является одним из основных элементов, из которых складываются нуклеиновые кислоты, белки, нуклеопротеиды, хлорофилл, гемоглобин и другие важные вещества. Оба стабильных изотопа и молярная масса азота в 14кг/моль и в 15кг/моль участвует в азотном обмене. По этой причине колоссальное количество связанного азота содержат живые организмы, «мертвая» органика и дисперсное вещество океанов и морей. А в дальнейшем, как результат процессов разложения и гниения органики, содержащей азот, образовываются залежи азотсодержащей органики такой, как, например, селитра.
Азот из атмосферы способны связать и превратить в усваиваемые формы, например, соединения аммония, около 160 видов микроорганизмов, в основном состоящие в симбиотической связи с высшими растениями, обеспечивая их азотными удобрениями, и дальше по пищевой цепочке попадает к травоядным организмам и хищникам.
В лабораторных условиях азот получают при помощи реакции разложения аммония нитрита. В результате получают смесь газа с аммиаком, кислорода и оксида азота (I). Его очистку производят, пропуская полученную смесь вначале через раствор серной кислоты, потом сульфата железа (II), а потом над раскаленной медью. Другой способ получения его в лаборатории заключается в пропускании над оксидом меди (II) аммиака при температуре около 700 градусов Цельсия.
В промышленных масштабах азот получают, пропуская воздух над раскаленным коксом, но образуется не чистый продукт, а опять-таки смесь, но уже с благородными газами и углекислым газом, так называемый «воздушный» или «генераторный» газ. Он является сырьем для химического синтеза и топливом. Также из «генераторного» газа можно выделять азот, для этого проводят поглощение оксида углерода. Второй способ получения азота в промышленности – фракционная перегонка жидкого воздуха.
Есть также такие методы, как мембранное и адсорбционное газоразделение. Возможно получение атомарного азота, он намного активнее, чем молекулярный, способен, к примеру, реагировать при обычных условиях с фосфором, серой, мышьяком, металлами. Азотные соединения широко применяются в промышленности, из них делают удобрения, взрывчатку, медикаменты, красители и так далее. В нефтехимической промышленности им продувают трубопроводы, проверяют их работу под давлением. В горнодобывающем комплексе с его помощью создают внутри шахт взрывобезопасную среду, распирают им пласты породы. В электронике им обдувают сборки, в которых недопустимо малейшее окисление кислородом, который содержится в воздухе.
Источник: fb.ru
Комментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы

Неметаллический элемент 15-й группы [Va] периодической таблицы – азот, 2 атома которого, соединяясь, образуют молекулу, – бесцветный, без запаха и вкуса газ, составляющий большую часть атмосферы Земли и яв...
 Образование Молярная масса кислорода. Чему равна молярная масса кислорода?
Образование Молярная масса кислорода. Чему равна молярная масса кислорода?Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная мас...
 Образование Молярная масса водорода: тяжелого и легкого
Образование Молярная масса водорода: тяжелого и легкогоСамый легкий из химических элементов, обязательный компонент органических веществ, необходимая часть молекул жизни – воды, - и это все о водороде. Само имя его на русский переведено при помощи преобразования час...

Химия – наука крайностей. В том смысле, что фактические, настоящие, описывающие действительность числа в ней или крайне малы, или крайне велики. Очень многих испугало бы число с 23 нулями. Это действительно мног...
 Образование Молярная масса эквивалента
Образование Молярная масса эквивалентаСогласно выражению закона постоянства состава, всякое химически чистое соединение остаётся в одном и том же количественном составе, никоим образом не зависящим от способа его получения, о чем впервые поведал миру учён...
 Образование Как найти молярную массу
Образование Как найти молярную массуВ практической и теоретической химии существуют и имеют практическое значение два таких понятия, как молекулярная (его часто заменяют понятием молекулярный вес, что не правильно) и молярная масса. Обе эти величины ...
 Образование Молярная масса йода и его характеристики
Образование Молярная масса йода и его характеристикиЧто представляет собой йод? Молярная масса данного элемента составляет 127 г/моль. Рассмотрим основные характеристики этого галогена, его значимость для живых организмов.
 Образование Молярная масса аммиака, свойства, применение
Образование Молярная масса аммиака, свойства, применениеСреди соединений азота с водородом особое место принадлежит аммиаку. Он является важнейшим продуктом химического производства и применяется во многих отраслях деятельности человека. В нашей статье мы ознакомимся с мол...
 Автомобили Закись азота для авто: описание, применение, эффективность и результаты
Автомобили Закись азота для авто: описание, применение, эффективность и результатыУ многих возникает необходимость в увеличении мощности мотора в транспортном средстве. Эту задачу можно решить при помощи различных методов, существующих сегодня. Одним из них является закись азота для авто.
 Автомобили Система "Платон" - что это? Российская система взимания платы с грузовиков, имеющих массу свыше 12 тонн
Автомобили Система "Платон" - что это? Российская система взимания платы с грузовиков, имеющих массу свыше 12 тоннСравнительно недавно на территории Российской Федерации была запущена система по автоматическому взиманию денежных средств с владельцев грузовых автомобилей массой свыше 12 тонн как компенсации за наносимый ими ущерб ...
monateka.com
Запишите относительную атомную массу азота калия
Прежде, чем ответить на вопрос задачи «запишите относительную атомную массу азота, калия…» стоит упомянуть, что значение данной величины можно почерпнуть из периодической таблицы. Таким образом, относительные атомные массы азота, калия и кислорода равны 14, 39 и 16 соответственно. Из этих химических элементов состоят следующие вещества: 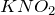 — нитрит калия,
— нитрит калия, 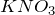 — нитрат калия.Молярная масса – величина, равная отношению массы вещества к количеству вещества. Она имеет размерность кг/моль или г/моль; обычно её обозначают буквой «М».Рассчитаем молярные массы нитрата и нитрита калия.
— нитрат калия.Молярная масса – величина, равная отношению массы вещества к количеству вещества. Она имеет размерность кг/моль или г/моль; обычно её обозначают буквой «М».Рассчитаем молярные массы нитрата и нитрита калия.
![Rendered by QuickLaTeX.com \[M(KNO_2) \rightarrow Ar(K) + Ar(N) + 2Ar(O) \rightarrow 29 + 14 + 2\cdot 16 \rightarrow 85 g/mole;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-01de73c0e6bbe480884b81402377c9fa_l3.png)
![Rendered by QuickLaTeX.com \[ M(KNO_3) \rightarrow Ar(K) + Ar(N) + 3Ar(O) \rightarrow 29 + 14 + 3\cdot 16 \rightarrow 101 g/mole.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-667a07f73f69618d317c3fb91f5d0516_l3.png)
Найдем массовую долю кислорода в составе нитрита калия:
![Rendered by QuickLaTeX.com \[ \omega (O) \rightarrow 2Ar (O) \div M(KNO_2) \times 100 \%.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cf5aad03cbce0aeaa1dc3bec445671cd_l3.png)
![Rendered by QuickLaTeX.com \[ \omega (O) \rightarrow 32 \div 85 \times 100 \% \rightarrow 37,65%.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-920798c6fb9693342e0c1ed2960f769f_l3.png)
Найдем массовую долю кислорода в составе нитрата калия:
![Rendered by QuickLaTeX.com \[ \omega (O) \rightarrow 3Ar (O) \div M(KNO_3) \times 100 \%.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-64cf53827716cd93c44fe37112fb2ad8_l3.png)
![Rendered by QuickLaTeX.com \[ \omega (O) \rightarrow 32 \div 101 \times 100 \% \rightarrow 47,52%.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4a3b571516dd85d0ac83d835174b9484_l3.png)
ru.solverbook.com
Вес атомный азота - Справочник химика 21
Общее количество вещества атомного азота в аммофосе массой 200 кг составляет [c.10]
Следовательно, количество вещества атомного азота, находившегося в сожженном образце вещества, составляет [c.120]
Вычисляем количество вещества атомного азота, содержавшегося в образце исходного вещества [c.143]
Находим соотношение между количествами веществ атомных азота, водорода и кислорода в соединении [c.143]
Азот в атомном состоянии может быть получен из молекулярного действием электрического разряда. Атомный азот значительно более активен по сравнению с молекулярным. Он может участвовать в реакциях типа [c.239]
Азотирование стали — насыщение поверхности стальных деталей азотом для повышения твердости, износоустойчивости и коррозионной стойкости. Для азотирования нагревают детали при 480—650 °С в атмосфере аммиака, при этом образуется атомный азот, который поглощается поверхностью стальных деталей с образованием нитридов железа и нитридов легирующих эле.ментов. [c.8]
Из данных табл. 6.2 следует, что при давлении от 0,001 до 10 МПа, температуре от О до 1400 К и коэффициенте избытка окислителя от 0,1 до 10 атомный азот в продуктах сгорания практически отсутствует при а 0,1 продукты сгорания состоят из трех компонентов Нг, N2 и Н2О (содержанием остальных компонентов можно пренебрегать) при а 10 продукты сгорания состоят из N2, О2, Н2О и Нг, остальные компоненты присутствуют в очень малом количестве при 0,5 а 2 следует учитывать все компоненты, за исключением атомного азота. [c.265]
Важные результаты достигнуты при фиксации азота ( в виде аммиака) металлоорганическими комплексами переходных металлов или при непосредственной реакции атомного азота с органическими соединениями (например, непредельными углеводородами). [c.238]
Другой путь заключается в непосредственной реакции активированного атомного азота (в разрядной трубке) с органическими соединениями (например, алкенами), приводящей к соединениям циана (таков возможный путь образования органических соединений [c.242]
Свойства. Азот — бесцветный газ, не имеющий вкуса и запаха, т. пл. —210°С, т. кип. —196°С. При комнатной температуре он реагирует только с литием и образует комплексы с некоторыми -элементами (см. дополнение). При высоких температурах N2 интенсивно взаимодействует с многими металлами. Атомный азот, получаемый при действии на N2 электрического разряда (в приборе типа озонатора) активен даже при комнатной температуре, он реагирует с металлами и неметаллами (5, Р, Н и др.). [c.394]
Те же Бей и Штейнер недавно показали, что метастабильные молекулы, образованные в разряде, могут быть выведены из зоны разряда. Этим самым было дано доказательство тому, что рекомбинация атомов азота не является единственным способом образования метастабильных молекул в послеразрядной зоне. В колебательном или конденсированном разряде образуется большое количество атомного азота. Вычислено, что при наиболее благоприятных условиях получается приблизительно 40% атомов. [c.55]
Вышеупомянутые работы Кистяковского содержат еще одно-интересное наблюдение именно, он нашел, что при поглощении железным катализатором небольшого количества кислорода исчезает как перелом при 13 V, вызываемый вероятно атомами водорода, так и перелом при 11 V, объясняемый присутствием на поверхности атомного азота. Повторное введение следов азота слегка усиливает перелом при 11 V, повторное же введение небольшого количества водорода почти не влияет на перелом при 11 V, но в значительной степени усиливает перелом при 13 V. Таким образом кислород, который, как известно, способен отравлять железный катализатор, способен также удалять и ту форму азота, которая обусловливает перелом ионизационной кривой при 11 V. [c.124]
Азот N2 — бесцветный, не имеющий запаха и вкуса газ. Сгущается в бесцветную же легкоподвижную жидкость при —147° и 33 атм давления удельный вес жидкого азота 0,7576 при —184°. В твердом состоянии азот также не имеет цвета. В химическом отношении азот обладает большой инертностью. При обыкновенной температуре он не вступает в реакцию с металлоидами и металлами (исключение составляет литий). При нагревании азот довольно легко соединяется с некоторыми металлами. Реакция азота с магнием, кальцием и другими металлами (при температуре от 550 до 600°) используется в газовом анализе для удаления азота из газовой смеси и для определения процентного состава его в ней. Атомный азот несравненно активнее молекулярного. Уже при обыкновенной температуре он соединяется с серой, фосфором, мышьяком, ртутью и другими металлами. [c.23]
Правда, в это время Мейер еще не опирался на выводы из периодического закона, что очень хорошо видно из его рассуждений об атомности азота и его аналогов [там же, стр. 265 н сл. ]. Но даже и в следующем издании своей книги (1876 г.) он, относя азот к элементам пятиатомным по кислороду [16, стр. 270], сохранил те же формулы для азотной кислоты, что и в предыдущем издании [там же, стр. 171]. [c.225]
Для получения нитридов наиболее пригоден аммиак, который перед азотом имеет некоторые преимущества, которые связаны с разной прочностью химической связи в молекулах. В аммиаке эта связь непрочная, и при нагревании наблюдается его разложение, которое ускоряется на поверхности металлов. Выделяющийся атомный азот активен, поэтому реакции образования нитридов идут при более низких температурах по сравнению с реакциями, идущими с азотом. Атомный водород восстанавливает оксидные пленки на металлах, которые мешают получению чистых нитридов. Небольшое количество кислорода или паров воды в аммиаке не мешает получению чистых нитридов, если исходные металлы (медь, железо, кобальт, никель и т. д.) не обладают большой активностью к кислороду. Активные металлы (магний, кальций, алюминий и т. д.) соединяются даже со следами кислорода, поэтому нитриды будут загрязнены оксидами. Если при нитровании использовать азот, то следы кислорода или паров воды будут переводить металлы или неметаллы в оксиды даже при небольшом сродстве к кислороду. [c.79]
Своеобразны еще малоизученные кинетические свойства атомного азота. С одной стороны, с парафинами происходит реакция расщепления, приводящая [c.147]
Сильная активация азота достигается в плазме электрического разряда. Удары быстрых электронов возбуждают молекулу N3, и она диссоциирует в плазме с образо нием химически очень активного атомного азота с электронной конфигурацией 1з 2з 2р . Этот процесс в естественных условиях происходит в грозовых разрядах — молниях [c.388]
Активный атомный азот воздуха вступает при этом в реакцию образования оксида азота(П) [c.388]
Изучение обмена изотопов азота Ni/ -I- N 2 = 2N Nl на тех же технических железных катализаторах приводило сначала к результатам, противоречащим схеме с участием атомного азота в синтезе аммиака, так как этот обмен, необходимо включающий ступени распада молекул аммиака на атомы, проходил во много раз медленнее синтеза (стр. 217). Однако, как выше уже указывалось, если поверхность катализатора предохранена от отравления поверхностными окислами, то обмен изотопов азота идет со скоростями одного порядка, со скоростью синтеза и со скоростью активированной адсорбции азота на той же поверхности. Такое совпадение скоростей дает новое подтверждение предположений, что наиболее медленной ступенью синтеза аммиака является активированная адсорбция молекул азота с расщеплением их на атомы. [c.292]
И Сг, ЧТО указывает на весьма сложный характер протекания процесса [ . Имеются высказывания, что образование H N из смеси h5-HN2 в тлеющем разряде обусловливается взаимодействием радикала СН с активным (атомным) азотом. [c.155]
Азог, подвергнутый действию обычного конденсированного разряда, приобретает повышенную химическую активность и продолжает светиться в течение более или меиее продолжительного времени даже после прекращения разряда. В таком послесветящем азоте непосредственными измерениями обнаружено присутствие значительных концентраций атомного азота (до 407о). Однако природа активного азота более сложна и не может еще считаться окончательно выясненной. [c.243]
Определите скорость химической реакции между атомным азотом и атомным кислородом, если через 51 с после начала эеакции молярная концентрация азота была 0,52 моль/л, а через 98 с стала 0,41 моль/л. Продуктом реакции является оксид азота(П). [c.241]
Получение атомного азота молуменьшенным давлением) сквозь поле высокочастотного электрического разряда. Так как энергии активации реакций с участием свободных атомов обычно весьма малы (часто — близки к нулю), атомный азот гораздо активнее молекулярного уже при обычной температуре он непосредственно соединяется с 3, Р, Аз, а также с Н и рядом других металлов. [c.255]
Действие окислителей на органические основания. Многие органические основания легко окисляются в щелочном или нейтральном растворе, но стойки в кислом растворе. го можно объяснить тем, что они, обладая основными свойствами и соединяясь с кислотами в продукты присоединения, являются ненасыщенными и, как таковые, легко окисляются. При растворении этих оснований в минеральных кислотах образуются солй, причем ненасыщенный Я-атом-ный азот оснований переходит в насыщенный 5-атомный азот соли. [c.321]
Продуктами сгорания смеси Н2+Ч2О2 (в порядке уменьшения содержания) являются Н2О, Нг, 0Н, Н, О2 и О. Содержание активных продуктов, таких, как радикалы 0Н, атомный водород и кислород, довольно значительно 10 8 и 4% соответственно. Продуктами сгорания смеси С0-Ь7202 в порядке уменьшения содержания являются СО2, СО, О2 и О. Содержание атомного кислорода составляет 4%. Горение смеси 2N2 -02, как отмечалось, характеризуется исключительно высокой температурой продуктов сгорания. Основными продуктами сгорания являются СО (66%) и N2 (32%). Имеется также атомный азот (1,2%), атомный кислород, атомный углерод, СМ и небольшие количества N0 и С2. [c.89]
Реакции активного азота и атомов N. Остановимся еще на реакциях активного азота [111, 680] и атомов N. Активный азот получается в электрическом разряде в азоте при давленпи в несколько миллиметров ртутного столба и представляет собой смесь нормальных молекул N2, метастабильных молекул ( 2) с энергией электронного возбуждения около 140 ккал 2 , нормальных атомов N и метастабильных атомов N ( D и Р) с энергией возбуждения 54,5 и 82 ккал [1186 а]. Заметим, что атомы N и в активном азоте Джексоном и Шиффом [797] недавно были обнарул ены при помощи масс-спектроскопического метода. О значительных концентразщ-ях атомов азота в зоне разряда в азоте свидетельствует, далее, поглощение света в области XX 400—800 А [565], которое в главной части, по-видимому, нужно приписать атомарной составляющей газа разрядной зоны. Имеются также указания, что рекомбинация атомов азота представляет собой главный источник свечения [1059, 386] и ионизации [856] активного азота (см. также [995, 841а]) и что химическая активность последнего обусловлена не заряженными, а нейтральными частицами [1249, 956]. Из всего этого можно заключить, что атомный азот является главной составляющей активного азота, ответственной также и за его химическую активность (см. также [340, 1301 в]) [c.97]
| Рис. 24, Микроструктуры титана с различным со дер-жанием азота [1251. Металл отожжен при 1100° шлифы травлены. Х250 а — 0.25 / (атомн.) азота б — 0,5 / (ятомн.) азота в — (атомн.) азота |  |
Джексоном [100] была развита теории стационарной концентрации радикалов (в применении к атомному азоту), замороженных в твердой решетке. Теория устанавливает величину предельной концентрации радикалов, но она не учитывает ме-хинизма рекомбинации и свойств матрицы. (Подробнее см. главу VIII.) [c.265]
chem21.info
Атомная характеристика азота - Справочник химика 21
Атомные характеристики. Атомный номер 7, атомная масса 14,0067 а. е.м., атомный объем 13,70-10- м /моль. Атомный радиус азота (ковалентный) 0,062 нм. Конфигурация внещних электронных оболочек атома 28 2р . Азот состоит из двух стабильных изотопов и ЭД, процентное содержание которых соответственно 99,635 и 0,365 %- Кроме того, известны четыре искусственных радиоактивных изотопа М, [c.268]
Если исследуемый образец дает рентгенограмму в виде диффузных колец с одинаковой интенсивностью по азимуту (все ориентации молекул равновероятны), то характеристикой взаимного расположения молекул может служить радиальная функция атомной плотности Рат( )- Так как молекулы жидких кристаллов состоят в основном из атомов углерода и водорода и лишь незначительного количества атомов азота и кислорода, рассеивающие способности которых близки к рассеивающей способности углерода (рассеянием атомами водорода можно пренебречь), то с допустимой степенью приближения можно предположить, что жидкие кристаллы состоят как бы из атомов углерода и для вычисления функции p iR) можно воспользоваться уравнением [c.258]При рассмотрении физических свойств простых веществ подчеркивалось, что они в основном присущи макроскопическим количествам вещества (особенно в конденсированном состоянии). Что же касается химических свойств, то они главным образом определяются свойствами атомов или молекул, поскольку химическое взаимодействие всегда протекает на атомном или молекулярном уровне. Однако реально наблюдаемая химическая активность твердых простых веществ в заметной мере зависит, например, от величины поверхности соприкосновения, ее состояния, структуры кристалла и т. п., т. е. опять-таки от макроскопических характеристик. Так, мелкодисперсный цинк (цинковая пыль) значительно энергичнее взаимодействует с кислотами, чем гранулированный. Например, цинковая пыль восстанавливает азотную кислоту до аммиака, а гранулированный цинк — только до низших оксидов азота. Хорошо известна также способность многих металлов (А1, Ре, Т1, Сг и т. п.) к пассивации в агрессивных окисляющих средах, хотя сами эти [c.38]
Химические свойства простых веществ. При рассмотрении физических свойств простых веществ подчеркивалось, что они в основном присущи макроскопическим количествам вещества (особенно в конденсированном состоянии). Что же касается химических свойств, то они главным образом определяются свойствами атомов или молекул, поскольку химическое взаимодействие всегда протекает на атомном или молекулярном уровне. Однако реально наблюдаемая химическая активность твердых простых веществ в заметной мере зависит, например, от величины поверхности соприкосновения, ее состояния, структуры кристалла и т.п., т.е. опять-таки от макроскопических характеристик. Так, мелкодисперсный цинк (цинковая пыль) значительно энергичнее взаимодействует с кислотами, чем гранулированный. Например, цинковая пыль восстанавливает азотную кислоту до аммиака, а гранулированный цинк — только до низших оксидов азота. Хорошо известна также способность многих металлов (А1, Ре, Т1, Сг и др.) к пассивации в агрессивных окисляющих средах, хотя сами эти металлы достаточно активны. Кроме того, различные модификации одного и того же простого вещества могут заметно различаться по химической активности (например, белый и красный фосфор). Таким образом, химические свойства простых веществ представляют собой единство атомной, молекулярной и кристаллической форм химической организации со всеми характерными для них особенностями. [c.249]
Кроме выделения, определения и характеристики компонентов древесины, анализ древесины включает также установление элементного состава последней. Древесные породы различаются по элементному составу весьма незначительно и в среднем содержат 50 % углерода, 43 % кислорода и 6 % водорода. Остальную часть составляют азот, входящий в состав белков (0,1—0,3 %) [147], и неорганические элементы, образующие при сжигании золу (см. 3.2.5). В атомных единицах состав древесины соответствует 47 атомам водорода, 28 атомам углерода и 24 атомам кислорода на каждые 100 атомов. [c.45]
Органическая масса всех видов твердых горючих ископаемых гетеромолекулярна, поскольку она сложена из большого количества различных молекул, образованных атомами углерода, кислорода, серы, азота и других элементов, которые обусловливают все многообразие ископаемых топлив. Важной характеристикой этих природных веществ является их элементный состав, выражаемый либо в единицах массы, либо в виде атомных соотношений. [c.39]
Одной из основных характеристик ядерных свойств изотопов является их способность вступать в различные ядерные реакции, под которыми понимаются процессы превращения атомных ядер при их взаимодействии с какими-либо частицами (в том числе и с гамма-квантами) или друг с другом. В ядерной физике запись реакции принято производить в виде А (а, б) В, где а — налетающая частица, Ь — вылетающая частица, А — ядро мишени, В — ядро-продукт (или конечное ядро). Например, первую ядерную реакцию, осуществлённую в 1919 году Резерфордом, бомбардировавшим ядра азота альфа-частицами и в результате которой вылетал протон, а азот превращался в кислород, можно записать следующим образом N(0 , р) 0. Если речь идёт об общем типе реакции, безотносительно к частному виду мишени, то запись производится и в такой форме (р,р), (7,1 ), (т, [c.24]
Совместное рассмотрение характеристик карбидов и нитридов оправдано подобием их структур и свойств. Среди всех соединений, образуемых атомами переходных металлов и легких элементов (Н, 13, С, N и О), только карбиды и нитриды имеют близкие по типам кристаллические структуры, фазовые соотношения, типы связи, электрические и магнитные свойства. Такая близость между карбидами и нитридами переходных металлов легко объясняется подобием их электронной структуры, размеров и электроотрицательностей атомов углерода и азота. Этого не наблюдается в случае боридов переходных металлов, для которых характерны атомные связи бор—бор, на что указывает сближенное расположение атомов бора в их кристаллической структуре. [c.10]
Описан атомно-абсорбционный метод определения 0,2— 20 мкг/мл фторида [172]. Фторид снижает абсорбционные характеристики магния в воздушно-ацетиленовых пламенах, изменение интенсивности поглощения линии магния (285,2 нм) пропорционально концентрации фторидов. Основными мешающими ионами являются сульфат и фосфат алюминий, лантан, оксалат и ацетат также мешают определению фторидов. Этот метод экспресснее двух упомянутых выше и может быть использован без предварительного отделения фторида. Один из вариантов этого метода основан на увеличении поглошения циркония в пламени оксида азота(I)—ацетилен в присутствии фторида (5—200 мкг/мл), число мешающих ионов невелико. В аналогичном методе, основанном на увеличении поглощения титана в том же пламени в присутствии фторида (40—400 мкг/мл), присутствие фосфата и сульфата не мешает определению фторида. [c.360]
Характеристика системы Гмелина и ее отношения к системе атомных весов Берцелиуса (с учетом поправок Реньо) настолько удачна и лаконична у Канниццаро, что мы приведем его собственные слова Система атомных весов, принятая благодаря Гмелину и называемая другими системою эквивалентов, в главных чертах своих была не что иное, как система Дальтона, Томсона, Уолластона, Праута, т. с. от системы Берцелиуса и Реньо она отличалась только тем, что рассматривала в качестве атомных единиц количества водорода, хлора, брома, иода, фтора, азота, фосфора, мышьяка, сурьмы, калия, натрия, лития, серебра, которые в системе Берцелиуса принимались за 2 атома. Если принимать атом кислорода за единицу атомных весов, то в системе Гмелина атомные веса перечисленных элементов вдвое больше тех, которые приведены в таблице Берцелиуса и Реньо атомные же веса (называемые также молекулярными) соединений одинаковы в обеих системах... Если же за единицу атомных весов принимать атом водорода, то, так как в системе Гмелина атомный вес водорода вдвое более принятого Берцелиусом, атомные веса всех элементов, как отнесенные к вдвое большей единице, выразятся числами наполовину меньшими, чем у Берцелиуса, за исключением атомных весов хлора, брома, иода, фтора, азота, фосфора, мышьяка, серебра, калия, натрия и лития, которые выразятся теми же числами, как у Берцелиуса, но, однако, будут иметь вдвое большее значение, так как единица, к которой они отнесены, вдвое больше [82, стр. 253—254]. [c.68]
В органических молекулах несвязывающие электроны (п-типа) расположены главным образом на атомных орбиталях азота, кислорода, серы и галогенов. Такие элементы часто присутствуют в молекулах в форме полярных групп, например —ОН, —5Н, —КНг, —ОСНз, —С1, —Вг, —I. Хотя некоторые полярные группы поглощают излучение и с большей длиной волны, перечисленные группы обычно поглощают в различной степени в далекой ультрафиолетовой области (переходы п—>-а ) и не влияют на поглощение, характерное для других групп. Однако в случае, когда полярные группы расположены соответствующим образом по отношению к хромофорным группам, происходит значительное изменение характеристик поглощения хромофора. Тогда эти группы называют аук-сохромами. [c.138]
Наиболее распространенным методом утилизации ОСМ (до 90% от их сбора) до сих пор остается сжигание — либо с целью простого уничтожения, либо (что осуществляется чаще) при использовании в качестве котельно-печного топлива или его компонента. Поэтому для характеристики антропогенного загрязнения атмосферы важен также анализ продуктов сгорания ОСМ. Рассмотренные выше исследования португальского института ШЕТ1 проводились в горизонтальной многосекционной печи с термической мощностью 240 кВт [170]. В табл. 2.12 и 2.19 представлены характеристики отработанных масел и условия их сжигания. Определение общего содержания металлов и их распределения как функции размера частиц возможно методом атомно-абсорбционной спектроскопии установка газоанализатора на линии выхлопа позволяет оценить содержание кислорода, оксида и диоксида углерода, оксидов азота и диоксида серы содержание хлора и брома определяется методом периодического поглощения их раствором кальцинированной соды с последующим потенциометрическим титрован ие.м. [c.100]
Характеристика элементов VA-группы. Элементы VA-группы в периодической системе расположены справа от границы Цинтля. В соответствии с этим положением в химическом отношении они являются типичными анионообразователями. Однако с увеличением атомного номера неметаллические свойства элементов заметно убывают. Так, азот и фосфор относятся к типичным неметаллам, мышьяк и сурьму обычно называют полуметаллами или иногда металлоидами (металлоподобными), а висмут уже в значительной мере проявляет металлические свойства. Еслн учесть, что в компактном состояни[1 и мышьяк, и сурьма, и висмут обладают металлической проводимостью (отрицательный температурный К0э(1х )ициент электрической проводимости), то становится понятным, почему эти три элемента целесообразно рассматривать в рамках химии металлов. [c.282]
Хотя рентгеновский микроанализ может быть определенным и точным, свойства биологических материалов часто приводят к ограничению точности анализа величиной, составляющей +10 отн. % истинного значения. Такая неопределенность обусловлена тем, что биологические материалы являются далеко не идеальными образцами, имеют различную геометрию и шероховатость поверхности, часто для их приготовления используются сомнительные методы, и они могут явиться эффективным источником загрязнений чистой в других отношениях окружающей среды. Другая проблема, специфическая для количествен-lioro анализа биологических систем, заключается в том, что большинство элементов в образце, например углерод, кислород, азот и водород, трудно точно измерять. В отличие от анализа в материаловедении в большинстве случаев использования рентгеновского микроанализа в биологии требуется измерить концентрацию элементов (2>10), содержащихся в малом количестве в плохо известной органической матрице. Следует также напомнить, что рентгеновские спектрометры регистрируют только вышедшее рентгеновское излучение, а оно не всегда полностью соответствует рентгеновскому излучению, генерируемому в образце. Эта проблема усугубляется тем, что в биологических материалах электроны проникают более глубоко, вследствие чего возрастает поглощение генерируемого рентгеновского излучения. Попытки впоследствии скорректировать поглощение затрудняются отсутствием полной характеристики органической матрицы и точных значений массовых коэффициентов поглощения для элементов с низкими атомными номерами. Поэтому центром обсуждения этого раздела являются поправки, которые можно ввести, чтобы сузить разрыв между численными значениями интенсивностей рентгеновского излучения, генерируемого в образце, и регистрируемого и измеряемого. Рассмотрение вопроса, что меряет рентгеновский микроанализатор в биологических системах [179], показывает, что [c.69]
Выход ГМК значительно ниже, чем ГУК, и состааляет 7,3—14,9% ГМК имеют более высокое содержание углерода и водорода, чем ГУК и сами исходные гуминовые кислоты Для них характерно более низкое содержание серы, кислорода и отсутствие азота Атомные отношения С/Н этих фракций также более низкие Закономерности изменения этой характеристики позволяют предположить снижение степени конденсированности ароматических фрагментов ГМК, увеличение в их составе доли гидроароматических и нафтеновых структур, повышение степени замещенности ароматических структур [c.371]
Характеристика шарового фантома МКРЕ шар диаметром 30 см химический состав фантома эквивалентен составу мягкой ткани (массовая доля химических элементов, % кислород — 76,2 утлерод — 11,1 водород — 10,1 азот — 2,6) плотность — 1000 кг/м эффективный атомный номер 2эфф = 6,5. [c.23]
Хотя газы имеют более низкие атомные номера, чем серебро, а следовательно, и более низкую рассеивающую способность, тем не менее можно легко получить дифракционную характеристику отдельного монослоя газа (кроме водорода) на поверхности твердого тела, если только, как это обычно и бывает [5], атомы газа образуют решетку, несколько отличную от решетки твердого тела. Если атомы газа в поверхностном монослое образуют ту же самую решетку, что и кристалл-носитель, то присутствие атомов газа можно обнаружить, когда расстояние между поверхностным монослоем и атомной плоскостью кристалла отличается от расстояния между двумя соседними атомными плоскостями (в твердом теле-носителе) с такими же мнллеровскими индексами. Примером может служить хемосорбция кислорода и азота на гранях (0001) поверхности титана [6]. Присутствие газа на поверхности может быть обнаружено в столь малых количествах, как несколько процентов от одного монослоя. Если адсорбированы два или более монослоев газа, то внешний слой является аморфным, и он может сделать совершенно невозможным наблюдение дифракционного рассеяния от расположенного под ним кристалла. Поэтому обычно для того, чтобы наблюдать дифракцию, необходимо тщательно очистить твердую поверхность в высоком вакууме путем нагревания или другим способом. Например, на медном кристалле нельзя получить какой-либо дифракционной картины после простого нагревания всей трубки при 300—400°. На некоторых кристаллах даже первый монослой газа имеет аморфную структуру. В этом случае единственным доказательством наличия адсорбированного газа является уменьшение интенсивности дифракционного потока от кристалла -носи-теля. [c.321]
В некоторых я-электронных системах вклад ст-составляющей пренебрежимо мал по сравнению с вкладом я-составляющей. Дипольный момент о-составляющей можно представить в виде суммы дипольных моментов отдельных ст-связей, для которых в литературе имеются табулированные значения. При этом не следует забывать о вкладах несвязывающих атомных орбиталей — неподеленных электронных пар (например, на атоме азота в пиридине или на атоме кислорода в карбонильных соединениях), которые имеют большее значение, чем дипольные моменты ст-связей. Известно, что подстановка плотности я-электронов, найденной методами МОХ или ССП, в выражение для дипольного момента приводит к завышенным значениям. Правильные значения (л получаются, если для расчета электронных плотностей используется метод, в котором значения а (или =) зависят от зарядов в соответствующих положениях. Это имеет место при применении со-техники (модифицированный метод МОХ) или метода ВЭ ССП (модифицированный метод ССП с варьированием электроотрицательностей, ВЭ). Хорошие результаты дают также методы, в которых явно учитываются ст-электроны. Однако в таком случае простое выражение (11.64) должно быть заменено более сложным. Добавим, что во многих случаях удалось достичь особенно хорошего согласия с экспериментом при помощи метода ППДП/2 отклонение вычисленных физических характеристик от экспериментальных данных составляло 10%, [c.314]
Характеристика элемента. Элемент I группы периодической системы. Атомный номер 1. Состоит из двух устойчивых изотопов легкого В. ( Н), или протия, и тяжелого В. ( Н), или дейтерия (D). В природных соединениях на один атом D приходится в среднем 6 800 атомов Н. Искусственно получен -pa-диоактивный изотоп — сверхтяжелый В. ( Н), или тритий (Т). В природе Т образуется из атмосферного азота под действием нейтронов космических лучей в атмосфере его ничтожно мало — 4 10- 5 % от общего числа атомов В. При обычных условиях В. существует в виде двухатомных молекул Нг. [c.15]
Коксообразование. При осуществлении всех реакций углеводородов на кислотных катализаторах образуется углеродистый материал, называемый коксом, который пе десорбируется с поверхности при обработке катализатора азотом или паром. Этот материал имеет атомное отношение водорода к углероду от 0,3 до 1,0 и спектроскопические характеристики, аналогичные таковым для ароматических соединений. Выполнены обширные исследования кокса, паиравлеиные на установление его химического строения, природы, влияния иа диффузионные свойства и активность катализатора. [c.109]
Для дальнейшего развития хроматоскопического метода определения параметров структуры молекул на основе экспериментальных значений константы Генри для адсорбции как на ГТС, так и на цеолитах и других однородных адсорбентах необходимо прежде всего значительно повысить точность экспериментальных определений этих констант, а также других термодинамических характеристик адсорбции при нулевом заполнении — теплот адсорбции и теплоемкостей адсорбционных систем. Это позволит уточнить параметры полуэмпирических атом-атомных потенциальных функций, необходимых для моле-кулярно-статнстических расчетов констант Генри, а также расширить возможности хроматоскопического метода и повысить точность и однозначность определенных с его помощью молекулярных параметров. Необходимо определение атом-атомных потенциальных функций для адсорбции на ГТС не только для углеводородов, но и для их производных, содержащих галогены, кислород, азот, серу и другие элементы в разных валентных состояниях. [c.210]
Способы использования простых характеристик кристалла для структурного анализа были развиты Коулеем и Рисом [22]. В этой работе применяли метод Фурье. Результаты представляли собой распределение потенциалов, которое графически можно изобразить или на плоскости, или в пространстве. Трудности проведенця точных измерений интенсивности более значительны, чем при рентгеноструктурном анализе. Для получения удовлетворительных результатов необходимо вводить точные поправки на вторичное рассеяние. Имеется также значительная неопределенность формы кривых атомного рассеяния электронов. Однако из сказанного выше ясно, что метод дифракции электронов является значительно более результативным, чем метод дифракции рентгеновских лзшей, при обнаружении легких атомов в присутствии тяжелых, например атомов водорода в органических молекулах или углерода, кислорода и азота в соединениях, содержащих свинец или платину. [c.58]
Перечисленные законы наводят на мысль о реальном существовании атомов и молекул. Закон постоянства состава указывает на способность атомов элемента присоединять к себе не любые, а определенные числа атомов другого элемента. Законы эквивалентов и кратных отношений основаны на той же характеристике атомов, причем особенно становится наглядным, что атомы входят в реакцию как целые частицы. Действительно, написав формулы пяти окислов азота, о которых шла речь выше, в современной форме КгО, N0, МгОз, КОг, N265, — мы сразу заметим, что если в первом случае на а г азота приходится Ь г кислорода, то во втором 2 Ь, в третьем — 3 Ь, в четвертом — 4 6, в пятом — 5 6. Здесь,однако,нужно обратить внимание на то, что сами химические формулы веществ могли быть выведены только на основе атомно- [c.10]
Таким образом, аргон должно определить как особый газ, отличающийся беспримерною (до его открытия) химическою недеятельностью, но совершенно определенный по физическим свойствам, из которых должно также обратить внимание на самостоятельность спектра аргона. А так как самостоятельными спектрами обладают преимущественно (гл. 13) тела простые, то аргон принято считать в их числе, хотя главной характеристики простых тел, т.-е. самостоятельных и своеобразных соответственных соединй ний, для аргона неизвестно. Однако, можно умственно допустить и такой разряд элементов, который не соединяется ни с водородом, ни с кислородом для образования кислотных или основных веществ, так как известны многие элементы, не соединяющиеся с водородом, а фтор не соединен с кислородом, — для образования солеобразных веществ. Если же это так, то мы имеем право образовать особую группу — аргоновых элементов, причисляя к ней гелий Не, неон Не, аргон Аг, криптон Кг и ксенон Хе, не только потому, что они друг друга сопровождают при азоте воздуха и представляют полное между собою сходство—по своей инертности или неспособности вступать известными нам способами в соединения, более или менее сходные с основаниями, кислотами или солями, но также и потому, что эта группа аргоновых элементов совершенно сходна (даже по величине атомных весов) с другими наиболее характерными группами элементов, о чем подробнее говорится в главе 15. [c.170]
С ( / ) 4-О / ) должно быть ясно, что, несмотря на сходство различных состояний изоэлектронных молекул, соотношения между молекулярными и атомными состояниями могут сильно различаться. Этот факт особенно заметен при сравнении диссоциации N3 и СН. Атом азота, обладающий конфигурацией 1 2 2/> , имеет, как видно из предыдущего, три низколежащих энергетических состояния, а именно 8 и соответственно этому имеется три низколежащих энергетических состояния атомарного иона азота Н+, т. е. 2х 2р , которым соответствуют термы Рд, 8д, анэлогичные трем состояниям атома углерода, обладающего той же самой электронной конфигурацией. Число возможных состояний молекулярного иона азота Н , образованного путем этих комбинаций атомных состояний, очень велико. Однако вероятно, что более низкие энергетические состояния Н получаются из низших атомных состоянихг, которые теоретически способны давать молекулярные состояния, имеющие соответствующие характеристики. Комбинация низшего состояния атома азота с низшим состоянием атомарного иона ( Р ) азота может давать двенадцать молекулярных состояний, а именно [c.329]
В разд. 4 этой главы было показано, что термодинамические характеристики адсорбции на ГТС при Г—>-0 являются аддитивными функциями по атомам также и для галоген- и кислородсодержащих производных углеводородов. Таким образом получены опорные экспериментальные данные для нахождения соответствующих атом-атомных потенциальных функций фна1...с и фо...с. В последнем случае должны быть найдены различные параметры атом-атомной функции для атомов кислорода в молекуле, находящихся в разных электронных конфигурациях (в разных кислородсодержащих функциональных группах). Аналогичная работа ведется для различных производных углеводородов, содержащих азот. [c.86]
Молекулярно-статистический расчет термодинамических характеристик удерживания цеолитами. Такие расчеты производились Киселевым, Лопаткиным и их сотрудниками пока только для молекул благородных газов [179, 180], некоторых алканов [179, 181—183а], азота и двуокиси углерода [184], цикланов и этилена. Строение пористых кристаллов цеолитов много сложнее строения атомного кристалла графита, поэтому расчеты потенциальной функции межмолекулярного взаимодействия и конфигурационных интегралов в случае цеолитов много сложнее. Наиболее детально модель молекула — цеолит X и была разработана в работах [180, 183]. В работе [180] потенциальную энергию взаимодействия молекул благородных газов с решеткой пористого кристалла цеолита NaX определяли во многих точках внутри полости цеолита при перемещении молекулы благородного газа от центра полости к ее стенке. Далее проводили числовое интегрирование полученных потенциальных кривых, необходимое для расчета термодинамических характеристик межмолекулярного взаимодействия молекул с решеткой цеолита методами молекулярной статистики. По рассчитанным таким путем конфигурационным интегралам определяли величины Ут, (константы Генри в расчете на 1 г цеолита), а также дифференциальные мольные изменения внутренней энергии и теплоемкости адсорбированного вещества для малого (нулевого) заполнения цеолита при разных температурах. [c.89]
Следующая (и единственная) дата — 26 октября 1870 г.— сделана на записи, посвященной характеристике питротел и азотистых эфиров и атомности фосфора и азота (см. т. XIII, стр. 802). К ней как ее прямое продолжение примыкает заиись под заглавием Нитросоединения и азотистый эфир , сделанная в Дневнике на стр. (4), т. е. в промежутке между 27 ноября 1870 г. и 1 января 1871 г. (дата, стоящая на стр. 6 Дневника). Все это дает повод заключить, что Дневник, начатый Д. И. 27 ноября 1870 г., является продолжением тех записей, которые до этого Д. И. делал на отдельных листочках, вклеенных уже в 1-е изд. Основ химии , или вклеиваемых туда позднее этим, в частности, можно объяснить, что в [c.626]
Были изучены некоторые структурные характеристики молекулы трифторида азота. Непрямые электро1юграфические исследования указывают, что межатомное расстояние N—F составляет 1,37 A, а угол F—N—F равен 102,5° [4]. Спектр поглощения в инфракрасной области с максимумами, соответствующими 505, 908 и 1 004 смГ , был интерпретирован при условии,, что молекула NFg представляет собой плоскую пирамиду с углом между" связями больше 110°, межатомным расстоянием N—F 1,45 А и константой колебания связи N—F, равной 410 dunj M [2]. Ни одна из этих моделей не может объяснить очень низкой диэлектрической постоянной трифторида азота, равной 1,001275 при 760 мм, которая практически не отличается от диэлектрической постоянной четырехфтористого углерода (1,001250), имеющего структуру симметричного тетраэдра [233]. Измерения показателя пре-, ломления при 25° и 760 мм для равных длин волн в интервале между 4 300 и 6 500 к показывают, что значение электронной поляризации для NF лежит между соответствующими значениями для тетраэдрической молекулы F4 и плоской молекулы BF3, а значение атомной поляризации для NFg— ниже соответствующих значений для каждого из этих соединений [234J. Температура кипения NFg (—129°) ниже температуры кипения F4 (—128°) и BFg (—100°), что также свидетельствует о низкой полярности NFg. Иа сказанного следует, что это интересное соединение нуждается в дальнейших исследованиях. [c.78]
Следует признать благоприятным тот факт, что определенные молекулярные колебания концентрируются в некоторой части или группе атомов молекулы. Такие групповые частоты эффективно проявляются спектроскопически, особенно когда атомные массы, участвующие в колебаниях, сильно отличаются одна от другой. Но этому не вполне удовлетворяют (РКС1а)з и (РЫС12)4, где хлор и фосфор имеют сравнимые атомные массы, а масса атома азота составляет приблизительно одну треть каждой из них. В этом случае от корреляции групповой частоты нельзя было бы многого ожидать, если бы не было известно, что колебания циклического остова имеют ярко выраженные групповые характеристики. [c.295]
Если рассматривать наиболее употребительные числа для атомных рефракций, то бросается в глаза, что для углерода, водорода и галогенов в таблице имеется только одно значение, в то время как другим элементам в зависимости от характера связи соответствуют различные значения рефракции. Двойная и тройная связи между двумя атомами углерода учитываются не в виде особой величины для двукратно- и трехкратносвязанного углерода для характеристики этой величины вводится особый инкремент, который прибавляется к значению для однократносвязанного углерода. Что же касается кислорода и азота с двойной связью, то, поскольку для этих элементов Приходится пользоваться различными эквивалентами рефракции даже При простой связи, от особых инкрементов отказываются и пользуются Просто разными величинами для карбонильного кислорода, для азота с двойной связью С =N в оксимах и т. д. Для трех- и четырехчленных колец вводят также инкременты (+ 0,7 и + 0,4). [c.148]
chem21.info
Чему равна масса 2 л азота при
Данные таблицы 15 показывают, что равные количества азота, внесенные в тонкий песок типа Леон в форме мочевины или безводного аммиака, одинаково влияют еа нитрификацию. По данным других исследователей [51, 76, 79, 80, 82, 87], содержание аммиака в центре зоны его внесения в почву было достаточно высоко, чтобы оказывать токсическое действие на нитрифицирующие бактерии. Образование нитратов происходит от периферии массы насыщенной почвы к ее центру по нисходящей линии. По мере течения процесса нитрификации pH снижается и весь аммиак полностью превращается в нитраты. [c.68]
Приведенные данные показывают, что общая масса жидких УВ составляет лишь малую долю рассеянного ОВ. Общая масса газов в осадочных породах равна по расчетам В. А. Соколова (1966 г.) 21,4-10 3 т, из них 4,3-Ю з т метана, 9,3-10 т углекислого газа и 7,7-10 3 J азота. На долю горючих газов, сосредоточенных в газовых, нефтегазовых и каменноугольных ме- [c.128]
Масса моля газа Б, равная 28 г, может относиться либо к оксиду углерода (II), либо к азоту, однако из условия задачи известно, что таз Б химически малоактивен, что более соответствует азоту. Оксид углерода (II) является хорошим восстановителем и входит в состав газообразного топлива. Таким образам, газ Б —N2. [c.178]
Пример 2. Определить молекулярную массу азота, если известно, что его плотность относительно водорода равна 13,89. [c.23]
Стабильные изотопы используются в качестве меченых атомов гораздо реже, чем радиоактивные изотопы. Тем не менее было опубликовано значительное число работ, в которых использовались образцы, содержащие избыточное, по отношению к нормальному, количество одного из стабильных изотопов. В некоторых химических исследованиях важно применение именно стабильных изотопов. Это касается работ, связанных с кислородом или азотом, так как у этих элементов нет подходящих радиоактивных изотопов. Периоды полураспада наиболее долгоживущих изотопов кислорода ( Ю) и азота ( N) равны соответственно 2,1 и 10,1 мин. Естественно, что это время слишком мало для их практического применения в работе, включающей, например, органическую препаративную часть. Тритий редко используется в качестве меченого атома, потому что его масса очень отличается от массы водорода. Кроме того, энергия -частиц, которые он эмитирует при распаде, равна лишь 18 кэв. [c.82]
Применяя вместо чистого углерода каменный уголь , можно синтезировать продукты с гораздо более высокой молекулярной. массой. Получаются также газообразные вещества, причем при определенных условиях можно добиться образования только газообразных продуктов. Если смешать каменный уголь с алюминиевой стружкой, нагреть эту смесь до 370 °С и пропускать через нее смесь трехфтористого хлора с азотом, получаются тяжелое масло в количестве, равном массе угля, густая смазка (5%) и твердая термопластичная смола (5%). Масло содержит менее 2% хлора и, по данным анализа, представляет собой соединение состава Ср1,8. Это обстоятельство, как и то, что результаты трудно воспроизводимы (по-видимому, образование высокомолекулярных продуктов зависит от состояния металлической поверхности аппарата) доказывает, что основным процессом является образование и полимеризация тетрафторэтилена. Масло перегоняется в пределах от 100 (при атмосферном давлении) до 250°С (при остаточном давлении 20 мм рт. ст.), причем остается немного твердого остатка. [c.73]
Доказав, что молекулы как азота, так и кислорода двухатомны и найдя с помощью взвешивания равных объемов газов отношение весов кислорода и азота равным примерно /у, т. е. 2/г8, мы легко убеждаемся, что при массе О, равной 16, масса N может быть только 14, но никак не 28 и не 7. Таким образом, твердо устанавливается набор формул [c.130]
В метане, например, приблизительно 98,9% молекул содержат и 1,1% содержат в том же отношении будут находиться интенсивности частиц с молекулярным весом 16 и 17, что подтверждается масс-спектром метана. Этан имеет вдвое больше шансов содержать i , т. е. приблизительно 2,2% всех молекул будут иметь молекулярный вес, равный 31. В общем случае этот изотопный пик будет всегда составлять приблизительно 1,1% на каждый атом углерода в частице, ответственной за моноизотопный пик (см. пик т/е 55 на рис. 42в). Если в исследуемом соединении содержится также и азот, то следует добавить [c.327]
Определение атомных масс. Валентность. Закон Авогадро позволяет определить число атомов, входящих в состав молекул простых газов. Путем изучения объемных отношений при реакциях, в которых участвуют водород, кислород, азот и. хлор, было установлено, что молекулы этих газов двухатомны. Следовательно, определив относительную молекулярную массу любого из этих газов и разделив ее пополам, можно было сразу найти относительную атомную массу соответствующего элемента. Например, установили, что молекулярная масса хлора равна 70,90 отсюда атомная масса хлора равняется 70,90 2 или 35,45. [c.31]
Пример. Анализом окиси азота и двуокиси азота установлено, что эквивалент азота в первом соединении 7, во втором —3,5. Атомная масса азота — величина постоянная — 14. Следовательно, валентность азота в окиси азота равна 14 7 = 2, а валентность азота в двуокиси азота равна 14 3,5 = 4. [c.28]
В качестве газообразных веществ выберем водород и азот. Напомним, что молекулярная масса водорода равна 2, а азота — 28. [c.39]
Написав левую и правую части, необходимо уравнять коэффициенты перед формулами. Известно, что суммарная масса веществ, вступивших в реакцию, должна быть равна массе всех веществ, получившихся в результате реакции. Это означает, что число атомов одного и того же элемента в правой и левой части уравнения должно быть одинаковым, независимо от того, в состав какого вещества этот элемент входит. Сначала уравнивают число атомов углерода, затем водорода, потом кислорода. Множитель перед коэффициентом (3,76), поставленный у молекулы азота, всегда будет равен коэффициенту перед кислородом. Уравнение реакции будет иметь вид [c.6]
Принимая во внимание, что атомные массы равны (округленно) для натрия 23, азота 14 и кислорода 16, находим, что в молекуле данного вещества приходится по массе на долю натрия 23х, на долю азота — 14г/ и на долю кислорода 1б2. [c.61]
Максимальное число положительных зарядов, которое может приобрести атом таким путем, естественно, не может превышать число содержащихся в нем электронов. Тяжелые атомы не отдают всех своих электронов так, в каналовых лучах азот появляется в виде ионов с 1, 2, 3. . . положительными зарядами. Ионы водорода в газообразном состоянии никогда не имеют заряда больше 1, как бы велико ни было напряжение на вводах катодной трубки, а заряд ионов гелия не превышает 2. Отсюда следует, что атомы водорода содержат только один электрон, а атомы гелия — два электрона. Следовательно, ионы водорода, называемые протонами, являются ядрами Н+, а ионы гелия — ядрами Не + и не имеют электронов. Масса этих ионов отличается от массы исходных атомов лишь на очень небольшую величину, равную массе отданных электронов. [c.66]
Определение молекулярной массы на основании массы единицы объема газа. Предположим, что опытным путем найдена масса 1 л азота при нормальных условиях она равна 1,25 г. Умножив эту массу на 22,4 л, находим грамм-молекулярную массу 1,25-22,4 = 28 (г). Отсюда, молекулярная масса азота равна 28. С другой стороны, можно делением грамм-молекулярной массы на 22,4 л определить массу 1 л газа при нормальных условиях. Обычно опытным путем находят объем того или иного количества газа при каких-то других условиях, а не при нормальных и затем по уравнению [c.29]
Требуется введение дополнительной массы азота с Nh5NO3 с учетом того, что относительное его содержание в смеси по условию равно 1 (т. е. 61,7 кг) [c.188]
Бериллий по свойствам сходен с алюминием. Поэтому химики считали, что он трехвалентен. Умножая эквивалент на три, находили, что атомная масса его равна 13,9 . Элемент с такой массой должен был бы в периодической системе занять место между неметаллами углеродом и азотом. Но тогда закономерного изменения свойств от металлических к неметаллическим в приведенном выше ряду элементов не наблюдалось бы. Д. И. Менделеев уменьшает принятую для бериллия атомную массу примерно на одну треть, считая ее равной 9,4, и ставит этот элемент между литием и бором. [c.95]
Количество всех этих веществ, выкипающих в пределах до 300—350° С, как правило, невелико и зависит от общего содержания кислорода, серы и азота в нефти. Здесь надо иметь в виду, что основная масса кислорода, серы и азота концентрируется-в высокомолекулярной части нефти. Однако при заводской перегонке, например сернистой нефти, вследствие термического разложения сложных гетероатомных соединений, в товарных светлых нефтепродуктах может накопиться значительное количество низкомолекулярных сернистых соединении (10% и более). Надо учитывать, что в сернистых, кислородных и азотистых соединениях сера, кислород и азот связаны с различными углеводородными радикалами, и на одну весовую часть этих элементов приходится 10—20 частей углерода и водорода. Так, например, если средний молекулярный вес фракции 320, содержание серы 1%, а в молекуле сернистого соединения только один атом серы, то в такой фракции содержание сернистых соединений равно 10%. [c.15]
Основываясь на правиле простоты, Дальтон начал с ошибочного предположения, что вода имеет двухатомную формулу НО. Вследствие этого атомная масса кислорода оказалась равной его соединительному весу 8 (относительно 1 для водорода). Затем он обратился к оксидам углерода и азота возможные варианты их предполагаемого состава приведены в табл. 6-2. (Все атомные массы, привлекаемые нами для последующих рассуждений, основаны на достоверных экспериментальных данных, а не на данных, которыми пользовался Дальтон. Он был удивительно плохим экспериментатором. Например, атомная масса кислорода, по его собственным данным, сначала составляла 6,5, а затем он постепенно изменял ее до [c.281]
РЬСН2СН2КгМез равна 1,009 [52]. Следовало ожидать, что фе-нильная группа должна сдвигать реакцию в сторону механизма Е1сВ это означает, что для данного соединения связь С—N в переходном состоянии не так сильно разрывается, как в соответствующем незамещенном субстрате. Изотопный эффект это подтверждает, так как он показывает, что в фенилзамещен-ном соединении масса азота оказывает меньшее влияние на скорость реакции, чем в незамещенном соединении. Аналогич- [c.23]
Азот в природе и его получение. Содержание азота в земной коре в виде соединений составляет 0,01 масс, доли, %. Атмосфера более чем на 75 масс, долей, % состоит из газообразного азота, что равно 4 10 т. Связанный азот образует минералы в форме нитратов чилийская МаКОз, индийская ККОэ и норвежская Са(КОз)2 селитры. Азот в форме сложных органических производных входит в состав белков, в связанном виде содержится в нефти (до 1,5 масс, доли, %), каменных углях (до 2,5 масс, доли, %). [c.397]
При эксплуатации установок гидрокрекинга необходимо учитывать, что в одном и том же температурном диапазоне скорости гидрокрекинга и деасфальтизации зависят от температуры в большей степени, чем глубина обессеривания ([183]. Следует также иметь в виду, что в этом процессе образуются токсичные карбонилы никеля, кобальта и >10либдена [10, 184]. Из них наиболее токсичен №(С0)4 его допустимая концентрация при восьмичасовой работе равна 10 % (масс.). Карбонилы N1 и Мо разрушаюГся при 48 и 149 °С соответственно. В результате выделяется окись углерода, что создает большую опасность для работающих на установке. Поэтому выгрузку катализатора, не прошедшего регенерацию, рекомендуется проводить в следующем порядке прекращать подачу сырья и пропускать через катализатор водо- род или водяной пар для отпарки углеводородов, после чего выключить подогреватель сырья и охлаждать катализатор в токе водорода, азота или водяного пара прекратить подачу пара при достижении температуры катализатора 150°С продуть катализатор азотом не прекращая подачи азота, выгружать катализатор в железные бочки, закрывая их сразу после заполнения. [c.283]
Во втором эксперименте N0 заменяют смесью равных количеств азота и кислорода. Количество Р2О5, полученное за 10,00 мин, эквивалентно 2,123 г Н3РО4. Наблюдаемый прирост температуры составляет 2,398° С, а поправка на охлаждение 0,032° С. Поправка на теплоту перемешивания равна 12,2 кал/мин. Масса воды та же, что и в первом эксперименте. Чему равна энтальпия образования N0 [c.46]
В метане, например, приблизительно 98,9% молекул содержат и 1,1% содержат в том же отношении будут находиться интенсивности частиц с молекулярным весом 16 и 17, что подтверждается масс-спектром метана. Этан имеет вдвое больше шансов содержать i , т. е. приблизительно 2,2% всех молекул будут иметь молекулярный вес, равный 31. В обш ем случае этот изотопный пик будет всегда составлять приблизительно 1,1% на каждый атом углерода в частице, ответственной за моноизотопный пик (см. пик mie 55 на рис. 42е). Если в исследуемом соединении содержится также и азот, то следует добавить 0,36% на каждый его атом. Тетралин (С оН з мол. в. = 132) дает пик при mje 133, интенсивность которого составляет приблизительно 11 % от интенсивности пика при mie 132. Инданон ( gHgO) имеет тот же молекулярный вес, но содержит только девять атомов углерода в этом случае пик с mie 133 будет составлять только 9,9% от интенсивности пика при mie 132. Поскольку в масс-спектре интенсивность даже очень малых пиков может быть измерена с очень большой точностью и воспроизводимостью, такие измерения можно использовать для получения определенной информации о составе частиц. Однако следует обратить внимание на тот факт, что наличие небольших количеств загрязнений или ионно-молекулярные столкновения (см. стр. 312) могут привести к увеличению интенсивности пика, расположенного на одну единицу массы выше молекулярного веса. Поэтому более убедительны случаи, когда изотопный пик расположен ниже вычисленного, чем наоборот. Аналогично можно использовать пик (М + 2), частично обусловленный наличием двух атомов а частично — присутствием 0. [c.327]
Метод Авогадро. Путем изучения объемных соотношений газов, вступающих в реакцию, и полученных газообразных продуктов определяют число атомов в молекуле, а затем делением молекулярной массы на это число находят атомную массу элемента. Например, при взаимодействии одного объема азота и одного объема кислорода получается два объема окиси азота. Эти данные показывают, что молекула азота (как и молекула кислорода) двухатомна. Молекулярная масса азота равна 28, а отсюда, атомная масса его равна 14. [c.31]
Во втором оксперименте N0 заменяют смесью равных количеств азота и кислорода. Количество Н3РО4, полученное за 10,00 ман, составляет 2,123 г, наблюдаемый подъем температуры 2,398 град и поправка на охлаждение 0,032 град-, поправка на теплоту перемешивания 12,2 кал ман-, масса воды та же, что и в первом эксперименте. [c.97]
Пусть в смеси массой т содержатся нитрат калия и нитрат аммония, массы которых обозначим т (КЫОз) и т (ЫН4ЫОз) (рис. 7). Составим уравнение, учитывая, что масса азота в смеси равна сумме масс азота в нитрате калия и нитрате аммония, [c.19]
Водородная связь. Еще в XIX веке было замечено, что соединения, в которых атом водорода непосредственно связан с атомами фтора, кислорода и азота, обладают рядом аномальных свойств. Это проявляется, например, в значениях температур плавления и кипения подобных соединений. Обычно в ряду однотипных соединений элементов данной подгруппы температуры плавления и кипения с увеличением атомной массы элемента возрастают, Это объясняется усилением взанмиога притяжения молекул, чтб связано с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними (см. 48). Так, в ряду H I—НВг—HI температуры плавления равны, соответственно, [c.154]
Из данных по синтезу КНз при бомбардировке смеси авота и водорода электропами заданной энергии следует, что минимальная энергия электронов, необ.ходимая для образования аммиака, равна 17 эв. Вследствие близости этого числа к потенциалу ионизации молекулы а юта, равному 15,65 эв, большинством исследователей принимается, что первичными активными центрами в реакции синтеза аммиака являются молекулярные ионы азота N2- Этн иопы должны легко взаимодействовать с водородом. Из масс-спектрометрического исследования рассматриваемой реакпии можно заключить, что первичным продуктом взаимодействия являются ионы КаН+, вероятно возникающие в результате процесса N3 + Нз = МзН - + Н (см. [66, 30]). [c.180]
Несмотря на разнообразие нефтей, сэдержание углерода и водорода в асфальтенах колеблется в сравнительно узких пределах С 80—86% (масс.), Н 7,3—9,4% (масс.), отношение С Н также сравнительно постоянно и равно 9—П. Различие в содержании гетероатомов значительно больше. По данным Сергиенко содержание кислорода в асфальтенах в зависимости от природы нефти может колебаться от 1 до 9, серы, от О до 9, азота от О до 1,5— 3,0% (масс.). Химические и спектральные методы анализа показали, что кислород в асфальтенах входит в состав гидроксильных, карбонильных, карбоксильных и сложноэфирных групп. В нативных асфальтенах преобладают гидроксильные и карбонильные группы до 80% (масс.). В асфальтена.ч из окисленных битумов преобладают сложноэфирные группы [ 60% (масс.) кислорода] Некоторые исследователи считают, что 1 ера входит в состав суль фидных мостиков между фрагментами молекулы асфальтенов Другие, в том числе Сергиенко, придерхиваются мнения, что ато мы серы включены в циклические структурные элементы, содер жащие кольцо тиофена или тетрагидрэтиофена. Спектральными методами были также обнаружены циклические соединения, содержащие сульфоксидную группу. [c.211]
chem21.info
Относительная атомная масса элемента в химии и история её определения :: SYL.ru
В процессе развития науки химия столкнулась с проблемой подсчёта количества вещества для проведения реакций и полученных в их ходе веществ.
На сегодня для подобных расчётов химической реакции между веществами и смесями используют значение относительной атомной массы, внесённой в периодическую таблицу химических элементов Д. И. Менделеева.
Химические процессы и влияние доли элемента в веществах на ход реакции
Современная наука под определением «относительная атомная масса химического элемента» подразумевает, во сколько раз масса атома данного химического элемента больше одной двенадцатой части атома углерода.
С зарождением эры химии потребность в точных определениях хода химической реакции и её результатов росла. Поэтому химики постоянно пытались решить вопрос о точных массах взаимодействующих элементов в веществе. Одним из лучших решений на то время была привязка к самому лёгкому элементу. И вес его атома был взят за единицу.
Исторический ход подсчёта вещества
Изначально использовался водород, затем кислород. Но этот способ расчёта оказался неточным. Причиной тому послужило наличие в кислороде изотопов с массой 17 и 18.
Поэтому, имея смесь изотопов, технически получали число, отличное от шестнадцати. На сегодня относительная атомная масса элемента рассчитывается исходя из принятого за основу веса атома углерода, в соотношении 1/12.
Дальтон заложил основы относительной атомной массы элемента
Лишь спустя некоторое время, в 19-м веке, Дальтон предложил вести расчёт по самому лёгкому химическому элементу – водороду. На лекциях своим студентам он демонстрировал на вырезанных из дерева фигурках, как соединяются атомы. По другим элементам он использовал данные, ранее полученные другими учёными.
По экспериментам Лавуазье в воде содержится пятнадцать процентов водорода и восемьдесят пять процентов кислорода. Имея эти данные, Дальтон рассчитал, что относительная атомная масса элемента, входящего в состав воды, в данном случае кислорода, составляет 5,67. Ошибочность его расчётов связана с тем, что он считал неверно относительно количества атомов водорода в молекуле воды.
По его мнению, на один атом кислорода приходился один атом водорода. Воспользовавшись данными химика Остина о том, что в составе аммиака 20 процентов водорода и 80 процентов азота, он рассчитал, чему равна относительная атомная масса азота. Имея этот результат, он пришёл к интересному выводу. Получалось, что относительная атомная масса (формула аммиака ошибочно была принята с одной молекулой водорода и азота) составляет четыре. В своих расчетах ученый опирался на периодическую систему Менделеева. По анализу он рассчитал, что относительная атомная масса углерода - 4,4, вместо принятых до этого двенадцати.
Несмотря на свои серьёзные промашки, именно Дальтон первым создал таблицу некоторых элементов. Она претерпела неоднократные изменения ещё при жизни учёного.
Изотопная составляющая вещества влияет на значение точности относительного атомного веса
При рассмотрении атомных масс элементов можно заметить, что точность по каждому элементу разная. К примеру, по литию она четырёхзначная, а по фтору - восьмизначная. Проблема в том, что изотопная составляющая каждого элемента своя и непостоянна. Например, в обычной воде содержится три типа изотопа водорода. В их число, кроме обычного водорода, входит дейтерий и тритий.
Относительная атомная масса изотопов водорода составляет соответственно два и три. «Тяжёлая» вода (образованная дейтерием и тритием) испаряется хуже. Поэтому в парообразном состоянии изотопов воды меньше, чем в жидком состоянии.
Избирательность живых организмов к различным изотопам
Живые организмы обладают селективным свойством по отношению к углероду. На построение органических молекул используют углерод с относительной атомной массой, равной двенадцати. Поэтому вещества органического происхождения, а также ряд полезных ископаемых, таких как уголь и нефть, содержат меньше изотопной составляющей, чем неорганические материалы.Микроорганизмы, перерабатывающие и накапливающие серу, оставляют после себя изотоп серы 32. В зонах, где бактерии не перерабатывают, доля изотопа серы - 34, то есть гораздо выше. Именно на основании соотношения серы в породах почвы геологи приходят к выводу о природе происхождения слоя - магматическую природу он имеет или же осадочную.
Из всех химических элементов только один не имеет изотопов - фтор. Поэтому его относительная атомная масса более точная, чем других элементов.
Существование в природе нестабильных веществ
У некоторых элементов относительная масса указана в квадратных скобках. Как видно, это элементы, расположенные после урана. Дело в том, что они не имеют устойчивых изотопов и распадаются с выделением радиоактивного излучения. Поэтому в скобках указан наиболее устойчивый изотоп. Со временем выяснилось, что у некоторых из них возможно получить в искусственных условиях устойчивый изотоп. Пришлось менять в периодической таблице Менделеева атомные массы некоторых трансурановых элементов.
В процессе синтеза новых изотопов и измерения их продолжительности жизни порой удавалось обнаружить нуклиды с продолжительностью полураспада в миллионы раз дольше.
Наука не стоит на месте, постоянно открываются новые элементы, законы, взаимосвязи различных процессов в химии и природе. Поэтому, в каком виде окажется химия и периодическая система химических элементов Менделеева в будущем, лет через сто, - является туманным и неопределённым. Но хочется верить, что накопленные за прошедшие века труды химиков послужат новому, более совершенному знанию наших потомков.
www.syl.ru