Простейшие типы диаграмм состояния сплавов. Диаграммы состояния
21 Диаграммы состояния двойных систем
Системой называется совокупность фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении). Система может быть простой, если она состоит из одного элемента, и сложной, если она состоит из нескольких элементов.
Компонентаминазываются вещества, образующие систему. Чистый металл представляет собой однокомпонентную систему, сплав двух металлов – двухкомпонентную и т.д. Устойчивые химические соединения могут быть компонентами.
Диаграммы состояния (ДС), или диаграммы фазового равновесия в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним и не учитывают кинетику процессов превращений.
По диаграммам состояния можно можно определить:
число фаз, их весовое соотношение и состав фаз (содержание, концентрация компонентов в каждой фазе) в любом сплаве при любой температуре данной системы;
можно проследить за структурными превращениями и дать качественную оценку ожидаемой структуры в сплаве при комнатной температуре.
Точкой ликвидусназывается точка, отвечающая началу кристаллизации, а точкойсолидус– точка, отвечающая концу кристаллизации.
Обычно ДС строят экспериментально в координатах температура - концентрация в весовых или реже атомных процентах. Для построения ДС используют термический анализ, разработанный Курнаковым Н.С. экспериментально получают кривые охлаждения отдельных сплавов и по их перегибам или остановкам, связанным с тепловыми эффектами превращений, определяют температуры соответствующих превращений. Эти температуры называют критическими точками. Температуру металлов измеряют обычно при помощи термопары.
Диаграмма состояния сплавов, образующих в твердом состоянии механические смеси кристаллов чистых компонентов (диаграмма состояния I рода). Компоненты таких сплавов в жидком состоянии неограниченно растворимы друг в друге, а в твердом – не растворимы и не образуют химических соединений. Поэтому в этом сплаве возможно образование трех фаз: жидкого сплава и кристаллов компонентов. Механические смеси образуют сплавы свинца и сурьмы, свинца и олова, цинка и олова, алюминия и кремния и др. Рассмотрим построение диаграммы на примере сплава свинца с сурьмой. Вначале строятся кривые охлаждения чистых свинца и сурьмы (рис. 29.). Температуры их кристаллизации соответствуют горизонтальным площадкам на кривых 1 и 6 (для свинца 327°С и для сурьмы 631°С). Далее рассматриваются несколько сплавов с соответствующим содержанием свинца РЬ и сурьмы Sb, %, например: РЬ 95, Sb 5; Pb 90, Sb 10; Pb 87, Sb 13; Pb 60, Sb 40. Строятся кривые их охлаждения (кривые 2-5 соответственно).
Критические точки, полученные на кривых охлаждения, переносятся на диаграмму состояния и соединяются. получаются линии АЕВ и MEN. Линия АЕВ диаграммы является линией ликвидус: все сплавы, лежащие выше этой линии, находятся в жидком состоянии. Линия MEN является линией солидус, ниже нее все сплавы свинец – сурьма находятся в твердом состоянии. В интервале между ликвидусом и солидусом сплав состоит из двух фаз — жидкого раствора и кристаллов одного из компонентов. Сплавы, содержащие менее 13% Sb, лежащие слева от эвтектического сплава, называют доэвтектическими, а более 13% Sb, — заэвтектическими. Структура и свойства их резко отличаются. В доэвтектических сплавах наряду с эвтектикой находятся избыточные кристаллы свинца, а в заэвтектических - кристаллы сурьмы. Различие структур определяет различие свойств сплавов.
Рисунолк 29 - Дииаграмма состояния сплавов Pb – Sb
Чтобы определить состояние сплава любого состава при данной температуре и для нахождения его критических точек с помощью диаграммы, нужно из точки, указывающей содержание концентрации данного сплава, провести вертикальную линию до пересечения с линиями ликвидус и солидус (см. рис. 29). Точки пересечения показывают начало и конец кристаллизации заданного сплава. Например, требуется определить состояние сплава, содержащего 50 % сурьмы при температуре 400°С. Точка пересечения вертикали с линиями ликвидус и солидус показывают, что данный сплав будет иметь две фазы - жидкий сплав и кристаллы сурьмы, так как точка соответствующая 400°С лежит в области диаграммы BEN.
В процессе кристаллизации непрерывно изменяется концентрация фаз и количество каждой фазы (количество жидкой фазы уменьшается, а твердой увеличивается). Концентрацию (состав) и количество каждой фазы можно определить в любой точке двухфазной области диаграммы состояния, используя правило отрезков. Правило отрезков формулируется следующим образом. Через заданную точку диаграммы состояния проводится горизонтальная линия до пересечения с линиями, ограничивающими данную область диаграммы. Проекции точек пересечения на ось концентраций показывают состав фаз. Длины отрезков горизонтальной линии между заданной точкой и точками, определяющими состав фаз, обратно пропорциональны количествам этих фаз.
На рис. 30 показано применение правила отрезков для точки m диаграммы. Через нее проведена горизонтальная линия и отмечены точки пересечения с линиями диаграммы k и n. Проекции этих точек на ось концентраций k1 и nlпоказывают состав фаз. Так, для диаграммы состояния свинец - сурьма (рис.4,а) точка kl показывает состав жидкой фазы, а точка nl твердой фазы (100 % Sb). Для диаграммы состояния медь - никель (рис.4,б) точка klпоказывает состав жидкой фазы, а точка nlсостав твердого раствора.
Рисунок 30 - Пример применения правила отрезков: а – для сплавов, образующих механические смеси, б – для сплавов, образующих твердые растворы
Рассмотрим теперь определение относительного количества каждой фазы. Обозначим количество жидкой фазы Qж, а количество твердой фазы — Qт. (Для примера на рис. 4,а твердой фазой является сурьма, а на рис. 4,6 — твердый раствор).
Тогда, в соответствии с правилом отрезков, количества фаз обратно пропорциональны длинам соответствующих отрезков:
Если обозначить количество всего сплава Q, то ему будет соответствовать отрезок kn, и можно найти относительные количества фаз:
;
Правило отрезков может быть применено для любой двухфазной области диаграммы состояния, т.е. не только для рассмотрения кристаллизации сплава, но и для изучения процессов, происходящих в твердом состоянии. В однофазных областях диаграммы состояния правило отрезков неприменимо. Любая точка внутри однофазной области характеризует концентрацию данной фазы.
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом и жидком состоянии (диаграмма состояния II рода). Эти диаграммы соответствуют сплавам, у которых компоненты и в жидком, и в твердом состоянии образуют раствор. Для таких сплавов возможно образование двух фаз: жидкого сплава и твердого раствора. К таким сплавам относят медь - никель, железо - никель, железо - хром, кобальт - хром и др. Рассмотрим диаграмму состояния сплавов медь - никель (рис. 31). Кривая 1 является кривой охлаждения чистой меди с температурой кристаллизации 1083°С, кривая 5 — кривая охлаждения никеля с температурой кристаллизации 1452°С. Кривая 2 характерна для кристаллизации сплава, содержащего 20 % никеля. Кристаллизация этого сплава начинается в точке а, при этом образуется кристаллическая решетка меди, в которой имеется 20 % никеля. В точке b кристаллизация заканчивается. Аналогично кристаллизуются сплавы с содержанием 40% (кривая 3) и 80% никеля (кривая 4), но точки начала (а1 и а2) и конца (b1 и b2) кристаллизации у первого сплава ниже, чем у второго. Все точки начала и конца кристаллизации меди, никеля и указанных выше сплавов переносятся на диаграмму (рис. 5, справа). Соединяя эти точки, получим линии ликвидус АаВ и солидус АbВ. Выше линии АаВ сплав меди с никелем находится в жидком стоянии, а ниже линии АbВ — в твердом. В зоне между линиями АаВ и АbВ имеются две фазы: жидкий сплав и кристаллы твердого раствора никеля и меди.
Диаграмма II-го рода отличается от диаграммы 1-го рода тем, что в первом случае образуется одна кристаллическая решетка, а значит, нет и эвтектического сплава как у сплавов, образующих механическую смесь. Кроме того, у сплавов медь — никель начало и конец кристаллизации сплавов с различным содержанием компонентов протекают при различных температурах.
Рисунок 31-. Диаграмма состояния сплавов Cu - Ni
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (диаграмма состояния III рода). Данная диаграмма характеризует сплавы, у которых компоненты неограниченно растворимы в жидком состоянии, ограниченно — в твердом и получающиеся твердые растворы образуют эвтектику. К таким сплавам относятся алюминий-медь, магний-алюминий, магний-цинк и др. Рассмотрим этот тип диаграммы в общем виде ( рис. 32). В сплаве могут существовать три фазы: жидкий сплав, твердый раствор α компонента В в компоненте А и твердый раствор β компонента А в компоненте В. Твердые растворы обозначены здесь строчными греческими буквами, а компоненты - заглавными латинскими буквами. Данная диаграмма содержит в себе элементы двух предыдущих. Линия АСВ является линией ликвидус, линия ADCEB - линией солидус. По линии АС начинают выделяться кристаллы твердого раствора α, по линии СВ — твердого раствора β. Левее точки D кристаллизация заканчивается образованием структуры однородного твердого раствора α, a правее точки Е - однородного твердого раствора β. Точка D характеризует предельную растворимость компонента В в компоненте А, а точка Е - предельную растворимость компонента А в компоненте В. Чаще всего с понижением температуры растворимость компонентов уменьшается. Поэтому по линиям FD и EG происходит выделение вторичных кристаллов αII и βII. Процесс выделения вторичных кристаллов из твердой фазы называется вторичной кристаллизацией. Возможен случай, когда растворимость не уменьшается с понижением температуры. Тогда вторичная кристаллизация происходить не будет, а линии DF и EG будут вертикальными.
Рисунок 32 - Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
На участке DE кристаллизация заканчивается с образованием эвтектики. В данном случае эвтектика состоит не из механической смеси двух компонентов, как на диаграмме I рода, а из механической смеси твердых растворов α и β. Сплав соответствующий точке С диаграммы называется эвтектическим. Все сплавы, расположенные межу точками D и С, называются доэвтектическими, а между точками С и Е - заэвтектическими. После образования эвтектики в доэвтектическом сплаве также будет происходить вторичная кристаллизация твердого раствора βII, а в заэвтектическом - твердого раствора αII.
Диаграмма состояния сплавов, образующих химическое соединение (диаграмма состояния IV рода). Данная диаграмма характеризует сплавы, компоненты которых неограниченно растворимы в жидком состоянии, нерастворимы в твердом и образуют устойчивое химическое соединение. К таким сплавам относятся магний-медь, магний-кальций и др. Диаграмма этого типа в общем виде изображена на рис. 33. Она характеризуется наличием вертикальной линии, соответствующей соотношению компонентов в химическом соединении AmBn. Эта линия делит диаграмму на две части, которые можно рассматривать как самостоятельные диаграммы сплавов, образуемых одним из компонентов с химическим соединением. В случае устойчивого химического соединения каждый из компонентов образует с химическим соединением механическую смесь. Линия ADCEB является линией ликвидус данной диаграммы. На участке AD начинается кристаллизация компонента А, на участке DCE - химического соединения AmBn, на участке ЕВ - компонента В. Точка С диаграммы соответствует химическому соединению AmBn. Кристаллизация происходит полностью аналогично кристаллизации сплавов, образующих механические смеси из чистых компонентов. Компонент А образует с химическим соединением AmBn эвтектику Э1, состав которой соответствует точке D. Компонент В образует с химическим соединением AmBn эвтектику Э2, состав которой соответствует точке Е.
Рисунок 33 - Диаграмма состояния сплавов, образующих химическое соединение
В некоторых сплавах могут одновременно находиться все виды соединений: механическая смесь, твердый раствор и химическое соединение. Примером таких сплавов служат сталь и чугун.
Диаграмма состояния сплавов с полиморфным превращением одного из компонентов. Большой практический интерес представляют сплавы, у которых один из компонентов или оба имеют полиморфные превращения. В этих сплавах в результате термической обработки можно получать метастабильные состояния структуры с новыми свойствами.
Диаграмма состояния сплавов с полиморфным превращением одного из компонентов представлена на рис. 34. Сплав I после полного затвердевания при температуре точки 2 в твердом состоянии в интервале температур точек 3 и 4 изменяет кристаллическую структуру. Это вызвано полиморфизмом компонента А, который до температуры точки А1 имеет тип кристаллической решетки Аα, а при температуре более высокой - Аγ. Причем кристаллическая решетка Аγ такая же, как у компонента В, в результате чего между ними образуется непрерывный ряд твердых растворов.
В сплавах, составы которых лежат между точками ха и хb, превращение γ →α при охлаждении не заканчивается и сплав остается двухфазным (γ + α). Сплавы, составы которых лежат правее точки хb, в твердом состоянии превращений не имеют, структура у них однофазная - γ–твердыйраствор.
Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением. Из анализа диаграммы, представленной на рис. 35, можно заключить, что после кристаллизации всех сплавов данной системы в определенном интервале температур образуется твердый раствор γ, который при понижении температуры ниже t3 испытывает эвтектоидное превращение
Образовавшуюся смесь двух твердых фаз принято называть эвтектоидом. В связи с переменной растворимостью компонентов в твердых растворах α и β при дальнейшем охлаждении следуют вторичные выделения твердыхрастворов βII и αII, которые показаны на структурной схеме сплавов, приведенной под диаграммой (см. рис.9).
| Рисунок 34 -Диаграмма состояния сплавов с полиморфным превращением одного из компонентов | Рисунок 35 - Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением |
2.2. Металлические сплавы. Диаграммы состояния.
Металлическим сплавом называется материал, полученный сплавлением двух или более металлов или металлов с неметаллами, обладающий металлическими свойствами. Вещества, которые образуют сплав, называются компонентами. Фазой называют однородную часть сплава, характеризующуюся определенными составом и строением иотделенную от других частей сплава поверхностью раздела. Под структурой понимают форму размер и характер взаимного расположения фаз в металлах и сплавах. Структурными составляющими называют обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями.
Виды сплавов по структуре. По характеру взаимодействия компонентов все сплавы подразделяются на три основных типа: механические смеси, химические соединения и твердые растворы.
Механическая смесь двух компонентов A и B образуется, если они не способны к взаимодействию или взаимному растворению. Каждый компонент при этом кристаллизуется в свою кристаллическую решетку. Структура механических смесей неоднородная, состоящая из отдельных зерен компонента A и компонента B. Свойства механических смесей зависят от количественного соотношения компонентов: чем больше в сплаве данного компонента, тем ближе к его свойствам свойства смеси.
Химическое соединение образуется, когда компоненты сплаваAиBвступают в химическое взаимодействие. При этом соотношение чисел атомов в соединении соответствует его химической формуле AmBn. Химическое соединение имеет свою кристаллическую решетку, которая отличается от кристаллических решеток компонентов. Химические соединения имеют однородную структуру, состоящую из одинаковых по составу и свойствам зерен.
При образовании твердого раствора атомы одного компонента входят в кристаллическую решетку другого. Твердые растворызамещения образуются в результате частичного замещения атомов кристаллической решетки одного компонента атомами второго (рис. 8,б.).Твердые растворы внедрения образуются когда атомы растворенного компонента внедряются в кристаллическую решетку компонента - растворителя (рис. 8,в.). Твердый раствор имеет однородную структуру, одну кристаллическую решетку. В отличие от химического соединения твердый раствор существует не при строго определенном соотношении компонентов, а в интервале концентраций. Обозначают твердые растворы строчными буквами греческого алфавита: и т. д.
Диаграмма состояния. Диаграмма состояния показывает строение сплава в зависимости от соотношения компонентов и от температуры. Она строится экспериментально по кривым охлаждения сплавов (рис. 9). В отличие от чистых металлов сплавы кристаллизуются не при постоянной температуре, а в интервале температур. Поэтому на кривых охлаждения сплавов имеется две критические точки. В верхней критической точке, называемой точкой ликвидус , начинается кристаллизация. В нижней критической точке, которая называется точкой солидус , кристаллизация завершается. Кривая охлаждения механической смеси (рис. 9,а) отличается от кривой охлаждения твердого раствора (рис. 9,6) наличием горизонтального участка. На этом участке происходит кристаллизация эвтектики. Эвтектикой называют механическую смесь двух фаз, одновременно кристаллизовавшихся из жидкого сплава. Эвтектика имеет определенный химический состав и образуется при постоянной температуре.
Рис. 9. Кривые охлаждения сплавов: а - механической смеси, б - твердого раствора.
Диаграмму состояния строят в координатах температура-концентрация. Линии диаграммы разграничивают области одинаковых фазовых состояний. Вид диаграммы зависит от того, как взаимодействуют между собой компоненты. Для построения диаграммы состояния используют большое количество кривых охлаждения для сплавов различных концентраций. При построении диаграммы критические точки переносятся с кривых охлаждения на диаграмму и соединяются линией. В получившихся на диаграмме областях записывают фазы или структурные составляющие. Линия диаграммы состояния, на которой при охлаждении начинается кристаллизация сплава, называется линией ликвидус, а линия, на которой кристаллизация завершается — линией солидус.
Виды диаграмм состояния. Диаграмма состояния сплавов, образующих механические смеси (рис.10), характеризуется отсутствием растворения компонентов в твердом состоянии. Поэтому в этом сплаве возможно образование трех фаз: жидкого сплава Ж, кристаллов А и кристаллов В. Линия АСВ диаграммы является линией ликвидус: на участке АС при охлаждении начинается кристаллизация компонента А, а на участке CD — компонента В. Линия ОС является линией солидус, на ней завершается кристаллизация А или В и при постоянной температуре происходит кристаллизация эвтектики Э. Сплавы концентрация которых соответствует точке C диаграммы называются эвтектическими, их структура представляет собой чистую эвтектику. Сплавы, расположенные на диаграмме левее эвтектического, называются доэвтектическими, их структура состоит из зерен A и эвтектики. Те сплавы, которые на диаграмме расположены правее эвтектического, называютсязаэвтектическими, их структура представляет собойзерна B, окруженные эвтектикой.
Рис. 10. Диаграмма состояния сплавов, образующих механические смеси.
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии изображена на рис. 10. Для этого сплава возможно образование двух фаз: жидкого сплава и твердого раствора а. На диаграмме имеется всего две линии, верхняя является линией ликвидус, а нижняя — линией солидус.
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии показана на рис. 11. В этом сплаве могут существовать три фазы — жидкий сплав, твердый раствор α компонента B в компоненте A и твердый раствор β компонента A в компоненте В. Данная диаграмма содержит в себе элементы двух предыдущих. Линия АСВ является линией ликвидус, линия ADCEB — линией солидус. Здесь также образуется эвтектика, имеются эвтектический, доэвтектический и заэвтектический сплавы. По линиям FD и EG происходит выделение вторичных кристаллов и(вследствие уменьшения растворимости с понижением температуры). Процесс выделения вторичных кристаллов из твердой фазы называетсявторичной кристаллизацией.
Диаграмма состояния сплавов, образующих химическое соединение (рис.12) характеризуется наличием вертикальной линии, соответствующей соотношением компонентов в химическом соединении AmBn. Эта линия делит диаграмму на две части, которые можно рассматривать как самостоятельные диаграммы сплавов, образуемых одним из компонентов с химическим соединением. На рис. 12 изображена диаграмма для случая, когда каждый из компонентов образует с химическим соединением механическую смесь.
studfiles.net
Значение диаграмм состояния.
Диаграмма состояния - это графическое изображение состояния сплавов в системе координат ''температура - концентрация". Она показывает, как с изменением температуры и химического состава изменяются структура, количество фаз и их концентрация.
Умея анализировать диаграмму состояния, можно представить полную картину кристаллизации сплава, процессы перекристаллизации сплава в твердом состоянии, а также определить оптимальную температуру заливки, оценить его жидкотекучесть, склонность к ликвации. Диаграмма позволяет установить виды и температурные режимы термической обработки.
Основные понятия.
Вещества (элементы), образующие сплавы, называют компонентами. Их принято обозначать в общем случае буквами А, В, С и т.д. В сплавах компоненты различно взаимодействуют друг с другом в твердом состоянии, образуя те или иные фазы. Фазой называют однородную по составу и атомно-кристаллическому строению часть сплава.
При сплавлении двух компонентов могут образовываться твердые растворы, химические соединения и смеси.
Если атомы компонента В размещаются (растворяются) в кристаллической решетке компонента А, не изменяя ее типа, то это будет твердый раствор - , а при растворении компонента А в компоненте В - твердый раствор - . Растворимость компонентов А и В может быть неограниченной и ограниченной. Если компоненты образуют твердый ограниченный раствор, то его предельная концентрация как правило изменяется с изменением температуры.
Химические соединения - это фазы, имеющие более сложную кристаллическую решетку, чем сплавляемые компоненты. Они имеют постоянный химический состав, отвечающий формуле Аm Вn.
Если в химическом соединении растворяется один из исходных компонентов А или В, то соответствующие твердые растворы на базе химического соединения также как обычные твердые растворы обозначают буквами греческого алфавита , ,,. и т.д. В сложных диаграммах образующиеся в системе химические соединения можно условно рассматривать как самостоятельные компоненты для оценки характера протекающих в сплавах превращений.
Рентгеновский анализ твердых растворов или химических соединений показывает только один тип кристаллической решетки, и лишь спектральный или химический анализы могут зафиксировать наличие двух компонентов.
При кристаллизации многих сплавов, образуются структуры, состоящие из нескольких фаз. Фазы, образующие эти структуры, обнаруживаются под микроскопом, а
рентгенограмма такого сплава показывает наличие разных кристаллических решеток. Такая структура представляет собой смесь фаз. Сплавы с неоднородной (гетерогенной) структурой могут образовываться, когда компоненты не обладают полной взаимной растворимостью в твердом состоянии, образуя структуры, состоящие из:
а) насыщенного твердого раствора и избыточных кристаллов чистого компонента;
б) двух насыщенных твердых растворов;
в) насыщенного твердого раствора и кристаллов химического соединения.
Так, избыточные кристаллы чистого компонента или химического соединения часто присутствуют в структуре сплавов, располагаясь в виде обособленных включений по границам зерен твердого раствора или в объеме самих зерен.
В ряде случаев в процессе кристаллизации сплавов может образоваться смесь фаз эвтектического и эвтектоидного состава. Они могут быть образованны кристаллами чистых компонентов (при отсутствии взаимной растворимости), твердыми растворами или химическими соединениями, а также различными комбинациями этих трех фаз.
Типовые диаграммы двойных систем и кривые охлаждения сплавов.
Диаграммы состояния характеризуют превращения, протекающие при медленном охлаждении (нагревании) сплавов. В зависимости от состояния сплавов они протекают различно. Следовательно, разные сплавы могут иметь разные по характеру кривые охлаждения, построенные в системе координат "температура - время".
На рис. 1 - 4 приведены основные типы диаграмм состояния и кривые охлаждения сплавов.
Кристаллизация чистых металлов происходит при постоянной температуре с определенными тепловыми эффектами, вследствие чего на кривых охлаждения при температуре затвердевания обнаруживается остановка (горизонтальный участок). На диаграммах состояния кристаллизация чистых компонентов происходит при температурах, которым соответствуют точки А и В на осях координат (рис. 1а). В двухкомпонентных системах первичная кристаллизация может протекать при постоянной температуре только в сплавах эвтектического состава (рис. 1а, сплав П). Кристаллизация всех остальных сплавов происходит в интервале температур. Так как образование кристаллов из жидкости идет с выделением тепла, то этому процессу соответствует замедление охлаждения сплава и изменение наклона кривой охлаждения. Поэтому начало кристаллизации характеризуется перегибом на кривой охлаждения.
В сплавах, компоненты которых не растворимы друг в друге в твердом состоянии, сначала в интервале температур идет кристаллизация одного из чистых компонентов, избыточного по отношению к эвтектическому составу. Затем при постоянной температуре кристаллизация заканчивается образованием из оставшейся жидкости эвтектической смеси кристаллов по реакции:
Ж-->А + В (рис. 1а)
В сплавах с полной растворимостью компонентов кристаллизация во всех случаях идет в интервале температур с образованием структуры однородного твердого раствора (рис. 16).
В сплавах с ограниченной растворимостью компонентов (рис. 1в) кристаллизация начинается с выделения избыточных кристаллов твердого раствора а или |3 и протекает в интервале температур. Заканчивается этот процесс при постоянной температуре (линия дск) образованием эвтектики, состоящей из кристаллов твердых растворов по реакции:
Ж--> α+β
В системе с перитектическим превращением (рис. 1г) на кривой охлаждения сплава 1 в начале наблюдается перегиб, соответствующий началу кристаллизации а - раствора, а затем горизонтальный участок, отвечающий перитектическому превращению:
Ж + α-->β
Рис. 1.
Диаграмма состояния и кривые охлаждения сплавов, не имеющих превращений в твердом состоянии.
а) - отсутствие растворимости, б) - полная растворимость,
в) - ограниченная растворимость с образованием эвтектики,
г) - ограниченная растворимость с образованием перитектики.
Это превращение заключается в том, что выделившиеся ранее кристаллы а - раствора взаимодействуют при постоянной температуре (линия вcд) с оставшейся жидкостью, образуя новую фазу- твердый раствор. При этом в сплаве I после окончания пери-тектического превращения в структуре частично сохраняются первичные кристаллы а . В сплаве II (рис. 1г) после перитектического превращения остается неизрасходованная жидкость, которая при дальнейшем охлаждении превращается в кристаллы - раствора. Это превращение тоже сопровождается тепловым эффектом, отражающимся на кривой охлаждения (кривая II).
Кристаллизация сплавов, компоненты которых образуют устойчивое химическое соединение (рис. 2а) или твердый раствор на основе химического соединения (рис. 26), происходит также, как в рассмотренных выше диаграммах. Исключения составляют сплавы, соответствующие по составу чистым химическим соединениям (рис. 2а, б, точка д), которые кристаллизуются при постоянной температуре подобно чистым металлам. Каждую диаграмму с устойчивым химическим соединением можно рассматривать, как комбинацию из простых диаграмм, где вторым компонентом условно считают образовавшееся в системе химическое соединение.
Процесс кристаллизации в сплавах, компоненты которых образуют неустойчивое химическое соединение (рис. 2в), происходит следующим образом. Сначала из жидкости выделяются кристаллы одного из компонентов. Моменту начала этого выделения соответствует точка перегиба на кривой охлаждения. Затем следуют два изотермических
превращения, которым соответствуют два горизонтальных участка на кривой охлаждения. Первый участок - это образование химического соединения по перитектической реакции А + Ж -> AmBn, второй - эвтектическое превращение
Ж --> AmBn + В.
Вторичная кристаллизация, т.е. превращения в твердом состоянии (полиморфные превращения, полный или частичный распад твердого раствора образование или распад неустойчивых химических соединений) и магнитные превращения также сопровождаются тепловым эффектом. Однако, величина теплового эффекта при этом меньше, чем при первичной кристаллизации.
Рис. 2. Диаграмма состояния и кривые охлаждения сплавов, не имеющих превращений в твердом состоянии и образующих химические соединения.
а) - при отсутствии растворимости, б) - при ограниченной растворимости, в) -образование химического соединения, неустойчивого при высоких температурах.
В чистых металлах превращение в твердом состоянии (полиморфное) происходит при постоянной температуре (рис. 3 а,б,в, точка m). В сплавах превращения в твердом состоянии также могут протекать при постоянной температуре в следующих случаях.
1) В сплавах-смесях при полиморфном превращении компонентов или образованного ими химического соединения (рис. За, сплав I). На диаграмме состояния этим превращениям соответствует горизонтальная линия, а на кривой охлаждения - изотермическая остановка.
2) При эвтектоидном превращении, в результате которого происходит полный распад твердого раствора и образование смеси фаз с постоянной концентрацией. Например, на (рис. 4 б, в) в точке "с" твердые растворы при постоянной температуре распадаются на эвтектодную смесь кристаллов компонентов А и В. Точка ''с'' в этом случае называется эвтектоидной точкой, а соответствующий ей сплав - эвтектоидным сплавом. Если состав сплава отличается от эвтектоидного, то сначала следует частичный распад с выделением из твердого раствора новой фазы, например, кристаллов чистого компонента (рис. Рис.4б,в, сплав I). Далее оставшийся твердый раствор при постоянной температуре превращается в эвтектоидную смесь точно такого же состава, как и в эвтектоидном сплаве. В этом случае начало частичного распада характеризуется точкой перегиба на кривой охлаждения, а эвтектоидный распад - горизонтальным участком.
3) При образовании химических соединений в твердом состоянии или упорядоченных фаз только сплав, соответствующий концентрации точке "а" (рис. 4г), будет иметь площадку (горизонтальный участок) на кривой охлаждения.
Во всех остальных случаях превращения в твердом состоянии протекают в интервале температур. Соответствующие линии на диаграмме состояния имеют наклон и могут показывать или полиморфное превращение твердого раствора (рис. 3 б и в) или частичный распад твердого раствора (рис. 3г и 4а). Началу этих превращений на кривых охлаждения соответствуют точки перегиба.
Рис. 3.
studfiles.net
Правило фаз, построение диаграмм состояния
Процесс кристаллизации металлических сплавов и связанные с ними многие закономерности строения сплавов описывают с помощью диаграмм фазового равновесия. Эти диаграммы в удобной графической форме показывают фазовый состав и структуру в зависимости от температуры и концентрации. Диаграммы построены для условий равновесия; равновесное состояние соответствует минимальному значению свободной энергии.
Рассмотрение диаграмм состояния позволяет определить фазовые превращения в условиях очень медленного охлаждения или нагрева. Закономерность изменения числа фаз в гетерогенной системе определяется правилом фаз.
Фаза – однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачком.
При изучении физико-химических равновесий за внешние факторы, влияющие на состояние сплава, принимают температуру и давление. Применяя правило фаз к металлам, можно во многих случаях принять изменяющимся только один внешний фактор – температуру, т.к. давление, за исключением очень высокого, мало влияет на фазовое равновесие в твердом и жидком состояниях. Тогда общие закономерности существования устойчивых фаз, отвечающих условиям равновесия, в математической форме выражаются правилом фаз (правилом Гиббса) и при постоянном давлении выражается следующим уравнением:
С = К + 1 - ,
где К – число компонентов в системе; - число фаз;С – число степеней свободы (вариантность системы).
Число степеней свободы С – число независимых внутренних переменных (состав фаз) и внешних (температура, давление) факторов, которые можно менять без изменения числа фаз, находящихся в равновесии. При фазовых превращениях в сплавах вновь образующаяся фаза не обязательно должна иметь более низкий уровень свободной энергии, чем исходная, но обязательно в процессе фазового превращения свободная энергия системы, в целом, должна уменьшаться.
По кривым свободной энергии можно геометрическим путем построить основные типы диаграмм состояния. Их строят в координатах температура-концентрация в процентном содержании по массе.
Для построения диаграмм состояния используют термический анализ, разработанный Н.С. Курнаковым. Экспериментально получают кривые охлаждения отдельных сплавов и по их перегибам или остановкам, связанных с тепловыми эффектами превращений, определяют температуру соответствующих превращений. Эти температуры называют критическими точками.
При изучении превращений в твердом состоянии используют различные методы физико-химического анализа, микроанализа, рентгеноструктурного, дилатометрического, магнитного анализов и др.
В жидком состоянии большинство металлов неограниченно растворяются один в другом, образуя однофазный жидкий раствор. Любые фазы, образующиеся в сплаве, отличаются по составу от исходного жидкого раствора. Поэтому для образования устойчивого зародыша необходимы не только гетерогенные флуктуации, но и флуктуации концентрации. Флуктуациями концентрации называют временно возникающие отклонения химического состава сплава в отдельных малых объемах жидкого раствора от среднего его состава. Такие флуктуации возникают в результате диффузионного перемещения атомов вещества и вследствие тепловых движений в жидком растворе. Зародыш новой фазы может возникнуть только в тех микрообъемах исходной фазы, состав которых в результате флуктуации концентрации и расположения атомов соответствует составу и строению новой кристаллизующейся фазы.
Скорость роста кристаллов в жидких растворах меньше, чем в чистых металлах. Это объясняется тем, что рост кристаллов требует диффузионного перемещения атомов компонентов в жидком растворе.
Диаграмма состояния разделена линиями на области. Отдельные области могут состоять только из одной фазы, а некоторые – из двух, имеющих разные составы, строение и свойства.
Анализируя диаграмму состояния, можно составить представление о специфике свойств сплавов данной системы компонентов и характере их изменений в зависимости от состава, а также о возможности термической обработки сплавов и температуре нагрева для ее проведения.
Вид диаграммы определяется характером взаимодействий, которые возникают между компонентами в жидком и твердом состояниях.
Диаграмма состояния для сплавов, образующих смеси из чистых компонентов
Оба компонента сплава в жидком состоянии неограниченно растворимы, а в твердом – нерастворимы и не образуют химических соединений и не имеют полиморфных превращений. Общий вид диаграммы на рис. 3. Фазы: жидкость – Ж, кристаллы – А и В.
Линия АСВ – линия начала кристаллизации, является линией ликвидус; линия ДСЕ – линия конца кристаллизации, является линией солидус. На линии АС начинают выделяться кристаллы А; на линии СВ – кристаллы В; на линии ДСЕ из жидкости концентрации С одновременно выделяются кристаллы А и В. Эвтектическая смесь двух видов кристаллов, одновременно кристаллизующихся из жидкости, называется эвтектикой.
Рис. 3. Общий вид диаграммы состояния и кривые охлаждения сплавов: 1 – заэвтектического; 2 – доэвтектического; 3 – эвтектического.
На рис. 4 схематически показано строение сплава в разные моменты кристаллизации.
Рис. 4. Строение сплавов
Имея диаграмму состояния, можно проследить за фазовыми превращениями любого сплава и указать состав и количественное соотношение фаз при любой температуре. Это определяется по правилу отрезков.
Для определения концентрации компонентов в двух фазах через данную точку а (рис. 3.), характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область. Проекции точек пересечения в и с на горизонтальную ось диаграммы покажут составы фаз в1 и с1 . Отрезки этой линии между точкой а и точками в и с, определяющими составы фаз, обратно пропорциональны количествам этих фаз:
Ж=ac/bc; B=ab/bc.
Эти правила справедливы для любой двухфазной области диаграммы состояния.
При оценке прочностных и других свойств сплава следует иметь в виду, что та часть сплава, которая представлена эвтектикой, имеет более высокую прочность, чем часть, представленная более крупными зернами избыточной фазы.
Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии
На рис. 5 приведена диаграмма состояния для сплавов с неограниченной растворимостью компонентов друг в друге в жидком и твердом состоянии, имеющих одинаковые типы решеток и сходное строение наружных электронных оболочек.
Линия АМВ – линия ликвидус; линия АNВ – линия солидус; фаза представляет собой твердый раствор компонентов А и В, зерна этой фазы имеют единую кристаллическую решетку, но у сплавов разного состава числа атомов компонентов А и В в элементарных ячейках решетки различно.
Кристаллизация α-фаз в сплавах разного рода происходит в соответствие с правилом отрезков. В случае равновесной кристаллизации, происходящей при достаточно малой скорости охлаждения сплава, к концу кристаллизации состав окончательно сформировавшейся фазы А4 должен соответствовать исходному составу сплава В1 (в данном случае сплава І). Это обусловлено непрерывно происходящей диффузией между обеими фазами.
Рис. 5. Общий вид диаграммы состояния и кривая охлаждения сплава.
В случае ускоренного охлаждения сплава при кристаллизации диффузионные процессы не успевают завершиться. В связи с этим центральная часть каждого зерна оказывается обогащенной более тугоплавким компонентом В, а периферийная – легкоплавким компонентом А. Это явление называется дендритной ликвацией, снижающей прочностные и др. свойства сплавов.
Дендритная ликвация может быть устранена путем длительного отжига. Этот отжиг называется диффузионным. Происходящие при этом диффузионные процессы выравнивают химический состав в зернах.
При образовании твердого раствора временное сопротивление при растяжении, предел текучести и твердость повышаются при сохранении достаточно высокой пластичности. Это объясняется тем, что атомы растворенного элемента группируются в искаженных областях решетки, что мешает продвижению дислокаций.
studfiles.net
Простейшие типы диаграмм состояния сплавов
Диаграмма – это графическое изображение состояния сплавов в зависимости от состава и температуры. Диаграммы строятся для условий равновесия, которые создаются при очень медленном охлаждении или нагревании сплавов, когда ни один процесс не затормаживается, все превращения идут до конца.
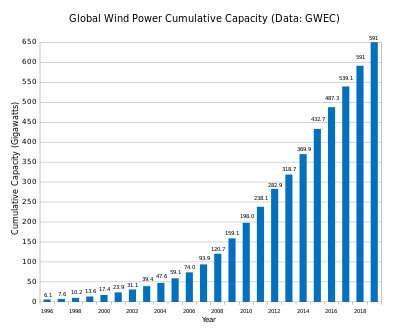
Диаграммы строятся экспериментально по критическим точкам. Критические точки – это температуры, при которых в сплаве происходит какое-то превращение (например, затвердевание – расплавление, аллотропическое превращение, распад твердого раствора и т.д.). Критические точки находят термическим или каким-либо другим методом. При термическом анализе для каждого сплава данной системы строят кривую охлаждения. Все превращения сопровождаются тепловым эффектом (выделение или поглощение тепла) что приводит или к температурным остановкам, или перегибам кривой охлаждения сплава из жидкого состояния (см. рис. 5.4): 1 и 2 – критические точки.
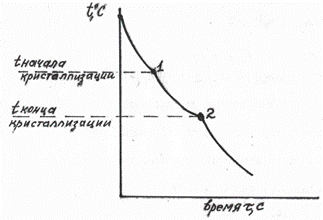
Рис. 5.4 Кривая охлаждения сплава, где компоненты дают твердый раствор  (20% В, 80% А – см. рис. 5.5)
(20% В, 80% А – см. рис. 5.5)
Полученные критические точки наносятся в координатах состав-температура. Соединяя однотипные точки, получаем диаграмму состояния (см. рис. 5.5).
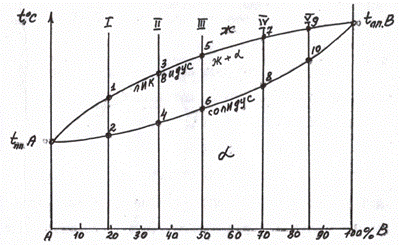
Рис. 5.5 Линии диаграммы, построенные по критическим точкам (ликвидус и солидус)
Например, в сплавах 1, 2, 3, 4, 5 были найдены критические точки (рис. 5.5). Соединяя точки начала кристаллизации (1, 3, 5, 7, 9), получаем линию ликвидус. Соединяя точки конца кристаллизации, получаем линию солидус. Таким образом, зная температуры плавления чистых компонентов А и В, получаем диаграмму для случая неограниченной растворимости.
Рассмотрим 4 типа простейших диаграмм.
Диаграмма 1 типа (случай образования механической смеси с эвтектикой, рис. 5.6).
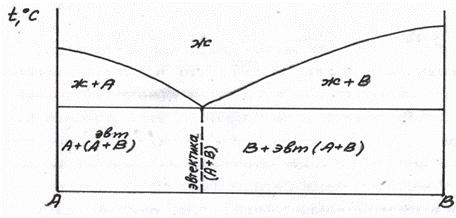
Рис. 5.6,а Диаграмма состояния 1 типа
Для того, чтобы понимать диаграммы состояния сплавов, необходимо уметь пользоваться правилом отрезков.
Правило отрезков
Оно действует только в двухфазных областях. С его помощью можно установить:
- какие фазы находятся в данной двухфазной области;
- химический состав каждой фазы;
- количественное соотношение фаз.
Для определения первых двух вопросов необходимо в двухфазной области при заданной температуре провести коноду (рис. 5.6,б, сплав 1).
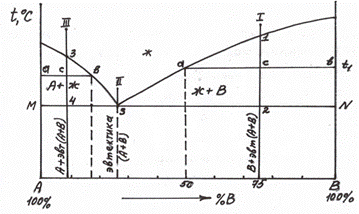
Рис. 5.6,б Диаграмма состояния 1 типа с демонстрацией правила отрезков.
Концы коноды а и б указывают, что в данной двухфазной области находятся: жидкость состава «а» и кристаллы компонента В (100%В). Количественное соотношение жидкой и твердой фазы при температуре 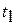 можно определить, пользуясь также правилом отрезков. Для этого составляем пропорцию: конода аб соответствует количеству всего сплава – 100%; количеству твердой фазы (кристаллов В) соответствует отрезок, прилежащий к противоположной фазе, т.е. отрезок ас:
можно определить, пользуясь также правилом отрезков. Для этого составляем пропорцию: конода аб соответствует количеству всего сплава – 100%; количеству твердой фазы (кристаллов В) соответствует отрезок, прилежащий к противоположной фазе, т.е. отрезок ас:
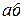 – 100%
– 100%
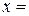
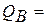
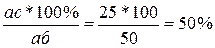
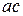 -
- 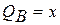
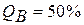
Значит, 50% сплава затвердело.
Разберем, пользуясь правилом отрезков, диаграмму 1 типа. Сначала рассмотрим кристаллизацию сплава 2 (рис. 5.6,б). В критической точке S из жидкого расплава начинают выделяться сразу два типа кристаллов – А и В (концы коноды М и N упираются в эти фазы). Механическая смесь двух видов кристаллов, образующаяся при постоянной температуре, является эвтектикой. Таким образом, в т.S вся жидкость превращается в эвтектику (при постоянной температуре). Кривая охлаждения этого сплава представлена на рис. 5.7.
Разберем кристаллизацию сплава 1 (заэвтектического) – рис. 5.6,б. В критической точке 1 из жидкого расплава начинают выделяться кристаллы компонента В. При охлаждении от т.1 до т.2 состав жидкой фазы изменяется по кривой 1S. При подходе к критической точке 2 количество не затвердевшего
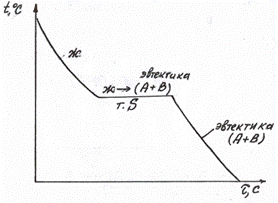
Рис. 5.7 Кривая кристаллизации сплава 2 (на рис. 6,б)
(эвтектического)
сплава (жидкости) соответствует отрезку 2N, а количеству твердой фазы (кристаллов В) соответствует отрезок S2. Состав жидкой фазы соответствует т.S – эвтектической. Таким образом, в т.2 происходит затвердевание жидкости эвтектического состава с образованием эвтектики (А+В). Ниже т.2 сплав состоит из В+ эвт (А+В) . Таким же образом разберем кристаллизацию сплава 3 (доэвтектического), рис. 5.8. Конец коноды «д» показывает, что в т.3 из жидкости начинают выделяться кристаллы компонента А. Состав жидкой фазы при охлаждении от т.3 до т.4 изменяется по кривой 3S. В т.3 оставшаяся жидкость, приняв эвтектический состав, превратится в эвтектику (А+В). Кривая кристаллизации сплава 3 представлена на рис. 5.8.
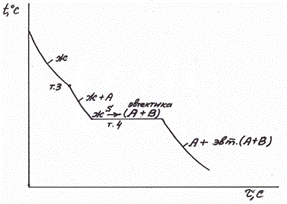
Рис. 5.8 Кривая охлаждения сплава 3
(доэвтектического)
Диаграмма состояния 2 типа (случай неограниченной растворимости компонентов в друг друге – рис. 5.9).
Неограниченная растворимость будет иметь место при следующих условиях:
1)Компоненты имеют один тип кристаллической решетки (изоморфны) с небольшим различием в параметрах.
2)Компоненты находятся близко в таблице Менделеева и имеют близкие атомные размеры.
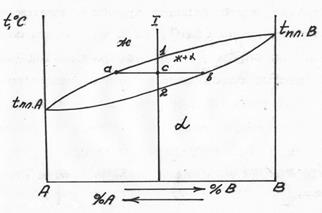
Рис. 5.9 Диаграмма состояния 2 типа
В этом случае атомы как бы взаимозаменяемы в кристаллической решетке. Заменяя атомы одного компонента на атомы другого компонента в кристаллической решетке получают непрерывный ряд твердых растворов. Когда будут заменены все атомы, получается чистый второй компонент. Твердые растворы, как уже упоминалось, обозначают 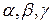 и т.д., рис. 5.9. Выше линии ликвидус – жидкость, ниже линии солидус – твердый раствор
и т.д., рис. 5.9. Выше линии ликвидус – жидкость, ниже линии солидус – твердый раствор  . Между линией ликвидус и солидус – двухфазная область, состоящая из ж+
. Между линией ликвидус и солидус – двухфазная область, состоящая из ж+  (см. концы коноды аб). Количество жидкой фазы в сплаве 1 при температуре т.С соответствует отрезку «сб». При снижении температуры до т.2 отрезок «сб» обращается в ноль, следовательно. При подходе к линии солидус затвердевают остатки жидкости. Кривая кристаллизации твердого раствора не имеет ступеньки (рис. 5.10).
(см. концы коноды аб). Количество жидкой фазы в сплаве 1 при температуре т.С соответствует отрезку «сб». При снижении температуры до т.2 отрезок «сб» обращается в ноль, следовательно. При подходе к линии солидус затвердевают остатки жидкости. Кривая кристаллизации твердого раствора не имеет ступеньки (рис. 5.10).
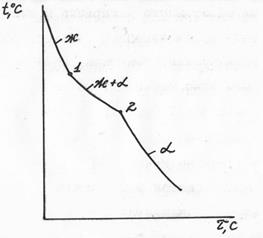
Рис. 5.10 Кривая охлаждения сплава 1 на диаграмме 2 типа.
Диаграмма состояния 3 типа(случай ограниченной растворимости компонентов).
Случаи неограниченной растворимости очень редки, чаще встречается ограниченная растворимость, будет участок диаграммы 2 типа.
Существует несколько вариантов диаграмм 3 типа.
1 вариант (рис. 5.11).
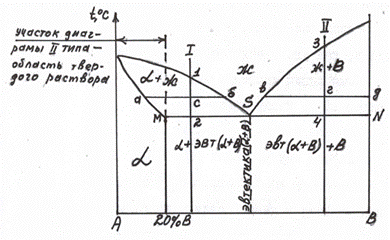
Рис. 5.11 Диаграмма 3 типа (1 вариант)
На том участке, где имеет место диаграмма 2 типа (указан на рис. 5.11), будет происходить кристаллизация твердого раствора  . В т. S в сплаве кристаллизуется эвтектика, которая состоит из кристаллов
. В т. S в сплаве кристаллизуется эвтектика, которая состоит из кристаллов  и
и 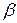 (на эти фазы указывают концы коноды М и N). При кристаллизации сплава 1 в т.1 (рис. 5.11) из жидкости начинают выделяться кристаллы твердого раствора
(на эти фазы указывают концы коноды М и N). При кристаллизации сплава 1 в т.1 (рис. 5.11) из жидкости начинают выделяться кристаллы твердого раствора  . При охлаждении до т.2 состав жидкой фазы изменяется по кривой 1S, в т.2 оставшаяся жидкость состава т.S превращается в эвтектику (
. При охлаждении до т.2 состав жидкой фазы изменяется по кривой 1S, в т.2 оставшаяся жидкость состава т.S превращается в эвтектику ( 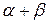 ) – см. рис. 5.11.
) – см. рис. 5.11.
Кристаллизация сплава 2 начинается в т.3 с выделением кристаллов В (рис. 5.11). Оставшаяся жидкость в т.4, приняв состав т.S, превращается в эвтектику ( 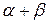 ).
).
2 вариант диаграммы 3 типа
На предыдущей диаграмме 3 типа растворимость составляет 20% В и не изменяется с повышением температуры. На диаграмме (рис. 5.12) растворимость повышается с возрастанием температуры от 10% до 30% В.
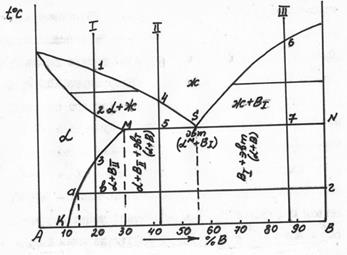
Рис. 5.12 Диаграмма 3 типа с изменяющейся растворимостью
Разберем кристаллизацию сплава, содержащего 20% В (рис. 5.12). Выше линии ликвидус на диаграмме находится область расплава – жидкость. На участке диаграммы, где линии ликвдус и солидус образуют часть диаграммы 2 типа, кристаллизуется твердый раствор А(В) -  . Между точками 1 и 2, исходя из правила отрезков, находится
. Между точками 1 и 2, исходя из правила отрезков, находится  +ж. В т.2 жидкость закристаллизовывается в
+ж. В т.2 жидкость закристаллизовывается в  , который содержит 20% В. Ниже т.3
, который содержит 20% В. Ниже т.3  -раствор не может растворить 20% В, например, в т. «в»
-раствор не может растворить 20% В, например, в т. «в»  -раствор может растворить 15% В. Значит, ниже т.3 из
-раствор может растворить 15% В. Значит, ниже т.3 из  -раствора должна выделяться фаза, богатая компонентом В. Эту фазу определяем, пользуясь правилом отрезков – конец коноды 2г» показывает, что в т. «в» существуют зерна Вп. Кристаллиты В называют вторичными, т.к. они выделяются из
-раствора должна выделяться фаза, богатая компонентом В. Эту фазу определяем, пользуясь правилом отрезков – конец коноды 2г» показывает, что в т. «в» существуют зерна Вп. Кристаллиты В называют вторичными, т.к. они выделяются из  -раствора; в отличие от Вп кристаллы В1 выделяются из жидкой фазы.
-раствора; в отличие от Вп кристаллы В1 выделяются из жидкой фазы.
Рассмотрим кристаллизацию эвтектического сплава (62% В). В т.S жидкость кристаллизуется при постоянной температуре с получением эвтектики ( 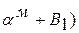 см. коноду MN (рис. 5.12). Ниже т.S состав кристаллов
см. коноду MN (рис. 5.12). Ниже т.S состав кристаллов  изменяется, т.к. растворимость падает, и из
изменяется, т.к. растворимость падает, и из  выделяются кристаллики Вп (обычно в виде сетки по границам зерен
выделяются кристаллики Вп (обычно в виде сетки по границам зерен  ). Таким образом, при комнатой температуре сплав будет состоять из
). Таким образом, при комнатой температуре сплав будет состоять из 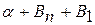 , т.е. из
, т.е. из 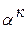 , содержащего 10% В, и кристаллов В.
, содержащего 10% В, и кристаллов В.
При кристаллизации доэвтектического сплава П в т.4 из жидкости начинают выделяться кристаллы  -раствора. В т.5 оставшаяся жидкость кристаллизуется с образованием эвтектики. В результате, после затвердевания в т.5 сплав состоит из
-раствора. В т.5 оставшаяся жидкость кристаллизуется с образованием эвтектики. В результате, после затвердевания в т.5 сплав состоит из 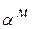 +эвт (
+эвт ( 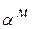 +В1). С понижением температуры из
+В1). С понижением температуры из  (состава точки М – 30% В) начинают выделяться кристаллы Вп. При комнатной температуре сплав состоит из
(состава точки М – 30% В) начинают выделяться кристаллы Вп. При комнатной температуре сплав состоит из 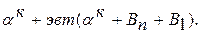 Кристаллизация сплава 3: в т.6 из жидкости начинают выделяться кристаллы В1. В т.7 оставшаяся жидкость состав т.S кристаллизуется в эвтектику. Ниже т.7 сплав состоит из В1+эвт (
Кристаллизация сплава 3: в т.6 из жидкости начинают выделяться кристаллы В1. В т.7 оставшаяся жидкость состав т.S кристаллизуется в эвтектику. Ниже т.7 сплав состоит из В1+эвт ( 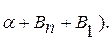
диаграмма 3 типа (3-й вариант) – рис. 5.13.а, б
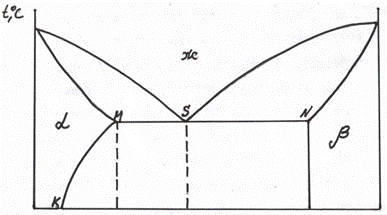
Рис. 5.13, а Диаграмма 3 типа (3-й вариант) – заполнены только однофазные области
Заполняем диаграмму, начиная с однофазных областей:  -раствор В и А;
-раствор В и А;  -раствор А и В и жидкость (рис. 5.13, а).
-раствор А и В и жидкость (рис. 5.13, а).
Остальные области двухфазные, поэтому заполняем, пользуясь правилом отрезков (рис. 5.13, б): в т.S образуется эвтектика из 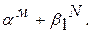 С понижением температуры из
С понижением температуры из  -раствора выделяются кристаллы
-раствора выделяются кристаллы  , т.к. растворимость падает по кривой МК. Заполненная диаграмма представлена на рис. 5.13, б.
, т.к. растворимость падает по кривой МК. Заполненная диаграмма представлена на рис. 5.13, б.
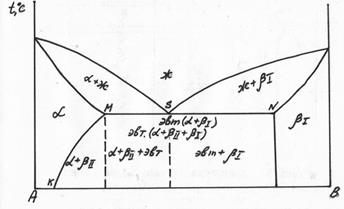
Рис. 5.13, б диаграмма 3 типа (3-й вариант)-
заполнены одно- и двухфазные области
Диаграмма состояния 4 типа(случай устойчивого химического соединения). Если компоненты вступают в химическое соединение, то на диаграмме появляется новое вещество и диаграмма разбивается на две (рис. 5.14).
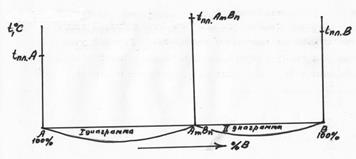
Рис. 5.14 Начало построения диаграммы 4 типа.
На каждом из этих участков диаграммы может быть диаграмма 1. 2 или 3 типа. Например, один из вариантов диаграммы 4 типа представлен на рис. 5.15.
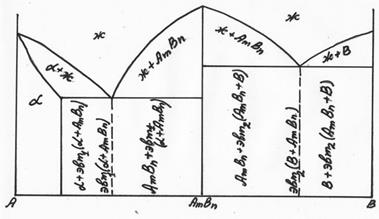
Рис. 5.15 Диаграмма 4 типа (один из вариантов)
Сначала заполняем однофазные области (ж) и (  ), затем в т.S и С определяем эвтектики (эвт.1 и эвт.2). Остальные области заполняем, пользуясь правилом отрезков (см. рис. 5.15).
), затем в т.S и С определяем эвтектики (эвт.1 и эвт.2). Остальные области заполняем, пользуясь правилом отрезков (см. рис. 5.15).
Похожие статьи:
poznayka.org
диаграмма состояния - это... Что такое диаграмма состояния?
* * *
ДИАГРАММА СОСТОЯНИЯДИАГРА́ММА СОСТОЯ́НИЯ, диаграмма равновесия, фазовая диаграмма, графическое изображение равновесных фазовых состояний одно- или многокомпонентных систем при разных значениях параметров, определяющих эти состояния. Диаграммы состояния изображают фазовый состав системы при разных концентрациях компонентов (Х), температурах (Т) и давлении (Р). Диаграммы являются пространственными. Мерность пространства зависит от числа независимых переменных, функцией которых является фазовый состав. Диаграмма состояния может быть двумерной, трехмерной и многомерной. Переменные (Р, Т, Х) являются координатами, в которых строится диаграмма. Каждая точка диаграммы состояния (фигуративная точка) указывает на фазовый состав вещества при заданных значениях термодинамических параметров (координат этой точки). Когда система состоит только из одного компонента, диаграмма состояния представляет собой трехмерную пространственную фигуру, построенную в трех прямоугольных координатных осях, по которым откладывают температуру (Т), давление (Р) и мольный объем (v). На практике часто применяют проекцию диаграммы состояния на одну из координатных плоскостей, обычно на плоскость Р — Т. Чаще всего строят диаграммы фазового равновесия в координатах концентрация — температура (диаграммы Т-Х). В этом случае для двухкомпонентных систем диаграммы изображаются на плоскости. Для трехкомпонентных систем диаграммы строятся в трехмерном пространстве. Диаграммы систем с числом компонентов более трех требуют специальных сложных приемов для своего построения. Если давление также является переменным, то и для двухкомпонентных систем диаграммы являются трехмерными (Р-Т-Х диаграммы). При исследовании равновесия фаз в условиях переменного давления строят изобарическое и изоконцентрационное сечения и проекции на плоскости Т-Р или Т-Х. С помощью диаграмм состояния для данных равновесных условий можно определить число фаз в системе, относительное количество каждой из фаз, состав каждой фазы и ее природу (чистый компонент, твердый раствор, соединение). Экспериментальное и теоретическое построение диаграмм состояния является главным путем в решении проблемы описания гетерогенных равновесий при анализе реальных систем. Основными методами построения диаграмм состояния являются методы физико-химического анализа, основы которого были разработаны акад. Н. С. Курнаковым (см. КУРНАКОВ Николай Семенович). В основе физико-химического анализа лежит изучение функциональной зависимости между значениями физических свойств и параметрами Р, Т, Х. Знание этих зависимостей позволяет устанавливать физико-химическую природу фаз и границы их существования. Экспериментальное построение диаграммы состояния осуществляется с применением данных различных физических методов измерения свойств, термических и рентгенографических анализов, оптической и электронной микроскопии, дилатометрии. Распространенным методом является построение диаграмм состав- свойство. В основе геометрического анализа диаграмм состав-свойство (в общем случае — переменный фактор-свойство) лежат принцип непрерывности и принцип соответствия. Согласно принципу непрерывности, при непрерывном изменении химического состава системы (или других переменных факторов Т и Р), не сопровождающемся изменением фазового состава (числа фаз), непрерывно и плавно меняются и свойства системы. Согласно принципу соответствия, каждому химическому индивидууму, каждой фазе и каждому фазовому равновесию отвечает определенный образ на диаграмме состояния: составам, отвечающим химическим соединениям, соответствуют максимумы или минимумы на диаграммах состав-свойство, каждой фазе, выделяющейся из расплава (при кристаллизации), или твердого раствора, соответствует своя линия на двойной диаграмме и т. д. Все линии на двойных или тройных диаграммах состояния ограничивают фазовые области, число фаз в которых различаются на единицу. При анализе диаграмм состояния пользуются правилом фаз Гиббса, устанавливающим наибольшее число фаз, которые могут находиться в равновесии и число независимых параметров, изменение которых не нарушает фазового состояния вещества. Изучение диаграмм состояния помогает выбрать оптимальные составы смесей и сплавов, определить эффективность процессов разделения и глубокой очистки веществ при перегонке, зонной плавке и т. д. Диаграммы состояния используют на практике в материаловедении, металлургии, металловедении, химии, геологии и др.
Энциклопедический словарь. 2009.
- диагональ
- диаграмма
Смотреть что такое "диаграмма состояния" в других словарях:
ДИАГРАММА СОСТОЯНИЯ — [phase equilibrium diagram) графическое изображение фазовых равновесий при разных значениях термодинамических параметров: температуры, давления и концентраций компонентов в фазах. В случае систем, не содержащих газовую фазу, слабым влиянием… … Металлургический словарь
ДИАГРАММА СОСТОЯНИЯ — диаграмма равновесия, фазовая диаграмма, графич. изображение равновесных состояний (см. Равновесие термодинамическое) в ва в виде точек в n мерном пространстве, по осям координат к рого отложены п независимых параметров состояния рассматриваемой… … Большой энциклопедический политехнический словарь
ДИАГРАММА СОСТОЯНИЯ — (фазовая Диаграмма) графическое изображение соотношения между параметрами состояния термодинамически равновесной системы (температурой, давлением, составом и др.). Диаграмма состояния позволяет определить, сколько и каких конкретно фаз образуют… … Большой Энциклопедический словарь
ДИАГРАММА СОСТОЯНИЯ — (диаграмма равновесия, фазовая диаграмма), геом. изображение равновесных состояний термодинамич. системы при разных значениях параметров, определяющих эти состояния: темп ры Т, давления р, состава системы (концентраций компонентов xi), мольного… … Физическая энциклопедия
Диаграмма состояния — диаграмма равновесия, фазовая диаграмма, графическое изображение соотношений между параметрами состояния физико химической системы (температурой, давлением и др.) и её составом. В простейшем случае, когда система состоит только из одного… … Большая советская энциклопедия
ДИАГРАММА СОСТОЯНИЯ — (фазовая диаграмма) графическое изображение равновесных состояний вещества в виде точек в n мерном пространстве, по осям координат которого отложены n независимых параметров состояния (объём, давление, температура, (см.), концентрации веществ и… … Большая политехническая энциклопедия
Диаграмма состояния — (фазовая) – графическое изображение всех возможных фазовых состояний термодинамической системы в пространстве основных параметров состояния – температуры, давления, объема или состава для многокомпонентных систем. [Ушеров Маршак А. В … Энциклопедия терминов, определений и пояснений строительных материалов
диаграмма состояния — Геометрическое изображение фазовых равновесий при разных значениях термодинамич. параметров: темп ры, давления и концентраций компонентов в фазах. В случае систем, не содержащих газ. фазу, слабым влиянием давления на фазовые равновесия обычно… … Справочник технического переводчика
диаграмма состояния — [phase equilibrium diagram] геометрическое изображение фазовых равновесий при разных значениях термодинамических параметров: температуры, давления и концентраций компонентов в фазах. В случае систем, не содержащих газовую фазу, слабым влиянием… … Энциклопедический словарь по металлургии
ДИАГРАММА СОСТОЯНИЯ — (фазовая диаграмма), графич. изображение всех возможных состояний термодинамич. системы в пространстве осн. параметров состояния т ры Т, давления ри состава х(обычно выражаемого молярными или массовыми долями компонентов). Для сложных систем,… … Химическая энциклопедия
dic.academic.ru
Диаграммы состояния. Примеры решения | СТУДЕНТОРИЙ
Задание 1
- Описать все превращения по диаграмме(название диаграммы, описание всехточек, линий, фаз и структур).
- Определить с помощью правила отрезков: a. структуру сплава с 20%В при Т= 400°C b. химический состав сплава по структуре Qβ= 33%, Qα= 67% при Т= 200°CОпределить химический состав найденных (задание а) и заданных (заданиеb) фаз.
- Начертить кривую охлаждения для сплава содержащего15%В.
- Определить число степеней свободы для сплава с 30%В при Т= 300°C
Решение
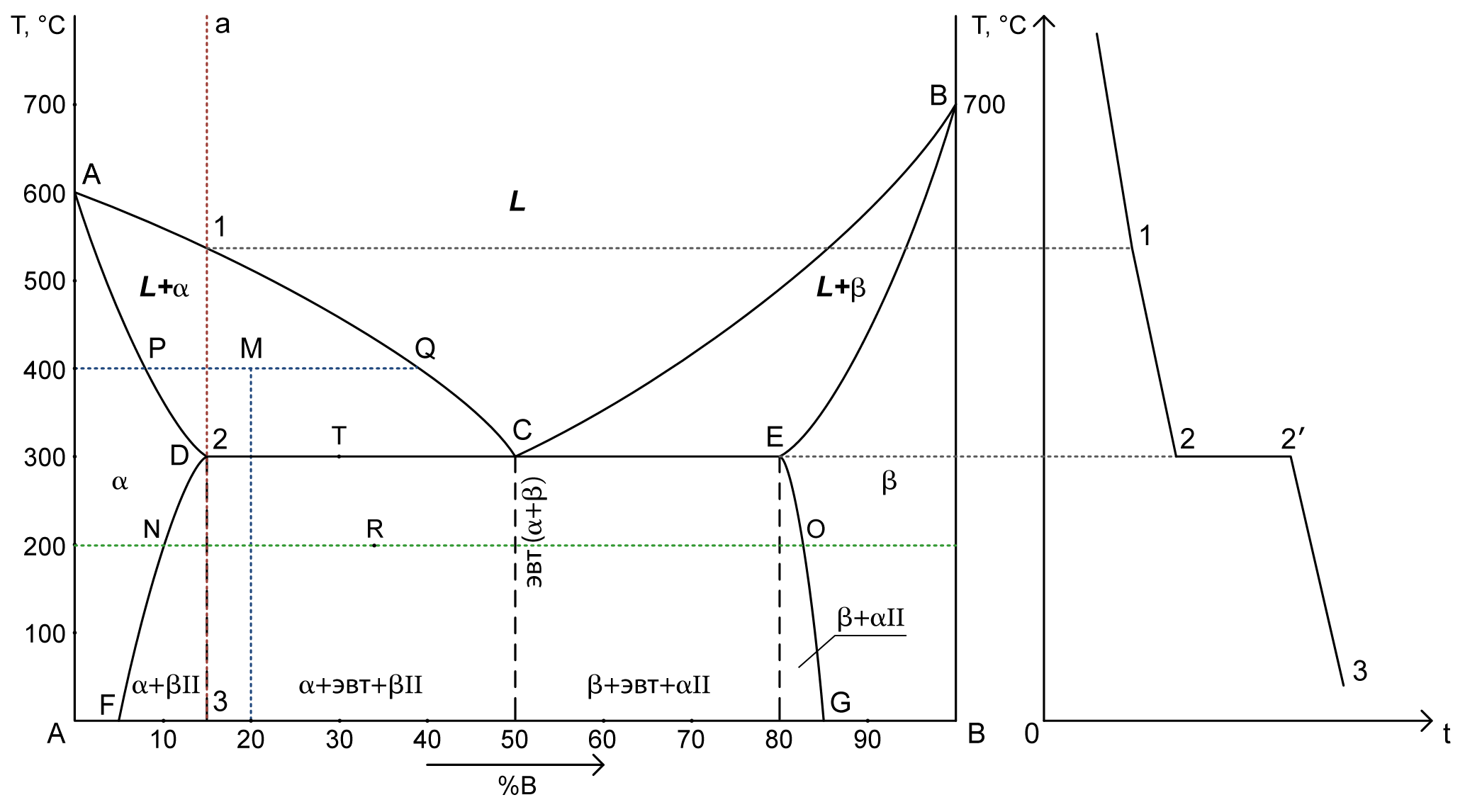
1. Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии.
2 компонента:
- A – температура плавления компонента A
- B – температура плавления компонента B
3 фазы:
- L – жидкость
- α – кристаллы твердого раствора A
- β – кристаллы твердого раствора B
ACB – ликвидус
ADCEB – солидус
DF – линия предельной растворимоси компонента B в A
EG – линия предельной растворимоси компонента A в B
2. a) Структура сплава 20%В при Т= 400°C – точка M.
PM – твердый раствор α: 7% B => 93% A. Cα= 7% B+ 93% A
MQ – жидкость: 40% B => 60% A. Cж= 40% B+ 60% A
Qα= (MQ/PQ)·100% = (40-20)/(40-7)·100% = 60,6%
Qж= 100%-60,6% = 39,4% (Или: (PM/PQ)·100% = (20-7)/(40-7)·100% = 39,4%)
b) химический состав сплава по структуре Qβ= 33%, Qα= 67% при Т= 200°C – точка R.
Qβ/Qобщ= RN/NO = 33%/100%RN/(83-10) = 33/100RN ≈ 24
B = 10+24=34% => A = 66%
Cсплава= 34%B + 66%A
Cα= 10%B + 90%A
Cβ= 83%B + 17%A
3. Кривая охаждения для сплава 15%В – a
4. Число степеней свободы для сплава с 30%В при Т= 300°C – точка T.
C = 2-3+1 = 0 (компоненты (A, B) – фазы (α, β, эвтектика) + 1)
Задание 2
- Описать все превращения по диаграмме(название диаграммы, описание всехточек, линий, фаз и структур).
- Определить с помощью правила отрезков: a. структуру сплава с 30%В при Т= 200°C b. химический состав сплава по структуре Qβ= 40%, Qж= 60% при Т= 300°CОпределить химический состав найденных (задание а) и заданных (заданиеb) фаз.
- Начертить кривую охлаждения для сплава содержащего 90%В.
- Определить число степеней свободы для сплава с 10%В при Т= 300°C
Решение
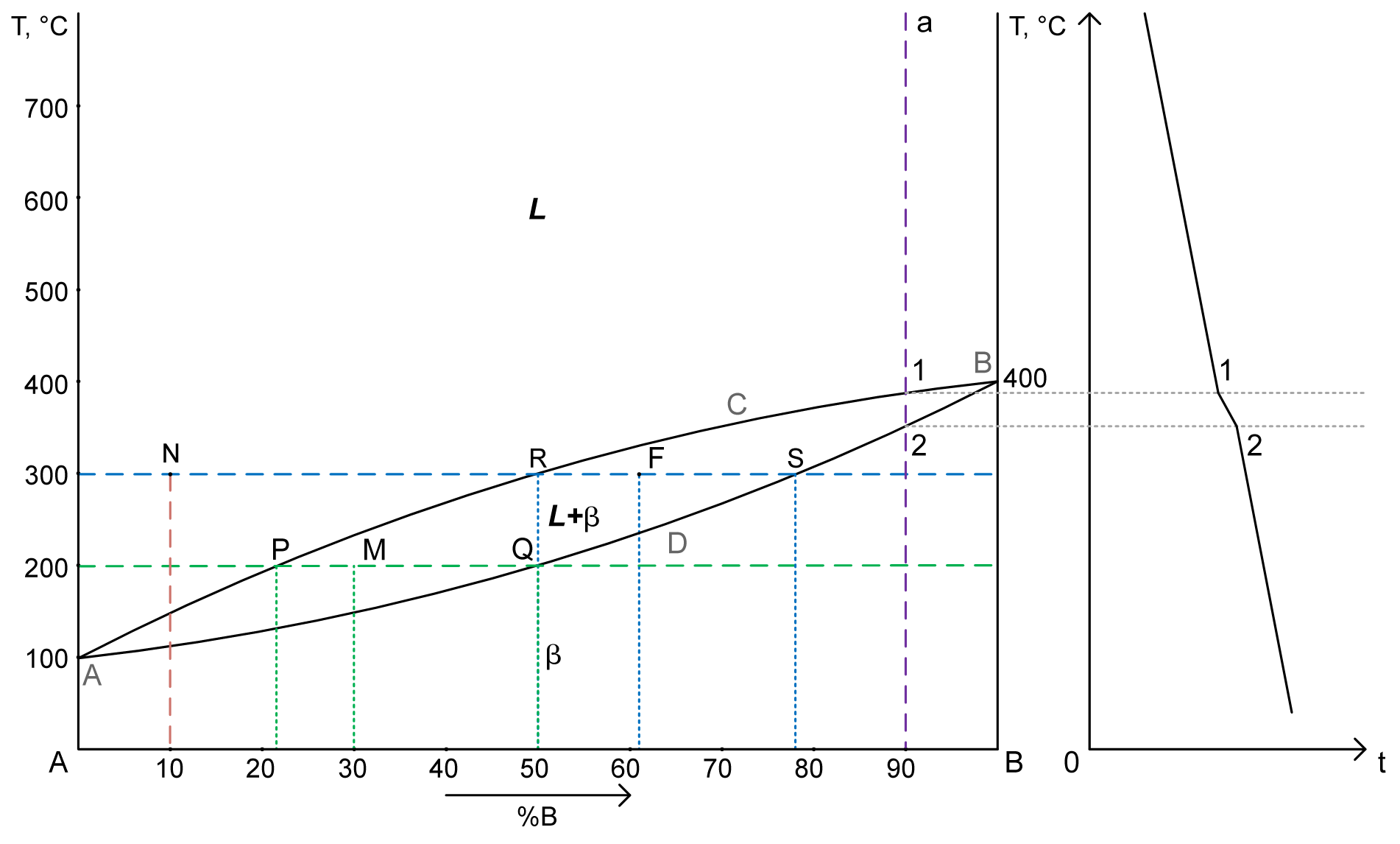
1. Диаграмма состояния сплавов с неограниченной растворимостью в твердом состоянии.
2 компонента:
- A – температура плавления компонента A
- B – температура плавления компонента B
2 фазы:
- L – жидкость
- β – кристаллы твердого раствора
ACB – ликвидус
ADB – солидус
2. a) Структура сплава 30%В при Т= 200°C – точка M.
PM – жидкость: 21% B => 79% A. Cж= 21% B+ 79% A
MQ – кристаллы твердого раствора: 50% B => 50% A. Cтв= 50% B+ 50% A
Qж= (MQ/PQ)·100% = (50-30)/(50-21)·100% = 69%
Qтв= 100%-69% = 31% (Или: (PM/PQ)·100% = (30-21)/(50-21)·100% = 31%)
b) химический состав сплава по структуре Qβ= 40%, Qж= 60% при Т= 300°C – точка F.
Qβ/Qобщ= RF/RS = 40%/100%RF/(78-50) = 40/100RF ≈11
B = 50+11=61% => A = 39%
Cсплава= 61%B + 39%A
Cβ= 78%B + 22%A
Cж= 50%B + 50%A
3. Кривая охаждения для сплава 90%В – a
4. Число степеней свободы для сплава с 10%В при Т= 300°C – точка N.
C = 2-1+1 = 2 (компоненты (A, B) – фазы (жидкость) + 1)
По Лукашова Т.В. Варианты заданий и пример решения по двухкомпонентным диаграммам состояния [Текст]: Методическое указание / Т.В.Лукашова, М.М.Сычев, С.И. Гринева. – СПб.: СПбГТИ(ТУ), 2008. – 41 с.
studentoriy.ru