КАК ПОЛУЧИТЬ КИСЛОРОД из ВОЗДУХА. Кислород как получить
КАК ПОЛУЧИТЬ КИСЛОРОД из ВОЗДУХА
ОГНЕННЫЙ ВОЗДУХ
О оздух не является химическим соединением отдельных газов. Теперь известно, что он представляет собою смесь из азота, кислорода и так называемых редких газов: аргона, неона, криптона, ксенона и гелия. Кроме того, воздух содержит ничтожные количества водорода и углекислого газа.
Главная составная часть воздуха — азот. Он занимает больше 3Д всего объёма воздуха. Пятую часть воздуха составляет «огненный воздух» — кислород. А на долю остальных газов приходится около одной сотой части.
Каким же образом удаётся разделить эти газы и получить из воздуха чистый кислород?
30 лет назад сравнительно широко применялся химический способ получения кислорода. Для этого использовалось соединение металла бария с кислородом — оки-сь бария. Это вещество имеет одно интересное свойство. Нагретая до тёмнокрасного цвета (примерно до 540 градусов) окись бария энергично соединяется с кислородом воздуха, образуя при этом новое более богатое кислородом вещество — перекись бария. Однако при дальнейшем нагревании перекись бария разлагается, выделяет кислород и снова превращается в окись. Кислород при
Этом улавливается и собирается в особые сосуды — баллоны, а перекись бария охлаждается до 540 градусов, чтобы снова получить способность извлекать кислород из воздуха.
Кислородные установки, работавшие по такому способу, давали несколько кубических метров газа в час. Однако они были дороги, громоздки и неудобны. Кроме того, окись бария при работе постепенно теряла свои поглотительные свойства и её приходилось часто менять.
Всё это привело к тому, что с течением времени химический способ получения кислорода из воздуха был вытеснен другими, более совершенными.
Наиболее просто удаётся выделить кислород из воздуха в том случае, если воздух предварительно превращён в жидкость.
Жидкий воздух при обычном атмосферном давлении имеет крайне низкую температуру—минус 192 градуса, то-есть на 192 градуса ниже точки замерзания воды. Но температура ожижения отдельных газов, входящих в состав воздуха, не одинакова. Жидкий азот, например, кипит и испаряется при температуре минус 196 градусов, а кислород при минус 183 градуса. Эта разница в 13 градусов и позволяет разделить жидкий воздух на составляющие его газы.
Если налить жидкий воздух в какой-либо сосуд, он энергично закипит и очень быстро испарится. При этом в первые моменты испаряется преимущественно азот, и жидкий воздух всё больше обогащается кислородом. Этот процесс и положен в основу устройства специальных аппаратов, применяющихся для разделения воздуха.
В настоящее время жидкий воздух широко используют для промышленного получения кислорода. Однако, чтобы превратить атмосферный воздух в жидкое состояние, его нужно охладить до весьма низкой температуры. Поэтому современный метод получения жидкого воздуха называется методом глубого охлаждения.
Глубокое охлаждение воздуха ведут в специальных машинах. Но, прежде чем рассказать об их работе, нам необходимо познакомиться с несколькими простейшими физическими явлениями.
МЕТАЛЛО-ХИМИЧЕСКИЙ КОМБИНАТ БУДУЩЕГО
П Омечтаем немного о будущем... 195... год. Наш автомобиль мчится по сверкающему асфальту загородного шоссе. По сторонам, в тени деревьев, мелькают красивые жилые здания. Машина быстро влетает на пригорок, и …
КИСЛОРОД В ПРОМЫШЛЕННОСТИ и в жизни
В этой книге мы могли остановиться лишь на отдельных примерах практического использования кислорода. На самом деле область применения «огненного воздуха» значительно шире. Одной из важнейших задач техники наших дней является …
КИСЛОРОДНОЕ ДУТЬЁ В МЕТАЛЛУРГИИ
К Ислород активно поддерживает горение. Значит, его целесообразно применять прежде всего в тех процессах, которые связаны с горением, с получением высоких температур. Таким процессом, помимо газификации твёрдых топлив, является производство …
msd.com.ua
Как в домашних условиях получить кислород
Всем привет!
Написала я «легко и быстро» в названии стать и взгрустнула – вот так легко и быстро прошел мой отпуск. Месяц пролетел совсем незаметно, завтра на работу. И хочется, и не хочется. Хочется – потому что уже устала быть дома, хоть и не скажу, что сидела в четырех стенах, наоборот, крутилась как белка в колесе. Не хочется – потому что знаю заранее, что с первой же минуты навалится такое количество работы, что ой-ой-ой, буду разгребать до начала июня.
Впрочем, нет смысла заранее паниковать, будем решать проблемы по мере их поступления ![]()
А пока продолжаю тематику перекиси и гидроперита и хочу предложить легкий способ, как получить кислород в домашних условиях. Сначала хотела включить этот опыт в предыдущую статью по опытам с перекисью и гидроперитом, но потом передумала и решила сделать отдельный пост на эту тему, так как опыт достаточно интересный и совсем не сложный.
Что вам понадобится:
- 10 таблеток гидроперита;
- 100 мл воды;
- марганцовка;
- какая-нибудь емкость, лучше, если она будет высокая и узкая.

Да, чуть не забыла. Само собой, понадобится то, чем будем проверять наличие кислорода, то есть какая-нибудь тонкая щепка-лучинка, которую легко зажечь и которая потом хорошо тлеет. Также вам понадобятся спички или зажигалка. Далеко их не убирайте, они должны быть под рукой.
Делается все быстро и просто.
Растворяем в воде гидроперит. Напоминаю, что в холодной воде растворяется он плохо, лучше взять очень теплую воду.

Если хотите, можно предварительно измельчить таблетки. Я никуда не торопилась, поэтому не стала их измельчать.
Переливаем полученный раствор в бутылочку. И аккуратно на кончике ножа сыпем в нее немного кристаллической марганцовки. Напоминаю о правилах ТБ! Не берите марганцовку руками!
Раствор бурно шипит, начинается выделение газа. Теперь нужно действовать быстро. Поджигаем заранее приготовленную лучинку и, помахивая, тушим ее, оставив на кончике тлеющий огонек.

Опускаем тлеющую лучинку в бутылочку, где идет выделение газа. Она мгновенно вспыхивает ослепительно ярким светом.

Таким образом, мы подтверждаем, что при реакции гидроперита с перманганатом калия выделяется кислород, который поддерживает горение и заставляет лучинку ярко загореться.
Вот и все. Таким несложным опытом вы самостоятельно получили кислород и подтвердили его свойство поддерживать горение.
Только напоминаю: не забывайте о правилах химической и пожарной безопасности! Будьте очень внимательны и аккуратны при проведении опыта!
На этом все на сегодня. И напоследок – немножко моих любимцев ![]()
Всем хорошего настроения!
Наталья Брянцева
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+, В контакте, Одноклассники , Facebook, Twitter
kidschemistry.ru
Кислород и его получение
Здравствуйте. Вы уже читали мои статьи в блоге Tutoronline.ru. Сегодня я расскажу Вам о кислороде и о способах его получения. Напоминаю, если у Вас будут ко мне вопросы, Вы можете писать их в комментариях к статье. Если же Вам понадобиться любая помощь по химии, записывайтесь на мои занятия в расписании. Буду рад Вам помочь.
Кислород распространён в природе в виде изотопов 16О, 17О, 18О, которые имеют следующее процентное содержание на Земле – 99,76%, 0,048%, 0,192% соответственно.
В свободном состоянии кислород находится в виде трёх алло-тропных модификаций: атомарного кислорода - Оо , дикислорода – О2 и озона – О3. Причём, атомарный кислород может быть получен следующим образом:
КClO3 = KCl + 3O0
KNO3 = KNO2 + O0
Кислород входит в состав более 1400 различных минералов и органических веществ, в атмосфере его содержание составляет 21% по объёму. А в человеческом теле содержится до 65% кислорода. Кислород газ без цвета и запаха, мало растворим в воде (в 100 объёмах воды при 20оС растворяется 3 объёма кислорода).
В лаборатории кислород получают умеренным нагреванием некоторых веществ:
1) При разложении соединений марганца (+7) и (+4):
2KMnO4 → K2MnO4 + MnO2 + O2 перманганат манганат калия калия
2MnO2 → 2MnO + O2
2) При разложении перхлоратов:
2KClO4 → KClO2 + KCl + 3O2перхлорат калия
3) При разложении бертолетовой соли (хлората калия).При этом образуется атомарный кислород:
2KClO3 → 2 KCl + 6O0хлорат калия
4) При разложении на свету солей хлорноватистой кислоты - гипохлоритов:
2NaClO → 2NaCl + O2
Ca(ClO)2 → CaCl2 + O2
5) При нагревании нитратов. При этом образуется атомарный кислород. В зависимости от того, какое положение в ряду активности занимает металл нитрата, образуются различные продукты реакции:
2NaNO3 → 2NaNO2 + O2
Ca(NO3)2 → CaO + 2NO2 + O2
2AgNO3 → 2 Ag + 2NO2 + O2
6) При разложении пероксидов:
2h3O2 ↔ 2h3O + O2
7) При нагревании оксидов неактивных металлов:
2Аg2O ↔ 4Аg + O2
Данный процесс имеет актуальное значение в быту. Дело в том, что посуда, изготовленная из меди или серебра, имея естественный слой оксидной плёнки, при нагревании образует активный кислород, что является антибактериальным эффектом. Растворение солей неактивных металлов, особенно нитратов, также приводит к образованию кислорода. Например, суммарный процесс растворения нитрата серебра можно представить по этапам:
AgNO3 + h3O → AgOH + HNO3
2AgOH → Ag2O + O2
2Ag2O → 4Ag + O2
или в суммарном виде:
4AgNO3 + 2h3O → 4Ag + 4HNO3 + 7O2
8) При нагревании солей хрома высшей степени окисления:
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3 O2бихромат хромат калия калия
В промышленности кислород получают:
1) Электролитическим разложением воды:
2Н2О → 2Н2 + О2
2) Взаимодействием углекислого газа с пероксидами:
СО2 + К2О2 →К2СО3 + О2
Данный способ представляет собой незаменимое техническое решение проблемы дыхания в изолированных системах: подводных лодках, шахтах, космических аппаратах.
3) При взаимодействии озона с восстановителями:
О3 + 2КJ + h3O → J2 + 2KOH + O2
Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
2Н2О = 4е + 4Н + О2
Накопившиеся протоны способствуют синтезу АТФ:
АДФ + Ф = АТФ
В темновую фазу происходит преобразование углекислого газа и воды в глюкозу. И побочно выделяется кислород:
6СО2 + 6Н2О = С6Н12О6 + О2
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Как получают кислород
Как получают кислород:
В лаборатории кислород получают, нагревая легко разлагающиеся вещества, например, бертолетову соль, которая начинает кипеть при 400°C и происходит её разложение с выделением газа:
2KClO3 
Символ температуры (t) над равенством означает, что реакция происходит при нагревании. А стрелка вверх (↑) показывает, что выделяется газ.
Чтобы реакция проходила при меньшей температуре в 200 °C, к бертолетовой соли добавляют катализатор - вещество, которое ускоряет реакцию. Реакции с катализатором называют катализом. В данном случае добавляют оксид марганца MnO2
Реакцию записывают так:
2KClO3 2KCl + 3O2 ↑
Полученный кислород вытесняет воздух из пробирки. Чтобы воздух не смешивался с кислородом обратно, ему не дают вернуться, с помощью неплотного прикрытия пробирки бумагой или ваткой.
Если в пробирке кислород, то поднесенная тлеющая лучинка будет вспыхивать около отверстия.
Существуют и другие способы получения кислорода.

Полученный кислород сжимают под давлением до 150 атмосфер, чтобы он превратился в жидкость и закачивают в специальные баллоны с голубой окраской.
Добавить новость и получить деньги
uchilegko.info
Как получить из воды кислород?
#1
Значение кислорода для человека неоценимо велико. Он необходим для дыхания живых организмов, активно участвует в процессах горения. Получением кислорода занимаются растения. Именно в их зеленых листьях осуществляется важный процесс фотосинтеза, который и обогащает атмосферу земли этим ценным газом. А возможно ли получать кислород человеку? Промышленным способом его добывают из воздуха. При этом воздух сжижают и одновременно очищают. Но ведь на земной поверхности огромные запасы простого вещества воды, в химический состав которой входит кислород. Соответственно, еще один способ получения кислорода – это разложение воды. Причем осуществить данный процесс можно даже в домашних условиях.
#2
Для этого понадобится гальваническая ванна, в которую наливается вода на высоту, превышающей середину ванны. В воду надо добавить до 2 мл разбавленной серной кислоты или едкого натра. Это делается для усиления электропроводности воды. Кроме того, необходимо взять два пластмассовых стакана. В дне каждого из них делается отверстие. Через него внутрь стакана помещается угольная пластина - электрод. Можно использовать и другой металл в качестве электрода (медный или железный) . А воздушную прослойку между такой пластиной и стаканом нужно хорошо заизолировать. Электроды помещаются в воду так, чтобы стаканы расположились вверх дном. А воздуха между дном стакана и поверхностью воды должно быть как можно меньше.
#3
К верхней части каждого электрода припаивается металлический провод. Этими проводами электроды подключают к полюсам источника питания. Электрод, подключенный к отрицательному полюсу, называется катодом. А положительный электрод – анодом. В результате, при прохождении через воду электрического тока происходит электролиз воды. Химическая реакция идет по такому типу 2 h3O→2 h3+O2. Как видно из уравнения, образуется два газа. На катоде внутри стакана собирается водород, а на аноде – кислород. Образование газов можно наблюдать по поднимающимся из воды пузырьков. Образующийся кислород можно выводить из стакана в другой сосуд с помощью трубки от капельницы. Чтобы убедиться в наличии кислорода, можно внести в сосуд тлеющую лучину. Она ярко вспыхнет.
#4
Любой химический опыт должен проводиться с соблюдением техники безопасности. Так и в этом случае нельзя смешивать эти два вида полученных газов. Также нужно избегать смешивания водорода с воздухом. Надо помнить, что водород взрывоопасен. Получение кислорода из воды приведенным способом дает небольшое количество данного газа. Образующийся кислород дополнительно вступает в реакцию с углем (материалом анода) с образованием примеси (углекислого газа) . Избежать этого можно, но надо использовать инертный электрод в виде металлической пластины, покрытой слоем платины или золота. . Такие устройства для получения кислорода называются электролизеры. Правда, количество получаемого кислорода невелико, и процесс требует больших затрат электроэнергии. Зато поиск исходного вещества (воды) не вызовет затруднений.
uznay-kak.ru
КАК ПОЛУЧИТЬ КИСЛОРОД ИЗ ВОЗДУХА
Воздух не является химическим соединением отдельных газов. Теперь известно, что он представляет собою смесь из азота, кислорода и так называемых редких газов: аргона, неона, криптона, ксенона и гелия. Кроме того, воздух содержит ничтожные количества водорода и углекислого газа.
Главная составная часть воздуха – азот. Он занимает больше 3/4 всего объёма воздуха. Пятую часть воздуха составляет «огненный воздух» – кислород. А на долю остальных газов приходится около одной сотой части.
Каким же образом удаётся разделить эти газы и получить из воздуха чистый кислород?
30 лет назад сравнительно широко применялся химический способ получения кислорода. Для этого использовалось соединение металла бария с кислородом – окись бария. Это вещество имеет одно интересное свойство. Нагретая до тёмнокрасного цвета (примерно до 540 градусов) окись бария энергично соединяется с кислородом воздуха, образуя при этом новое более богатое кислородом вещество – перекись бария. Однако при дальнейшем нагревании перекись бария разлагается, выделяет кислород и снова превращается в окись. Кислород при этом улавливается и собирается в особые сосуды – баллоны, а перекись бария охлаждается до 540 градусов, чтобы снова получить способность извлекать кислород из воздуха.
Кислородные установки, работавшие по такому способу, давали несколько кубических метров газа в час. Однако они были дороги, громоздки и неудобны. Кроме того, окись бария при работе постепенно теряла свои поглотительные свойства и её приходилось часто менять.
Всё это привело к тому, что с течением времени химический способ получения кислорода из воздуха был вытеснен другими, более совершенными.
Наиболее просто удаётся выделить кислород из воздуха в том случае, если воздух предварительно превращен в жидкость.
Жидкий воздух при обычном атмосферном давлении имеет крайне низкую температуру – минус 192 градуса, то-есть на 192 градуса ниже точки замерзания воды. Но температура ожижения отдельных газов, входящих в состав воздуха, не одинакова. Жидкий азот, например, кипит и испаряется при температуре минус 196 градусов, а кислород при минус 183 градуса. Эта разница в 13 градусов и позволяет разделить жидкий воздух на составляющие его газы.
Если налить жидкий воздух в какой-либо сосуд, он энергично закипит и очень быстро испарится. При этом в первые моменты испаряется преимущественно азот, и жидкий воздух всё больше обогащается кислородом. Этот процесс и положен в основу устройства специальных аппаратов, применяющихся для разделения воздуха.
В настоящее время жидкий воздух широко используют для промышленного получения кислорода. Однако, чтобы превратить атмосферный воздух в жидкое состояние, его нужно охладить до весьма низкой температуры. Поэтому современный метод получения жидкого воздуха называется методом глубокого охлаждения.
Глубокое охлаждение воздуха ведут в специальных машинах. Но, прежде чем рассказать об их работе, нам необходимо познакомиться с несколькими простейшими физическими явлениями.
Дата добавления: 2015-07-08; просмотров: 182 | Нарушение авторских прав
Читайте в этой же книге: ОБ ОДНОМ ПРОСТОМ, НО ВАЖНОМ АППАРАТЕ | ОЧИСТКА ВОЗДУХА | МАШИНЫ ГЛУБОКОГО ХОЛОДА | ОТ ВЫСОКОГО ДАВЛЕНИЯ – К НИЗКОМУ | ХОЛОДИЛЬНАЯ УСТАНОВКА НИЗКОГО ДАВЛЕНИЯ | КАК УБЕРЕЧЬ ЖИДКИЙ ВОЗДУХ ОТ ИСПАРЕНИЯ | О НЕКОТОРЫХ СВОЙСТВАХ ЖИДКОГО ВОЗДУХА | МИЛЛИОННЫЕ ДОЛИ АТМОСФЕРЫ | ОБ ИТЕРЕСНЫХ, НО МАЛО ПОЛЕЗНЫХ ПРОЕКТАХ | ПОЛУЧЕНИЕ ЧИСТОГО КИСЛОРОДА |mybiblioteka.su - 2015-2018 год. (0.006 сек.)mybiblioteka.su
Как из воды получить кислород
При электролитическом разложении воды образуется смесь газов – водорода и кислорода (как из воды получить кислород):
![Rendered by QuickLaTeX.com \[ 2H_2O \rightarrow 2H_2 + O_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4f3b45bfd48bd2f3b50144df5bbc10a3_l3.png)
Активные угли получают при действия на неактивные паров 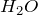 или
или 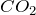 при
при 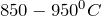 . При этом часть угля выгорает и получается активный уголь, пронизанный весьма тонкими порами с радиусом менее 1 мм. Поверхность покрыта главным образом оксидными группами, причем из-за неоднородности состава оксидов на поверхности физическая адсорбция может сопровождаться как катионо-, так и анионообменными процессами. Особое место занимают окисленные активные угли, являющиеся селективными полифункциональными катионообменниками, Они весьма устойчивы к химическим, термическим и радиационным воздействиям, их легко получить и регенерировать. Активные угли используют в качестве эффективных сорбентов для извлечения свинца из атмосферного воздуха; Са, Ва и Sr из концентрированных растворов щелочей, солей и других соединений; Cr, Мо и V из воды и рассолов ртутного электролиза. Как правило, определение элементов заканчивается непосредственно в концентрате: прямым сжиганием концентрата в канале спектрального угольного электрода или концентрат облучают потоком нейтронов или определяют элементы в концентрате рентгено-флуоресцентным методом. Окончание анализа может быть другим: после разложения сорбента, содержащего сорбированные компоненты, действием азотной кислотой в полученном растворе компоненты определяют атомно-абсорбционным, спектрофотометрическим и другими методами.
. При этом часть угля выгорает и получается активный уголь, пронизанный весьма тонкими порами с радиусом менее 1 мм. Поверхность покрыта главным образом оксидными группами, причем из-за неоднородности состава оксидов на поверхности физическая адсорбция может сопровождаться как катионо-, так и анионообменными процессами. Особое место занимают окисленные активные угли, являющиеся селективными полифункциональными катионообменниками, Они весьма устойчивы к химическим, термическим и радиационным воздействиям, их легко получить и регенерировать. Активные угли используют в качестве эффективных сорбентов для извлечения свинца из атмосферного воздуха; Са, Ва и Sr из концентрированных растворов щелочей, солей и других соединений; Cr, Мо и V из воды и рассолов ртутного электролиза. Как правило, определение элементов заканчивается непосредственно в концентрате: прямым сжиганием концентрата в канале спектрального угольного электрода или концентрат облучают потоком нейтронов или определяют элементы в концентрате рентгено-флуоресцентным методом. Окончание анализа может быть другим: после разложения сорбента, содержащего сорбированные компоненты, действием азотной кислотой в полученном растворе компоненты определяют атомно-абсорбционным, спектрофотометрическим и другими методами.
ru.solverbook.com