Ацетилен: применение в медицине, промышленности. Применение ацетилена
Ацетилен: применение в медицине, промышленности
Ацетилен относится к углеводородам ненасыщенного ряда. Это соединение, а также его различные гомологи служат сырьем для синтеза большого количества химических продуктов.
Свойства и получение ацетилена
В условиях атмосферного давления и нормальной температуры ацетилен представляет собой бесцветный газ. Если температура опускается до значения -85 градусов и ниже, то это соединение переходит в другое состояние – твердое. При этом образуются кристаллы. Следует отметить, что в жидком и твердом состоянии ацетилен может легко взрываться под воздействием трения или при ударе (гидравлическом или механическом). Именно это свойство во многом обусловливает его область применения. Реакции горения ацетилена происходят в присутствии кислорода. В результате данного процесса возникает пламя, характеризующееся самыми высокими показателями температуры (3150 градусов) по сравнению с другими видами горючего.
Основным способом получения ацетилена является реакция, в которой взаимодействуют карбид кальция и вода. Данный процесс протекает при показателях температуры около 2000 градусов и является эндотермическим.
Существует такое понятие, как выход ацетилена. Это такое его количество, которое выделяется в результате разложения 1 кг карбида кальция. ГОСТ 1460-56 устанавливает конкретные значения данной величины, которая находится в прямой зависимости от степени грануляции исходного вещества. Таким образом, следствием относительно небольшого размера частиц карбида кальция является снижение выхода ацетилена.

Данная закономерность является следствием наличия в мелких частицах карбида посторонних примесей, например оксида кальция.
Существуют и другие, менее громоздкие, дорогие и энергозатратные способы получения ацетилена. Например, реакция термоокислительного пиролиза метана из природного газа; разложение нефти, керосина и других видов горючего путем электропиролиза.
Хранение и транспортировка
Все способы хранения и транспортировки предусматривают использование баллонов. Они заполняются специальной массой пористой консистенции. Ее пропитывают ацетоном, который хорошо растворяет ацетилен. Применение данного способа позволяет значительно увеличить наполняемость баллона ацетилена и, что немаловажно, понижает его взрывоопасность.
Длительное соприкосновение ацетилена с такими металлами, как медь и серебро, может привести к повышению его взрывоопасности. Следовательно, недопустимо использование материалов, которые могут содержать эти металлы, например в вентилях.

Как правило, баллоны должны иметь специальные вентили, предназначенные именно для хранения ацетилена.
Полного использования всей емкости баллона можно достигнуть, храня пустые емкости так, чтобы ацетон был распределен по всему объему баллона. А это возможно только в горизонтальном положении. Наполнение баллона должно происходить очень медленно, что важно для соблюдения условий химической реакции растворения ацетилена в ацетоне, а в частности ее скорости.
Преимущества растворенного ацетилена
Основное преимущество растворенного ацетилена перед тем, который получают с использованием переносных генераторов из карбида кальция, состоит в том, что при применении баллонов происходит повышение труда сварщика примерно на 20 %, а потери ацетилена при этом снижаются на 25 %. Также следует отметить повышение оперативности и маневренности сварочного поста, безопасность. В отличие от газа, полученного из карбида кальция, растворенный ацетилен содержит значительно меньше посторонних веществ, то есть примесей, что позволяет использовать его в особо ответственных сварочных работах.
Основные области применения ацетилена
- Сварка и резка металлов.
- Использование в качестве источника яркого, белого света. В данном случае речь идет об ацетилене, получаемом путем взаимодействия карбида кальция и воды. При этом используются автономные светильники.
- Производство взрывчатых веществ.
- Получение других соединений и материалов, которыми являются уксусная кислота, этиловый спирт, растворители, пластические массы, каучук, ароматические углеводороды.
Ацетилен: применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.

Баллоны с этим газом маркируют следующим образом: окрашивают в белый цвет и большими красными буквами наносят надпись: «Ацетилен»
Строительные работы проводятся в основном на открытом воздухе. Применение ацетилена и его гомологов в этих условиях не должно проходить под воздействием прямых солнечных лучей. Небольшие перерывы должны сопровождаться перекрыванием вентилей на горелке, а длительные – перекрыванием вентилей на самих баллонах.
В химической промышленности очень востребован ацетилен. Применение его заключается в использовании данного вещества в процессе получения продуктов органического синтеза. Это синтетический каучук, пластмассы, растворители, уксусная кислота и т.д.
Ацетилен, являясь универсальным горючим, часто используется в процессах, сопровождающихся газопламенной обработкой. Важно, что применение ацетилена в промышленности возможно только при соблюдении мер безопасности, так как он является взрывоопасным газом.
Карбидные лампы
Название «карбидная лампа» обусловлено использованием в качестве источника света открытого пламени струи сжигаемого ацетилена. Он, соответственно, получен в результате взаимодействия карбида кальция с водой.
Такие лампы были широко распространены в прошлом. Их можно было увидеть на каретах, автомобилях и даже велосипедах. В современное время карбидные лампы используют только в случае острой необходимости в мощном автономном светильнике. Так, спелеологи часто пользуются ими. Отдаленные маяки снабжают именно такими лампами, ведь такой тип освещения намного выгоднее, нежели подведение линий электропередач. Достаточно распространенным является использование таких ламп на судах дальнего плавания.
Ацетилен: применение в медицине
Как используется вещество в этой сфере? Общая анестезия предполагает применение алкинов. Ацетилен является одним из тех газов, которые используются при ингаляционном наркозе. Но повсеместное его применение в этом качестве осталось в прошлом. Сейчас появились более современные и безопасные способы анестезии.
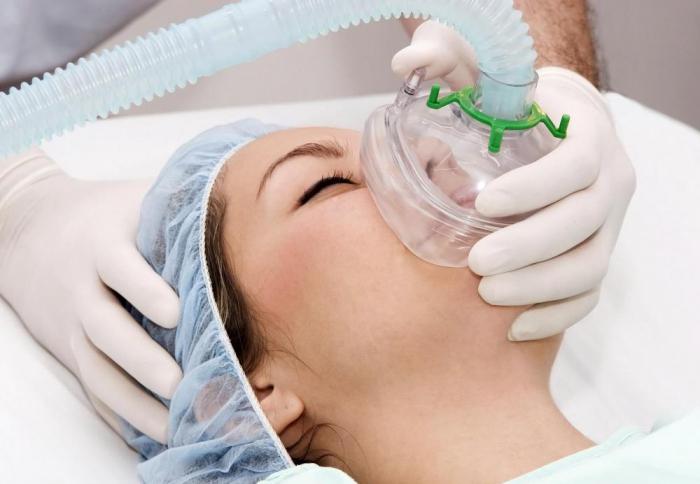
Хотя следует отметить, что и применение ацетилена не представляло большой опасности, так как прежде чем значение его концентрации во вдыхаемом воздухе дойдет до опасного предела, нижний порог горючести будет пройден.
Самым главным условием использования данного газа является соблюдение мер безопасности. Сложно переоценить, насколько опасен ацетилен. Применение его возможно только после проведения всех необходимых инструктажей с работниками различных сфер, в которых он используется.
fb.ru
Применение ацетилена в промышленности
Ацетилен – бесцветный газ, относящийся к классу алкинов. Он представляет собой химическое соединение углерода с кислородом, служащее сырьём для синтеза большого числа химических компонентов.
Он ценится за свою универсальность и недорогую стоимость. Впервые этот газ был получен Эдмундом Деви, который проводил лабораторные опыты с карбидом калия. Чуть позже опыты с получением ацетилена проводились Пьером Бертло. Физик получил чистый ацетилен, пропуская обыкновенный водород над электрической дугой. Именно Бертло назвал новое химическое соединение ацетиленом.
Основные свойства ацетилена
Ацетилен является искусственным газом, так как он не имеет природного происхождения. Он горючий и весит легче воздуха. Газообразный углеводород добывается на специальных установках из карбида кальция, который в свою очередь подвергается разложению водой. В атмосферном воздухе ацетилен горит коптящим ярким пламенем.

При давлении свыше двух атмосфер он может быть взрывоопасным. В чисто химическом виде это соединение имеет слабовыраженный эфирный запах. А технический продукт, наоборот, из-за имеющихся примесей насыщен резковатым ароматом. Ацетилен намного легче воздушных масс, в газообразном состоянии он бесцветен. Описываемое соединение растворяется во многих жидких веществах при этом, чем ниже температура, тем лучше растворимость ацетилена.
Для этого газа характерны реакции полимеризации, димеризации, цикломеризации. Ацетилен может полимеризоваться в бензол или в другие химические органические соединения, такие как полиацетин. Атомы этого газа могут отщепляться в виде протонов. И за счет этого проявляются кислотные свойства ацетилена.
Ацетилен способен спровоцировать взрыв в отсутствие кислорода как природного окислителя. И особенности горючести этого газа были открыты еще в 1895 году А. Шателье. Именно он заметил, что ацетилен, сгорая в кислоте, дает яркое пламя, температура которого может достигать выше 3000 градусов Цельсия.
Применение ацетилена
Ацетилен имеет широкий ореол распространения. При помощи своих горючих свойств он активно применяет при сварке и резке металла. Также он применяется как источник ярчайшего и белого цвета. Ацетилен, образуемый путём взаимосвязи карбида кальция и h3O используемый для автономных светильников. Он активно используется для изготовления взрывчатых веществ. Благодаря ацетилену на свет появились разнообразные растворители этилового происхождения. Без этого газа не обходятся газосварочные работы, поэтому строительные фирмы всегда заказывают ацетилен в баллонах для производства сварочных а газорежущих работ.

ацетилен широко применяется в газосварочных работах
Строительство и промышленность это две основные отрасли, в которых ацетилен нашел свое широкое применение. В частности, сварочные и автогенные работы производятся только с ним. Кроме этого ацетилен используется в процессе органического синтеза разных химических веществ.
Например, на его основе производится синтез уксусной кислоты и уксусного альдегида, синтетического каучука, поливинилхлорида. Ну и естественно, ацетилен применяется в медицине для общей анестезии, которая предполагает использование алкинов в ингаляционном наркозе.
Транспортировка
Следует сказать и о транспортировке и хранении этого газа. Ацетилен вещество потенциально взрывоопасное. И он хранится в специализированных баллонах при поддержании оптимального уровня температуры и атмосферного давления. Газ растворяют и наполняют им баллоны для транспортировки. Подобный груз считается потенциально опасным и перевозится в соответствии со специальными нормами обращения с взрывоопасными грузами.
kriogenservis.ru
Реферат.химия.ацитилен
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Московский авиационный институт
(национальный исследовательский университет)»
Реферат
на тему «Ацетилен»
Выполнил: студент
1МЕТ-1ДБ-033
Мельников Д.В.
Проверил: преподаватель
Белая А.В.
Москва 2015
СОДЕРЖАНИЕ
История открытия.
Название ацетилена по номенклатуре июпак.
Физические характеристики.
Структурная формула ацетилена.
Характеристика класса органических соединений Ацетилена.
Реакции получения ацетилена.
Характерные химические реакции ацетилена.
Области применения ацетилена.
Воздействие ацетилена на человеческий организм и окружающую среду.
Список использованной литературы.
ИСТОРИЯ ОТКРЫТИЯ
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени - от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина Ash4.
НАЗВАНИЕ АЦЕТИЛЕНА ПО НОМЕНКЛАТУРЕ ИЮПАК
Согласно номенклатуре ИЮПАК при построении названий алкинов в названиях соответствующих насыщенных углеводородов суффикс -ан заменяется суффиксом -ин. Для указания положения тройной связи и замещающих групп цепь нумеруют также, как в соответствующих алкенах. Этин также возможно именовать тривиально - ацетилен.
ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ
При нормальных условиях - бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2h3 обнаружен на Уране и Нептуне.
СТРУКТУРНАЯ ФОРМУЛА АЦЕТИЛЕНА
Рис. 1
ХАРАКТЕРИСТИКА КЛАССА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ АЦЕТИЛЕНА
Ацетилен принадлежит к классу алкинов.
Алки́ны (иначе ацетиленовые углеводороды) - углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой Cnh3n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) - газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше - в органических растворителях.
ацетилен реакция соединение формула
РЕАКЦИИ ПОЛУЧЕНИЯ АЦЕТИЛЕНА
В лаборатории ацетилен получают действием воды на карбид кальция
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ АЦЕТИЛЕНА
Основные химические реакции ацетилена (реакции присоединения):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации).
ОБЛАСТИ ПРИМЕНЕНИЯ АЦЕТИЛЕНА
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов,
- для получения технического углерода,
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации,
- в ракетных двигателях (вместе с аммиаком).
ВОЗДЕЙСТВИЕ АЦИТЕЛЕНА НА ЧЕЛОВЕЧЕСКИЙ ОРГАНИЗМ И ОКРУЖАЮЩУЮ СРЕДУ
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Ньюленд Ю., Фогт Р., Химия ацетилена, Иниздат, 1947.
Федоренко Н.П., Методы и экономика получения ацетилена, Химическая наука и промышленность, 3, т. 1, 1956.
Федоренко Н.П. Химия и химическая технология, № 3, т. I, 1956.
Размещено на Allbest.ru
studfiles.net
Газ ацетилен, физические свойства ацетилена, химические свойства ацетилена.
Газообразный
Жидкий
Ацетилен — ненасыщенный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах.Взрывоопасный. Нельзя выпускать на открытый воздух. Частицы C2h3 есть на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 3300 °C)
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекулавысокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании температура пламени достигает 3300°С. Ацетилен можетполимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метаниз эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра иодновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.), а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия.
Применение
Ацетиленовая лампа
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидка),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Безопасность
Поскольку ацетилен растворим в воде и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры. Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например N2, метаном или пропаном. При длительном соприкосновении ацетилена с медью или серебром образуется взрывчатая ацетиленистая медь или ацетиленистое серебро, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов). Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 "Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест". ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), т.к. концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100%. Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
tgko.ru
Ацетилен: применение в медицине, промышленности
Ацетилен относится к углеводородам ненасыщенного ряда. Это соединение, а также его различные гомологи служат сырьем для синтеза большого количества химических продуктов.
Свойства и получение ацетилена
В условиях атмосферного давления и нормальной температуры ацетилен представляет собой бесцветный газ. Если температура опускается до значения -85 градусов и ниже, то это соединение переходит в другое состояние – твердое. При этом образуются кристаллы. Следует отметить, что в жидком и твердом состоянии ацетилен может легко взрываться под воздействием трения или при ударе (гидравлическом или механическом). Именно это свойство во многом обусловливает его область применения. Реакции горения ацетилена происходят в присутствии кислорода. В результате данного процесса возникает пламя, характеризующееся самыми высокими показателями температуры (3150 градусов) по сравнению с другими видами горючего.
Основным способом получения ацетилена является реакция, в которой взаимодействуют карбид кальция и вода. Данный процесс протекает при показателях температуры около 2000 градусов и является эндотермическим.
Существует такое понятие, как выход ацетилена. Это такое его количество, которое выделяется в результате разложения 1 кг карбида кальция. ГОСТ 1460-56 устанавливает конкретные значения данной величины, которая находится в прямой зависимости от степени грануляции исходного вещества. Таким образом, следствием относительно небольшого размера частиц карбида кальция является снижение выхода ацетилена.

Данная закономерность является следствием наличия в мелких частицах карбида посторонних примесей, например оксида кальция.
Существуют и другие, менее громоздкие, дорогие и энергозатратные способы получения ацетилена. Например, реакция термоокислительного пиролиза метана из природного газа; разложение нефти, керосина и других видов горючего путем электропиролиза.
Хранение и транспортировка
Все способы хранения и транспортировки предусматривают использование баллонов. Они заполняются специальной массой пористой консистенции. Ее пропитывают ацетоном, который хорошо растворяет ацетилен. Применение данного способа позволяет значительно увеличить наполняемость баллона ацетилена и, что немаловажно, понижает его взрывоопасность.
Длительное соприкосновение ацетилена с такими металлами, как медь и серебро, может привести к повышению его взрывоопасности. Следовательно, недопустимо использование материалов, которые могут содержать эти металлы, например в вентилях.

Как правило, баллоны должны иметь специальные вентили, предназначенные именно для хранения ацетилена.
Полного использования всей емкости баллона можно достигнуть, храня пустые емкости так, чтобы ацетон был распределен по всему объему баллона. А это возможно только в горизонтальном положении. Наполнение баллона должно происходить очень медленно, что важно для соблюдения условий химической реакции растворения ацетилена в ацетоне, а в частности ее скорости.
Видео по теме
Преимущества растворенного ацетилена
Основное преимущество растворенного ацетилена перед тем, который получают с использованием переносных генераторов из карбида кальция, состоит в том, что при применении баллонов происходит повышение труда сварщика примерно на 20 %, а потери ацетилена при этом снижаются на 25 %. Также следует отметить повышение оперативности и маневренности сварочного поста, безопасность. В отличие от газа, полученного из карбида кальция, растворенный ацетилен содержит значительно меньше посторонних веществ, то есть примесей, что позволяет использовать его в особо ответственных сварочных работах.
Основные области применения ацетилена
- Сварка и резка металлов.
- Использование в качестве источника яркого, белого света. В данном случае речь идет об ацетилене, получаемом путем взаимодействия карбида кальция и воды. При этом используются автономные светильники.
- Производство взрывчатых веществ.
- Получение других соединений и материалов, которыми являются уксусная кислота, этиловый спирт, растворители, пластические массы, каучук, ароматические углеводороды.
Ацетилен: применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.

Баллоны с этим газом маркируют следующим образом: окрашивают в белый цвет и большими красными буквами наносят надпись: «Ацетилен»
Строительные работы проводятся в основном на открытом воздухе. Применение ацетилена и его гомологов в этих условиях не должно проходить под воздействием прямых солнечных лучей. Небольшие перерывы должны сопровождаться перекрыванием вентилей на горелке, а длительные – перекрыванием вентилей на самих баллонах.
В химической промышленности очень востребован ацетилен. Применение его заключается в использовании данного вещества в процессе получения продуктов органического синтеза. Это синтетический каучук, пластмассы, растворители, уксусная кислота и т.д.
Ацетилен, являясь универсальным горючим, часто используется в процессах, сопровождающихся газопламенной обработкой. Важно, что применение ацетилена в промышленности возможно только при соблюдении мер безопасности, так как он является взрывоопасным газом.
Карбидные лампы
Название «карбидная лампа» обусловлено использованием в качестве источника света открытого пламени струи сжигаемого ацетилена. Он, соответственно, получен в результате взаимодействия карбида кальция с водой.
Такие лампы были широко распространены в прошлом. Их можно было увидеть на каретах, автомобилях и даже велосипедах. В современное время карбидные лампы используют только в случае острой необходимости в мощном автономном светильнике. Так, спелеологи часто пользуются ими. Отдаленные маяки снабжают именно такими лампами, ведь такой тип освещения намного выгоднее, нежели подведение линий электропередач. Достаточно распространенным является использование таких ламп на судах дальнего плавания.
Ацетилен: применение в медицине
Как используется вещество в этой сфере? Общая анестезия предполагает применение алкинов. Ацетилен является одним из тех газов, которые используются при ингаляционном наркозе. Но повсеместное его применение в этом качестве осталось в прошлом. Сейчас появились более современные и безопасные способы анестезии.
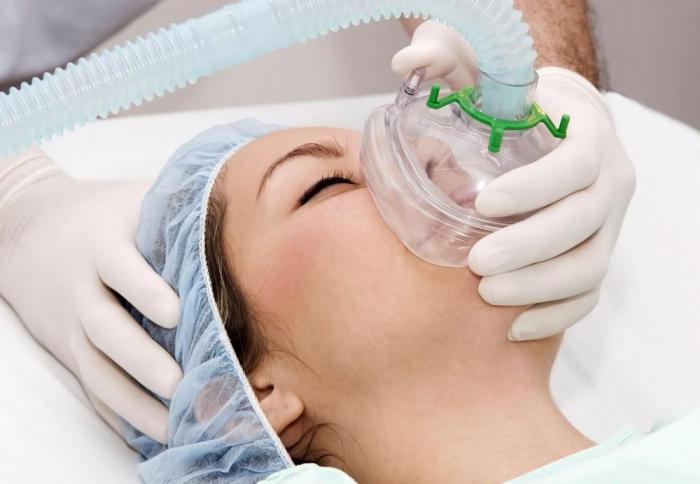
Хотя следует отметить, что и применение ацетилена не представляло большой опасности, так как прежде чем значение его концентрации во вдыхаемом воздухе дойдет до опасного предела, нижний порог горючести будет пройден.
Самым главным условием использования данного газа является соблюдение мер безопасности. Сложно переоценить, насколько опасен ацетилен. Применение его возможно только после проведения всех необходимых инструктажей с работниками различных сфер, в которых он используется.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
Query failed: connection to localhost:9312 failed (errno=111, msg=Connection refused).
monateka.com
Применение ацетилена. Сварка ацетиленом
Чтобы понять, где применяется ацетилен, необходимо изучить и понять, что же это такое. Данное вещество представляет собой горючий бесцветный газ. Его химическая формула – С2Н2. Газ обладает атомной массой, равной 26,04. Он немного легче воздуха и обладает резким запахом. Получение и применение ацетилена осуществляется лишь в промышленных условиях. Получают данное вещество из карбида кальция путем разложения компонента в воде.
Чем опасен ацетилен
Применение ацетилена ограничено его необычайными свойствами. Этот газ самовоспламеняется. Происходит это при температуре 335°С, а его смесь с кислородом – при температуре от 297 до 306°С, с воздухом – при температуре от 305 до 470°С.
Стоит отметить, что ацетилен технический взрывоопасен. Это было происходит при:
- Повышении температуры до 450-500°С, а также при давлении в 150-200 кПа, что равно 1,5-2 атмосферам.
- Смесь ацетилена и кислорода при атмосферном давлении также опасна, если ацетилена в ней содержится 2,3-93%. Взрыв может произойти от сильного нагрева, открытого пламени и даже от искры.
- При подобных же условиях происходит взрыв смеси воздуха с ацетиленом, если в ней содержится 2,2-80,7 % ацетилена.
- Если газ долго соприкасается с медным или серебряным предметом, то может образоваться ацетиленистое взрывчатое серебро или же медь. Это вещество очень опасно. Взрыв может произойти от сильного удара или же в результате повышения температуры. Работать с газом следует осторожно.
Особенности вещества
Ацетилен, свойства и применение которого до конца не изучены, в результате взрыва может привести к несчастному случаю и сильнейшим разрушениям. Вот некоторые данные. При взрыве одного килограмма данного вещества выделяется в 2 раз больше тепловой энергии, чем при взрыве такого же количества тротила, а также в полтора раза больше, чем при взрыве одного килограмма нитроглицерина.
Видео по теме
Области применения ацетилена
Ацетилен – это горючий газ, который используется при газовой сварке. Нередко его используют для кислородной резки. Стоит отметить, что температура горения смеси кислорода и ацетилена может достигать 3300°С. Благодаря этому свойству вещество чаще других используется при сварке. Ацетиленом обычно заменяют природный газ и пропан-бутан. Вещество обеспечивает производительность и высокое качество сварки.
Снабжение постов газом для резки и сварки может осуществляться от ацетиленового генератора или же от баллонов с ацетиленом. Для хранения данного вещества обычно используют емкости белого цвета. Как правило, на них присутствует надпись «Ацетилен», нанесенная красной краской. Стоит учесть, что существует ГОСТ 5457-75. Согласно данному документу для обработки металлов применяется технический растворенный ацетилен марки Б или же вещество в газообразном виде.
Сварка ацетиленом: проверка
Технология сварки данным газом достаточно проста. Однако при работе с веществом требуется терпение и внимательность. Для сварки обычно используют специальные горелки, с маркировкой 0-5. Ее выбор зависит от того, какой толщиной обладают свариваемые детали. Следует учесть, что чем больше размер горелки, тем больше расход.
Сварка ацетиленом осуществляется только после того, как оборудование будет проверено и отрегулировано. При этом следует обратить внимание на номер наконечника и номер подающей газ форсунки, которая располагается около рукоятки горелки под гайкой. Также следует проверить все уплотнения.
Процесс сварки
Применение ацетилена при сварке должно осуществляться аккуратно и в соответствии с определенными правилами. Для начала горелку следует продуть газом. Это нужно делать до тех пор, пока не появится запах ацетилена. После этого газ поджигается. При этом следует добавлять кислород, пока пламя не станет более устойчивым. Из редуктора на выходе давление ацетилена должно быть от 2 до 4 атмосфер, а кислорода – от 2 атмосфер.
Для сварки черных металлов требуется нейтральное пламя. Оно обладает четко очерченной короной и условно его можно разделить на три яркие части: ядро – ярко-голубой окрас с зеленоватым отливом, восстановленное пламя – бледно-голубого оттенка, факел пламени. Последние две зоны являются рабочими.
Перед началом работы все детали нужно очистить, а затем подогнать друг к другу. При работе с горелкой также применяют левый и правый способ. В последнем случае происходит медленное остывание шва. Присадочный материал, как правило, перемещается за горелкой. При левом способе повышается эластичность и прочность шва. В данном случае пламя направляется от места сварки. Присадочный материал следует вносить в сварочную ванну только после того, как переместится на следующую позицию горелка.
Правила безопасности
Применение ацетилена без навыков и опыта запрещено. Существует несколько правил, которые следует соблюдать при работе с веществом:
- Содержание ацетилена в помещении в воздухе необходимо постоянно контролировать. Для этого следует использовать специальные автоматические приборы, которые способны оповещать о превышении концентрации газа. Этот показатель не должен быть более 0,46 %.
- Области применения ацетилена совершенно разные, но чаще всего его используют при сварке. При работе с баллонами, наполненными именно этим газом, следует соблюдать осторожность. Запрещено размещать емкости вблизи открытого огня или же около отопительных систем. Помимо этого, запрещено работать с баллонами, которые находятся в горизонтальном положении, а также, если они не закреплены и неисправны.
- При работе с ацетиленом следует использовать исключительно неискрящиеся инструменты, электрическое оборудование и освещение во взрывобезопасном исполнении.
- Если происходит утечка ацетилена из баллона, то следует быстро закрыть вентиль емкости. Для этого можно использовать неискрящийся специальный ключ. Определить утечку можно лишь по звуку или же запаху.

Что делать, если возник пожар
Неправильное применение ацетилена может привести к печальным последствиям. Этот газ взрывается и приносит сильное разрушение. Что же делать, если возник пожар?
- При возникновении пожара следует незамедлительно убрать из опасной зоны все емкости, наполненные ацетиленом. Те баллоны, которые остались, следует постоянно охлаждать обычной водой или же специальным составом. Емкости должны полностью остыть.
- Если воспламенился газ, который выходит из баллона, то следует незамедлительно закрыть емкость. Для этого следует использовать неискрящийся ключ. После этого емкость необходимо остудить.
- При сильном возгорании тушение огня следует осуществлять только с безопасного расстояния. В такой ситуации стоит использовать огнетушители, наполненные составом, содержащим флегматизирующую концентрацию азота 70 % по объему, также диоксид углерода 75 % по объему, песок, струи воды, сжатый азот, полотно асбестовое и так далее.
Комментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
Query failed: connection to localhost:9312 failed (errno=111, msg=Connection refused).
monateka.com
Ацетилен
Ацетилен
СОДЕРЖАНИЕ
ИСТОРИЯ ОТКРЫТИЯ
НАЗВАНИЕ АЦЕТИЛЕНА ПО НОМЕНКЛАТУРЕ ИЮПАК
ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ
СТРУКТУРНАЯ ФОРМУЛА АЦЕТИЛЕНА
ХАРАКТЕРИСТИКА КЛАССА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ АЦЕТИЛЕНА
РЕАКЦИИ ПОЛУЧЕНИЯ АЦЕТИЛЕНА
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ АЦЕТИЛЕНА
ОБЛАСТИ ПРИМЕНЕНИЯ АЦЕТИЛЕНА
ВОЗДЕЙСТВИЕ АЦЕТИЛЕНА НА ЧЕЛОВЕЧЕСКИЙ ОРГАНИЗМ И ОКРУЖАЮЩУЮ СРЕДУ
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
ИСТОРИЯ ОТКРЫТИЯ
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На латыни acetum - уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 - Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени - от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина Ash4.
НАЗВАНИЕ АЦЕТИЛЕНА ПО НОМЕНКЛАТУРЕ ИЮПАК
Согласно номенклатуре ИЮПАК при построении названий алкинов в названиях соответствующих насыщенных углеводородов суффикс -ан заменяется суффиксом -ин. Для указания положения тройной связи и замещающих групп цепь нумеруют также, как в соответствующих алкенах. Этин также возможно именовать тривиально - ацетилен.
ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ
При нормальных условиях - бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения ?83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2h3 обнаружен на Уране и Нептуне.
СТРУКТУРНАЯ ФОРМУЛА АЦЕТИЛЕНА
Рис. 1
ХАРАКТЕРИСТИКА КЛАССА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ АЦЕТИЛЕНА
Ацетилен принадлежит к классу алкинов.
Алки?ны (иначе ацетиленовые углеводороды) - углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой Cnh3n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) - газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше - в органических растворителях.
ацетилен реакция соединение формула
РЕАКЦИИ ПОЛУЧЕНИЯ АЦЕТИЛЕНА
В лаборатории ацетилен получают действием воды на карбид кальция
+ 2 Н2О = С2Н2? + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
СН4 = С2Н2? +3Н2?
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ АЦЕТИЛЕНА
Основные химические реакции ацетилена (реакции присоединения):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации).
ОБЛАСТИ ПРИМЕНЕНИЯ АЦЕТИЛЕНА
Ацетилен используют:
для сварки и резки металлов,
как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
в производстве взрывчатых веществ (см. ацетилениды),
для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов,
для получения технического углерода,
в атомно-абсорбционной спектрофотометрии при пламенной атомизации,
в ракетных двигателях (вместе с аммиаком).
ВОЗДЕЙСТВИЕ АЦИТЕЛЕНА НА ЧЕЛОВЕЧЕСКИЙ ОРГАНИЗМ И ОКРУЖАЮЩУЮ СРЕДУ
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1.Ньюленд Ю., Фогт Р., Химия ацетилена, Иниздат, 1947.
.Федоренко Н.П., Методы и экономика получения ацетилена, Химическая наука и промышленность, 3, т. 1, 1956.
.Федоренко Н.П. Химия и химическая технология, № 3, т. I, 1956.
Теги: Ацетилен Контрольная работа ХимияПросмотров: 11879Найти в Wikkipedia статьи с фразой: Ацетиленdiplomba.ru