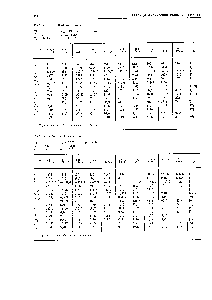
Таблица. Степени окисления химических элементов. Степень окисления аргона
Таблица степеней окисления химических элементов. Возможные степени окисления химических элементов. Стандартные, редкие, исключения
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
www.dpva.ru
|
Порядковый номер |
Русское / англ. название |
Химический символ |
Степень окисления |
|
1 |
Водород / Hydrogen |
H |
(+1), (-1) |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
(+1) |
|
4 |
Бериллий / Beryllium |
Be |
(+2) |
|
5 |
Бор / Boron |
B |
(-1), 0, (+1), (+2), (+3) |
|
6 |
Углерод / Carbon |
C |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
|
7 |
Азот / Nitrogen |
N |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
|
8 |
Кислород / Oxygen |
O |
(-2), (-1), 0, (+1), (+2) |
|
9 |
Фтор / Fluorine |
F |
(-1) |
|
10 |
Неон / Neon |
Ne |
0 |
|
11 |
Натрий / Sodium |
Na |
(+1) |
|
12 |
Магний / Magnesium |
Mg |
(+2) |
|
13 |
Алюминий / Aluminum |
Al |
(+3) |
|
14 |
Кремний / Silicon |
Si |
(-4), 0, (+2), (+4) |
|
15 |
Фосфор / Phosphorus |
P |
(-3), 0, (+3), (+5) |
|
16 |
Сера / Sulfur |
S |
(-2), 0, (+4), (+6) |
|
17 |
Хлор / Chlorine |
Cl |
(-1), 0, (+1), (+3), (+5), (+7), редко (+2) и (+4) |
|
18 |
Аргон / Argon |
Ar |
0 |
|
19 |
Калий / Potassium |
K |
(+1) |
|
20 |
Кальций / Calcium |
Ca |
(+2) |
|
21 |
Скандий / Scandium |
Sc |
(+3) |
|
22 |
Титан / Titanium |
Ti |
(+2), (+3), (+4) |
|
23 |
Ванадий / Vanadium |
V |
(+2), (+3), (+4), (+5) |
|
24 |
Хром / Chromium |
Cr |
(+2), (+3), (+6) |
|
25 |
Марганец / Manganese |
Mn |
(+2), (+3), (+4), (+6), (+7) |
|
26 |
Железо / Iron |
Fe |
(+2), (+3), редко (+4) и (+6) |
|
27 |
Кобальт / Cobalt |
Co |
(+2), (+3), редко (+4) |
|
28 |
Никель / Nickel |
Ni |
(+2), редко (+1), (+3) и (+4) |
|
29 |
Медь / Copper |
Cu |
+1, +2, редко (+3) |
|
30 |
Цинк / Zinc |
Zn |
(+2) |
|
31 |
Галлий / Gallium |
Ga |
(+3), редко (+2) |
|
32 |
Германий / Germanium |
Ge |
(-4), (+2), (+4) |
|
33 |
Мышьяк / Arsenic |
As |
(-3), (+3), (+5), редко (+2) |
|
34 |
Селен / Selenium |
Se |
(-2), (+4), (+6), редко (+2) |
|
35 |
Бром / Bromine |
Br |
(-1), (+1), (+5), редко (+3), (+4) |
|
36 |
Криптон / Krypton |
Kr |
0 |
|
37 |
Рубидий / Rubidium |
Rb |
(+1) |
|
38 |
Стронций / Strontium |
Sr |
(+2) |
|
39 |
Иттрий / Yttrium |
Y |
(+3) |
|
40 |
Цирконий / Zirconium |
Zr |
(+4), редко (+2) и (+3) |
|
41 |
Ниобий / Niobium |
Nb |
(+3), (+5), редко (+2) и (+4) |
|
42 |
Молибден / Molybdenum |
Mo |
(+3), (+6), редко (+2), (+3) и (+5) |
|
43 |
Технеций / Technetium |
Tc |
(+6) |
|
44 |
Рутений / Ruthenium |
Ru |
(+3), (+4), (+8), редко (+2), (+6) и (+7) |
|
45 |
Родий / Rhodium |
Rh |
(+4), редко (+2), (+3) и (+6) |
|
46 |
Палладий / Palladium |
Pd |
(+2), (+4), редко (+6) |
|
47 |
Серебро / Silver |
Ag |
(+1), редко (+2) и (+3) |
|
48 |
Кадмий / Cadmium |
Cd |
(+2), редко (+1) |
|
49 |
Индий / Indium |
In |
(+3), редко (+1) и (+2) |
|
50 |
Олово / Tin |
Sn |
(+2), (+4) |
|
51 |
Сурьма / Antimony |
Sb |
(-3), (+3), (+5), редко (+4) |
|
52 |
Теллур / Tellurium |
Te |
(-2), (+4), (+6), редко (+2) |
|
53 |
Иод / Iodine |
I |
(-1), (+1), (+5), (+7), редко (+3), (+4) |
|
54 |
Ксенон / Xenon |
Xe |
0 |
|
55 |
Цезий / Cesium |
Cs |
(+1) |
|
56 |
Барий / Barium |
BA |
(+2) |
|
57 |
Лантан / Lanthanum |
La |
(+3) |
|
58 |
Церий / Cerium |
Ce |
(+3), (+4) |
|
59 |
Празеодим / Praseodymium |
Pr |
(+3) |
|
60 |
Неодим / Neodymium |
Nd |
(+3), (+4) |
|
61 |
Прометий / Promethium |
Pm |
(+3) |
|
62 |
Самарий / Samarium |
Sm |
(+3), редко (+2) |
|
63 |
Европий / Europium |
Eu |
(+3), редко (+2) |
|
64 |
Гадолиний / Gadolinium |
Gd |
(+3) |
|
65 |
Тербий / Terbium |
Tb |
(+3), (+4) |
|
66 |
Диспрозий / Dysprosium |
Dy |
(+3) |
|
67 |
Гольмий / Holmium |
Ho |
(+3) |
|
68 |
Эрбий / Erbium |
Er |
(+3) |
|
69 |
Тулий / Thulium |
Tm |
(+3), редко (+2) |
|
70 |
Иттербий / Ytterbium |
Ib |
(+3), редко (+2) |
|
71 |
Лютеций / Lutetium |
Lu |
(+3) |
|
72 |
Гафний / Hafnium |
Hf |
(+4) |
|
73 |
Тантал / Tantalum |
Ta |
(+5), редко (+3), (+4) |
|
74 |
Вольфрам / Tungsten |
W |
(+6), редко (+2), (+3), (+4) и (+5) |
|
75 |
Рений / Rhenium |
Re |
(+2), (+4), (+6), (+7), редко (-1), (+1), (+3), (+5) |
|
76 |
Осмий / Osmium |
Os |
(+3), (+4), (+6), (+8), редко (+2) |
|
77 |
Иридий / Iridium |
Ir |
(+3), (+4), (+6), редко (+1) и (+2) |
|
78 |
Платина / Platinum |
Pt |
(+2), (+4), (+6), редко (+1) и (+3) |
|
79 |
Золото / Gold |
Au |
(+1), (+3), редко (+2) |
|
80 |
Ртуть / Mercury |
Hg |
(+1), (+2) |
|
81 |
Талий / Thallium |
Tl |
(+1), (+3), редко (+2) |
|
82 |
Свинец / Lead |
Pb |
(+2), (+4) |
|
83 |
Висмут / Bismuth |
Bi |
(+3), редко (+3), (+2), (+4) и (+5) |
|
84 |
Полоний / Polonium |
Po |
(+2), (+4), редко (-2) и (+6) |
|
85 |
Астат / Astatine |
At |
— |
|
86 |
Радон / Radon |
Ra |
0 |
|
87 |
Франций / Francium |
Fr |
— |
|
88 |
Радий / Radium |
Ra |
(+2) |
|
89 |
Актиний / Actinium |
Ac |
(+3) |
|
90 |
Торий / Thorium |
Th |
(+4) |
|
91 |
Проактиний / Protactinium |
Pa |
(+5) |
|
92 |
Уран / Uranium |
U |
(+3), (+4), (+6), редко (+2) и (+5) |
ru.solverbook.com
|
Степени окисления химических элементов |
|||
|
(В скобках нехарактерные степени окисления) |
|||
| Порядковый номер химического элемента | Название химического элемента | Химический символ | Степени окисления |
| 1 | Водород | H | (-1), +1 |
| 2 | Гелий | He | 0 |
| 3 | Литий | Li | 1 |
| 4 | Бериллий | Be | 2 |
| 5 | Бор | B | 0 |
| 6 | Углерод | C | (+2), +4 |
| 7 | Азот | N | -3, -2, -1, (+1), +2, +3, +4, +5 |
| 8 | Кислород | O | -2 |
| 9 | Фтор | F | -1, (+1) |
| 10 | Неон | Ne | 0 |
| 11 | Натрий | Na | 1 |
| 12 | Магний | Mg | 2 |
| 13 | Алюминий | Al | 3 |
| 14 | Кремний | Si | -4, (+2), +4 |
| 15 | Фосфор | P | 6 |
| 16 | Сера | S | 10 |
| 17 | Хлор | Cl | -1, +1, (+2), +3, (+4), +5, +7 |
| 18 | Аргон | Ar | 0 |
| 19 | Калий | K | 1 |
| 20 | Кальций | Ca | 2 |
| 21 | Скандий | Sc | 3 |
| 22 | Титан | Ti | 9 |
| 23 | Ванадий | V | 14 |
| 24 | Хром | Cr | 11 |
| 25 | Марганец | Mn | +2, (+3), +4, (+6), +7 |
| 26 | Железо | Fe | +2, +3, (+4), (+6) |
| 27 | Кобальт | Co | +2, +3, (+4) |
| 28 | Никель | Ni | (+1), +2, (+3), (+4) |
| 29 | Медь | Сu | +1, +2, (+3) |
| 30 | Цинк | Zn | 2 |
| 31 | Галлий | Ga | (+2). +3 |
| 32 | Германий | Ge | 2 |
| 33 | Мышьяк | As | -3, (+2), +3, +5 |
| 34 | Селен | Se | -2, (+2), +4, +6 |
| 35 | Бром | Br | -1, +1, (+3), (+4), +5 |
| 36 | Криптон | Kr | 0 |
| 37 | Рубидий | Rb | 1 |
| 38 | Стронций | Sr | 2 |
| 39 | Иттрий | Y | 3 |
| 40 | Цирконий | Zr | (+2), (+3), +4 |
| 41 | Ниобий | Nb | (+2), +3, (+4), +5 |
| 42 | Молибден | Mo | (+2), +3, (+4), (+5), +6 |
| 43 | Технеций | Tc | 6 |
| 44 | Рутений | Ru | (+2), +3, +4, (+6), (+7), +8 |
| 45 | Родий | Rh | (+2), (+3), +4, (+6) |
| 46 | Палладий | Pd | +2, +4, (+6) |
| 47 | Серебро | Ag | +1, (+2), (+3) |
| 48 | Кадмий | Cd | (+1), +2 |
| 49 | Индий | In | (+1), (+2), +3 |
| 50 | Олово | Sn | 6 |
| 51 | Сурьма | Sb | -3, +3, (+4), +5 |
| 52 | Теллур | Te | -2, (+2), +4, +6 |
| 53 | Иод | I | -1, +1, (+3), (+4), +5, +7 |
| 54 | Ксенон | Xe | 0 |
| 55 | Цезий | Cs | 1 |
| 56 | Барий | Ba | 2 |
| 57 | Лантан | La | 3 |
| 58 | Церий | Ce | 7 |
| 59 | Празеодим | Pr | 3 |
| 60 | Неодим | Nd | 7 |
| 61 | Прометий | Pm | 3 |
| 62 | Самарий | Sm | (+2), +3 |
| 63 | Европий | Eu | (+2), +3 |
| 64 | Гадолиний | Gd | 3 |
| 65 | Тербий | Tb | 7 |
| 66 | Диспрозий | Dy | 3 |
| 67 | Гольмий | Ho | 3 |
| 68 | Эрбий | Er | 3 |
| 69 | Тулий | Tm | (+2), +3 |
| 70 | Иттербий | Yb | (+2), +3 |
| 71 | Лютеций | Lu | 3 |
| 72 | Гафний | Hf | 4 |
| 73 | Тантал | Ta | (+3), (+4), +5 |
| 74 | Вольфрам | W | (+2), (+3), (+4), (+5), +6 |
| 75 | Рений | Re | (-1), (+1), +2, (+3), +4, (+5), +6, +7 |
| 76 | Осмий | Os | (+2), +3, +4, +6, +8 |
| 77 | Иридий | Ir | (+1), (+2), +3, +4, +6 |
| 78 | Платина | Pt | (+1), +2, (+3), +4, +6 |
| 79 | Золото | Au | +1, (+2), +3 |
| 80 | Ртуть | Hg | 3 |
| 81 | Талий | Tl | +1, (+2), +3 |
| 82 | Свинец | Pb | 6 |
| 83 | Висмут | Bi | (-3), (+2), +3, (+4), (+5) |
| 84 | Полоний | Po | (-2), +2, +4, (+6) |
| 85 | Астат | At | нет данных |
| 86 | Радон | Rn | 0 |
| 87 | Франций | Fr | нет данных |
| 88 | Радий | Ra | 2 |
| 89 | Актиний | Ac | 3 |
| 90 | Торий | Th | 4 |
| 91 | Проактиний | Pa | 5 |
| 92 | Уран | U | (+2), +3, +4, (+5), +6 |
www.funtable.ru
| Таблица. Степени окисления химических элементов.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
tehtab.ru
Аргон степень - Справочник химика 21
В первых экспериментальных исследованиях [52—55] восстановление трикальцийфосфата до элементарного фосфора проводилось в реакторе с псевдоожиженным плазмой слоем. Трикальций-фосфат подавали в плазму в смеси с двуокисью кремния и углеродом, а конечными продуктами процесса являлись элементарный фосфор, силикат кальция и окись углерода. Температура псевдо-ожиженного слоя была 1300—1480 К. В качестве транспортирую-ш его газа использовался аргон. Степень восстановления фосфора определялась по выходу окиси углерода и достигала 100%. Побочный продукт процесса — карбид кальция, что подтверждают результаты термодинамических расчетов. В результате экспериментов также установлено, что энергетический кпд реактора повышается с увеличением подачи исходного сырья. [c.187]
Исключение составляют фтор, кислород, гелий, неон, аргон, а также железо и элементы подгрупп кобальта и никеля, высшая степень окисления которых ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе. [c.83]
Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений равна —2. Кроме того, кислород проявляет степени окисления +2 и +4, а также +1 и —1 в соединениях со связью О—О. [c.309]
Для оценки степени чувствительности энтропии растворения к структуре укажем, что для растворения аргона в воде А сольв = —22 э. е., а эффект ограничения неупорядоченности вследствие уменьшения объема в результате растворения газа в жидкости составляет 12 э. е. Следовательно, разница между этими величинами (—10 9. е.) приходится на упорядочение структуры растворителя. [c.136]
Отвлекаясь от вопроса о степени ионности связи и считая принадлежащими данному отрицательному иону все электроны, участвующие в образовании связи его с положительными ионами, можно представить схематически структуры электронных оболочек атома аргона, положительных ионов калия и кальция и отрицательных ионов хлора и серы (рис. 11). Сопоставление этих структур наглядно показывает аналогию л ежду ними. Все они содержат одинаковое число (18) электронов, которые одинаковым образом распределены в первой, второй и третьей оболочках К, L п М (2, 8 и 8 электронов) эти атомы и ионы в основном различаются по заряду ядра. Различие это приводит к тому, что при переходе от [c.60]
Видно существенное различие между значениями предельных объемов адсорбционного пространства для различных газов. Вывод здесь, по нашему мнению, может быть только один изменяется не объем адсорбционного пространства, а плотность адсорбированной фазы. Если считать истинное значение предельного объема адсорбционного пространства по бензолу — = 0,40 см /г постоянным для всех адсорбируемых газов, то можно отметить, что степень заполнения адсорбционного пространства зависит от размера молекул, свойств криогенных газов и температуры опыта. Например, азот и аргон адсорбируются при температуре, близкой к их точке кипения, и плотность адсорбата (в расчете на 1 о = 0,40 см г) почти в полтора раза выше плотности нормальной жидкости при этой же температуре. По-видимому, в силу малости линейных размеров молекул это свойство должно наблюдаться у всех исследуемых газов при температурах, близких к температуре кипения. Низкое значение Ц7о для гелия и неона объясняется высокой температурой адсорбции, значительно превышающей критическую для указанных газов. [c.27]
Так как водород сильно снижает скорость образования пироуглерода, данные, полученные при применении аргона, несколько искажаются наложением влияния выделяющегося водорода на кинетику образования пироуглерода на влияние на нее строения исходного углеводорода. При разбавлении водородом это искажение устраняется. Для всех приведенных в табл. 2.2 углеводородов кроме бензола и, в меньшей степени, этилена различия в скоростях образования пироуглерода при применении в качестве разбавителя водорода очень малы. Скорость выделения пироуглерода при замене аргона на водород уменьшается в 10—200 раз для различных углеводородов. Необходимо учитывать, что при использовании в качестве разбавителя аргона водород в реакционной зоне вследствие разложения углеводородов присутствует, и действительное торможение водородом еще сильнее, чем следует из данных табл. 2.2. [c.89]
Окисление СО в нестационарном режиме на нанесенном платиновом катализаторе изучалось также в работе [21]. На вход без-градиентного изотермического реактора подавали реакционную смесь, состав которой периодически изменялся — в течение первой половины периода подавали смесь оксида углерода с аргоном, в течение второй — смесь кислорода с аргоном. Процесс проводили при температуре 60°С, концентрации СО — О—2%, Оа — О—3%. Максимальная длительность цикла 3 мин. Оказалось, что при нестационарном способе ведения процесса может быть достигнуто 20-кратное увеличение скорости реакции по сравнению со стационарными условиями. Максимальный выигрыш имел место при длительности цикла 1 мин. Результаты экспериментов объясняются так. Предполагая, что образование СОа определяется главным образом скоростью взаимодействия адсорбированных СО и Оа, можно сделать вывод, что эта скорость максимальна в случае примерного равенства концентраций поверхностных форм [ OZ] и [0Z]. Тогда значительное увеличение наблюдаемой скорости образования СОа в нестационарном режиме можно объяснить тем, что в этом случае поверхностные покрытия сохраняли свои значения вблизи этих оптимальных величин. В то же время при стационарном способе ведения процесса степени покрытия [ OZ] и [0Z], как показывают независимые стационарные эксперименты, значительно отличаются по величине, и их произведение мало. [c.37]
При рассмотрении изобарных диаграмм состояния сплавов можно вообще не рассматривать газовую фазу, так как постоянное давление поддерживается при помощи инертного газа (например, аргона), в то время как давлением пара металла в большинстве случаев можно пренебречь. Учет газовой фазы не изменял бы поэтому числа термодинамических степеней свободы. [c.156]
Расход пара — а кг/кг сырья концентрация кислорода в техническом кислороде Со, м /м , а концентрация азота в сумме с аргоном и другими благородными газами в техническом кислороде тогда составит 1 — Со,- Объем кислорода в м , израсходованного на сжигание водорода. — б, а степень паровой конверсии СО с образованием Н, и СО, — . [c.102]
Большой интерес представляет вопрос, при каких значениях прицельного параметра наблюдается наибольшая передача энергии из поступательных во внутренние степени свободы молекулы На рис. 4.25 представлены гистограммы величин средних квадратов изменения внутренней и колебательной энергии молекул метана при столкновениях с атомом аргона. Видно, что наибольший вклад в передачу энергии дают столкновения с прицельным параметром Ь = 2 2 к. [c.109]
Получаемые азот и кислород содержат некоторое количество аргона и других редких газов, которые находятся в исходном воздухе. Для повышения степени чистоты конечных продуктов разделения приходится удалять часть паров с той тарелки колонны 1, на которой в наибольшем количестве накапливается аргон. Дальнейшее разделение редких газов происходит путем низкотемпературной ректификации в отдельных колонных аппаратах. [c.519]
Точная форма кривой в значительной степени зависит от природы иона. Для молекулярных и осколочных ионов, образующихся при простом механизме ионизации, начальный участок кривой меньше и угол линейного участка больше, чем для ионов, образующихся по сравнительно сложному механизму. Если сравнивать ионы одного типа, то различия в форме их ионизационных кривых невелики. Так ионизационные кривые для молекулярных ионов криптона, аргона, двуокиси углерода, метана, ацетилена, этилена, водорода и воды обычно располагаются параллельно, особенно в области низких энергий [130], если в масс-спектрометр они вводятся [c.175]
Имеются основания предполагать, что адсорбция на активированном или графитизированном угле, а также на графите должна происходить главным образом на базисных плоскостях. Поэтому поверхность этих веществ должна, по-видимому, иметь-довольно однородный характер. Это подтверждается полученными значениями теплот адсорбции физически адсорбированных молекул. Так, теплоты адсорбции многих газов, включая аргон, азот, кислород и ряд углеводородов, имеют практически постоянные значения [39б-е]. В некоторых случаях теплота адсорбции слегка уменьшается с увеличением степени заполнения. Гольдман и Поляни [39е, 175], в частности, указывают,, что теплоты адсорбции хлористого этила на угле при увеличении 0 от 0,09 до 0,60 падают с 12,5 до 9,5 ккал/моль. Теплоты десорбции н-пентана [39г], сероуглерода 39д] и диэтилового эфира [39е] на том же угле обнаруживают подобную же зависимость от степени заполнения. Следовательно, можно сделать вывод, что в аналогичных случаях уменьшение теплоты адсорбции вызывается неоднородностью поверхности. [c.111]
Вымывание адсорбированных газов занимает 15 мин и идет в такой последовательности водород, азот, метан, окись углерода. В конце столбика находится ионизационный детектор со слабым источником радия Д, который ионизирует часть газа-носителя (аргона). Возникающий ионизационный ток подается на усилитель и далее на самописец. Примесь газов, выделенных из металла, изменяет степень ионизации аргона, в результате чего на самописце наблюдается ряд пиков. Результаты записи анализа одной пробы показаны на рис. 11. При строго постоянных условиях вымывания адсорбированных газов аргоном высота пиков пропорциональна содержанию отдельных компонентов. На основании анализа образцов металла с известным содержанием газов (или соответствующих искусственных смесей) можно установить соотношение между высотой пика и процентным содержанием газа в металле. [c.70]
Получение и очистка газов. Большинство измерений в электрохимии проводят в отсутствие кислорода воздуха, который является электрохимически активным. В связи с этим исследования выполняют в атмосфере инертных газов азота, аргона, гелия. В ряде систем возможно использование водорода, который, однако, может проявлять электрохимическую активность на некоторых электродах при анодных потенциалах, Эти газы выпускаются промышленностью разной степени очистки. Если содержание кислорода в газах не превышает 0,005 %. то для большинства исследований нет необходимости в дополнительной очистке газов от следов кислорода и их очищают лишь от органических примесей пропусканием через трубки, заполненные активированным углем. При большом содержании кислорода в газах возникает необходимость его удаления. [c.31]
Если теперь рассмотреть элементы от натрия до аргона, то нетрудно заметить, что они в значительной степени повторяют свойства элементов от лития до неона. Причем повторение проявляется в определенной последовательности натрий повторяет свойства лития, магний — бериллия, алюминий—бора, кремний — углерода, фосфор — азота, сера — кислорода, хлор —фтора, аргон —неона, т. е. каждый восьмой элемент повторяет свойства первого. Следующий за аргоном калий повторяет свойства натрия и лития, кальций—магния и бериллия и т. д., иначе говоря, свойства элементов периодической системы повторяются. [c.56]
Для синтеза используют чистые вещества, так как все П римеси из исходных веществ переходят в карбиды. Наиболее пригодны металлы, полученные восстановлением оксидов водородом. Скорость реакции определяется главным об разом степенью измельчения исходных веществ, так как взаимодействие идет за счет взаимной диффузии веществ, главным образом углерода. Металлы и неметаллы должны быть в виде тонких порошков. Хрупкие металлы можно измельчить в ступке из закаленной стали. Мягкие или вязкие металлы, не измельченные в ступке (литий, кальций и т. д.), следует нарезать мелкими кусочками (не более 1—0,5 мм). Чтобы предупредить окисление металлов, эту операцию лучше Проводить в бензоле, керосине и т. д. или в инертной сухой атмосфере в специальном боксе. Инертным газом может быть азот, аргон, оксид углерода (IV). [c.52]
Уголь и металл отвешивают на аналитических весах в соответствии с формулой получаемого карбида, 4—5 г смеси тщательно перемешивают и прессуют в таблетки под давлением не менее 15-10 Па. Спрессованную смесь помещают в фарфоровую или кварцевую трубку и прокаливают в атмосфере аргона, азота или в вакууме. Газ необходимо тщательно очистить от следов кислорода. Лучше всего для этой цели его пропустить через раскаленную трубку, наполненную магниевыми, кальциевыми или железными стружками, или через промывалку с расплавленным натрием. Синтез проводят в установке, схема которой показана иа рисунке 1. Лодочку со спрессованными таблетками помещают в трубку. Время прокаливания зависит от степени измельчения металла, его природы и температуры. Если используют металл в виде тончайшего порошка, реакция при соответствующей температуре заканчивается за 2—3 ч. Для гомогенизации продукт следует (после охлаждения в токе инертного газа) измельчить в ступке, немного смочить спиртом или глицерином, спрессовать и снова прокалить. При отсутствии пресса исходную смесь можно прокалить, утрамбовав ее в фарфоровой или кварцевой лодочке. В этом случае процесс образования карбидов замедляется вследствие ухудшения контакта между частичками исходных веществ. [c.53]
Газовая хроматография. Эта хроматография представляет собой один из вариантов распределительной хроматографии. Одной из ее разновидностей является газожидкостная хроматография. Неподвижной фазой служит нелетучая жидкость (глицерин, поли-этиленгликоль, ланолин и др.), которой пропитывают твердый порошкообразный адсорбент (активированный уголь, целит, специальный огнеупорный кирпич и т. п.) до такой степени, чтобы он оставался на ощупь сухим и легко продувался газом. Таким адсорбентом, содержащим неподвижную жидкую фазу, равномерно заполняют колонку — стеклянную или медную трубку диаметром примерно 0,5 см и длиной до 20 м. Роль подвилвещество также в виде газа или пара. Полученная смесь газов подается в колонку под определенным давлением и при низкой температуре. Разделение смесей на компоненты происходит в общем так же, как и в случае адсорбционной хроматографии в колонке при выделении растворенных веществ. [c.173]
Притяжение атомов сжиженных инертных газов целиком определяется слабыми силами, а именно силами Ван-дер-Ваальса, которые уменьшаются обратно пропорционально седьмой степени расстояния между молекулами. Для сравнения укажем, что силы притяжения между ионами убывают более медленно обратно пропорционально квадрату расстояния между ними. Именно слабым взаимодействием атомов объясняется то, что при атмосферном давлении неон, аргон, криптон и ксенон находятся в жидком состоянии при очень низкой температуре. Температурный интервал существования жидкой фазы этих элементов не превышает 4°С (табл. 13). [c.156]
Говоря о различных путях исследования структуры жидкостей, следует назвать и метод прямого экспериментального моделирования жидкостей (Бернал, Кинг, Скотт), осуществляемый путем встряхивания твердых шаров в баллонах с нерегулярной шероховатой поверхностью. Исследования такого рода показали, что структура жидкости в большой степени определяется геометрическими факторами и близка к так называемой случайной плотноупакованной структуре (для такой структуры объем сфер составляет около 0,64 от общего объема, тогда как для регулярной плотноупакованной структуры коэффициент заполнения 0,74 заметим, что относительное различие плотностей регулярной и случайной плотных упаковок приблизительно равно относительному увеличению объема при плавлении аргона). [c.361]
Оксиды неметаллов. Известны оксиды всех неметаллов, полученные непосредственно или косвенно, за исключением оксидов гелия, пеона и аргона. Поскольку разность ОЭО кислорода и неметаллов относительно невелика, природа химической связи в оксидах неметаллов преимущественно ковалентная. Поэтому в подавляющем большинстве случаев оксиды неметаллов — газы, легколетучие жидкости или легкоплавкие твердые вещества. В твердом состоянии, как правило, образуются молекулярные структуры из-за насыщаемости и направленности ковалентных связей. Однако при наличии заметной доли ионной составляющей связи возникают координационные решетки, например, в случае диоксида кремния. В оксидах неметаллов кислород чаще всего подвергается 5/ -гибридизации. Степень гибридизации зависит от физико-химической природы партнера. [c.314]
Чтобы исключить окисление очищаемого металла, зонную плавку ведут в атмосфере инертного газа (аргона или азота). Метод позволяет получать металлы (п некоторые другие вещества) очень высокой степени чистоты. [c.264]
Исследовались также ИК-спектры поглощения тех же гидратов с D O и HDO. Дейтерированию подвергался хлористый магний, тщательно обезвоженный и возог-нанный в токе сухого хлористого водорода. Образцы для съемки спектров готовились перекристаллизацией из концентрированного водного раствора на окошке пз aF. или на полиэтиленовой пленке в токе осушенного подогреваемого (— 50—60° С) аргона. Степень дейтерирования и толщина слоя, наносимого на окошко, не измерялись, однако контроль осуществлялся по полосам поглощения в области частот валентных колебаний воды. [c.342]
Мембранная установка включает 12 мембранных аппаратов, каждый из которых имеет внутренний диаметр 0,1 м и длину 3,0 м, и смонтирована на площади около 60 М-. Продувочные газы, содержащие после стадии синтеза и конденсации около 2% (об.) аммиака, под давлением 14 МПа направляют в скруббер водной промывки для окончательного улавливания КНз. Газовая смесь, очищенная от аммиака и содержащая 62,3% (об.) водорода, 20,9% (об.) азота, 10,4%, (об.) метана и 6,4% (об.) аргона, проходит через 8 последовательно установленных аппаратов I ступени очистки. Пермеат I ступени, содержащий 87,3% (об.) водорода, под давлением 7,0 МПа подают на вторую ступень компрессора свежей азотоводородной смеси и возвращают в производство. Ретант после I ступени разделения направляют на 4 последовательно расположенных мембранных аппарата П ступени. Обогащенный до 84,8% (об.) по водороду газовый поток под давлением 2,5 МПа возвращают на I ступень компрессора свежего газа и далее в цикл. Суммарная степень выделения водорода—87,6%. Обедненный водородом [г=20,8% (об.) И,] ретант после И ступени установки сжигают в трубчатой печи конверсии углеводородов. Работу установки хорошо иллюстрирует табл, 8.4. [c.278]
В то же время аналитическое решение задач химической кинетики при рассмотрении ее совместно с другими релаксационными процессами (мак-свеллизация, колебательная релаксация и т. д.) в настоящее время невозможно [149]. Поэтому большой интерес представляет разработка численных методов, пригодных для решения широкого класса таких задач. В [55] изложены результаты расчетов на ЭВМ для задачи о максвеллизации бинарной смеси метана и аргона с разными начальными температурами (соответственно 300 и 40 ООО К). Оказалось, что процесс релаксации по поступательным степеням свободы протекает в два этапа. На первом, неадиабатическом этапе функции распределения молекул обоих газов существенно отличаются от максвелловских, причем высокоэнергетическое крыло функции распределения метана образуется практически мгновенно. Наличие этого крыла должно оказать существенное влияние на кинетику других релаксационных процессов (в частности, химических реакций), особенно в начальные моменты времени. [c.205]
Исключительно высокая степень осушки газа, которая может быть достигнута молекулярными ситами, была показана очень эффективными опытами Р. Бэррера. Эти опыты проводились с аргоном, который осушался тремя указанными в табл. 11 способами 1) через перхлорат магния и фосфорный ангидрид 2) через перхлорат магния, фосфорный ангидрид и натриевый фильтр и 3) через молекулярные сита 4 и зА. Для определения оставшейся в аргоне влаги был применен весьма чувствительный метод. После осушителя аргон пропускался с постоянной скоростью над блестящей поверхностью чистого жидкого натрия или висмута. Малейшие следы влаги вызывают помутнение зеркальной поверхности этих металлов. При первом из способов осушки помутнение наблюдалось через 1 ч, при втором — через 4—5 ч, а при использовании молекулярных сит поверхность металлов оставалась блестящей при пропускании аргона даже в течение 80 ч. [c.313]
Графитация карбонизованного волокна осуществляется при очень БЫС0Ы1х температурах (до 3000°С) в инертной среде, обычно азоте или аргоне. На этой стадии еще в большей мере, чем при карбонизации, необходима тщательная очистка защитных газов от следов кислорода, а также применение аппаратуры, исключающей попадание кислорода воздуха в реакционное пространство. Как и при карбонизации, к основным условиям графитации относятся среда, температурно-временные реясимы, степень вытягивания волокна. [c.62]
Исходные данные мощность выброса - 12 500 м7ч химический состав выброса % об) азот - 78, кислород -21, аргон - 0,93, пары воды -0,04, диоксид углерода - 0,03 концентрация примесей, подлежащих обезвреживанию (г/м ) фенол - 1,25, этанол - 0,025 предельно допустимые кэнцентрации (мг/м ) фенол - 0,01, этанол - 6 температура промышленного выброса - 15°С катализатор - АП-56, размеры гранул катализа-тэра (м) диаметр - 0,003, высота - 0,005 порозность слоя катализатора - 0,375 требуемая степень очистки по веществу с меньшей предельно допустимой концентрацией У = 0,998. Расчет выполняется по фенолу. Кинетическое уравнение процесса глубокого окисления фенола на катализаторе АП-56 (табл. П,1) [c.224]
При этой температуре, как видно из рис. (У.14), энтальпия водорода примерно в 8 раз больше энтальпии аргона, а степень диссоциации На на атомы достигает почти 96%. При охлаждении водорода от 5000 до 1700° К, т. е. до температуры, когда реакция (У.61) протекает еще со значительным выходом, 1 тль водорода отдает около 135 ккал. Этого количества теплоты достаточно для нагревания примешиваемого к плазменной струе холодного метана и образования одного моля ацетилена. В этих же условиях из более тяжелых углеводородов образуется до 1,3—1,4 моль С2Н2. Весьма существенно, что в струе водородной плазмы достижимы значительно большие степени превращения метана (и других углеводородов) в ацетилен (80—85%) по сравнению с прямым воздействием электрической дуги на углеводород . Поэтому водород плазмы не снижает концентрацию получаемого ацетилена. [c.152]
В первом способе плазма образуется при пропускании рабочего плазмообразующего вещества через электрическую дугу. Используемое в дуге напряжение невелико (40—100 В), плотность тока достаточно велика (>1 А). В качестве плазмообразующих газов используются обычно азот, водород, гелий, аргон. Изменяя газ, можно изменять химические свойства среды плазмы (окислительные, нейтральные, восстановительные). Плазма может иметь разную температуру (от 5000 до 50000° С). Соответственно степень ионизации может изменяться от 1 до 100%. Дуговые плазменные струи всегда в некоторой степени загрязнены материалом электродов. Поэтому наряду с дуговыми плазмотронами развивается разработка высокачастотных и сверхвысокочастотных плазмотронов, в которых источником плазмы является высокочастотный индукционный нагрев. [c.538]
Валентные соединения аргона до сих пор еще не получены, а соединения его электронных аналогов Кг, Хе, Нп изучены в последние годы. Высшей степени возбуждения соответствует только соединение ксенона Хе04, представляющее собой взрывчатое вещество. [c.55]
chem21.info
Высшая степень окисления, формулы и примеры
Понятие степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная – число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, h3, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na+1I-1, Mg+2Cl-12, Al+3F-13, Zr+4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Высшая степень окисления
Для элементов, проявляющих в своих соединениях различные степени окисления, существуют понятия высшей (максимальной положительной) и низшей (минимальной отрицательной) степеней окисления. Высшая степень окисления химического элемента обычно численно совпадает с номером группы в Периодической системе Д. И. Менделеева. Исключения составляют фтор (степень окисления равна -1, а элемент расположен в VIIA группе), кислород (степень окисления равна +2, а элемент расположен в VIA группе), гелий, неон, аргон (степень окисления равна 0, а элементы расположены в VIII группе), а также элементы подгруппы кобальта и никеля (степень окисления равна +2, а элементы расположены в VIII группе), для которых высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3).
Примеры решения задач
ru.solverbook.com