2. Физические свойства неметаллов. Азот агрегатное состояние при обычных условиях
Азот | Учеба-Легко.РФ - крупнейший портал по учебе
Свойства 7N.
| Атомная масса | 14,006 | кларк, ат.% (распространненость в природе) | 0,03 |
| Электронная конфигурация* |
| Агрегатное состояние (н. у.). | газ |
|
| 0,071 |
| бесцветный |
|
| 0,015 |
| -210,01 |
| Энергия ионизации
|
14,53 |
| -195,81 |
| Относительная электро-отрицательность |
3,0 | Плотность | 0,879 |
| Возможные степени окисления |
-3 ¸ +5 | Стандартный электродный потенциал
| ¾ |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе. Азот в природе встречается главным образом в свободном состоянии. В воздухе объемная доля его составляет 78,09%, а массовая доля 75,6%. Соединения азота в небольших количествах содержатся в почвах. Азот входит в состав белковых веществ и многих естественных органических соединений.
Получение. В технике азот получают из жидкого воздуха. Как известно, воздух — это смесь газов, главным образом азота и кислорода. Сухой воздух у поверхности Земли содержит (в объемных долях): азота 78,09%, кислорода 20,95%, благородных газов 0,93%, оксида углерода (IV) 0,03%, а также случайные примеси — пыль, микроорганизмы, сероводород, оксид серы (IV) и др. Для получения азота воздух переводят в жидкое состояние, а затем испарением отделяют азот от менее летучего кислорода (т. кип. азота -195,8° С, кислорода -183° С). Полученный таким образом азот содержит примеси благородных газов (преимущественно аргона). Чистый азот можно получить в лабораторных условиях, разлагая при нагревании нитрит аммония:
Физические свойства. Азот в свободном состоянии — газ без цвета и запаха, состоящий из двухатомных молекул N2. Он является основным компонентом атмосферы Земли (78% по объему). Азот легче воздуха. Растворимость в воде меньше, чем у кислорода: при 20 °С в 1 л воды растворяется 15,4 мл азота (кислорода 31 мл). Поэтому в воздухе, растворенном в воде, содержание кислорода по отношению к азоту больше, чем в атмосфере. Малая растворимость азота в воде, а также его очень низкая температура кипения объясняются весьма слабыми межмолекулярными взаимодействиями как между молекулами азота и воды, так и между молекулами азота.
Природный азот состоит из двух стабильных изотопов с массовыми числами 14 (99,64%) и 15 (0,36%).
В молекуле N2 атомы связаны тремя ковалентными связями (две p -связи, одна s -связь), поэтому энергия диссоциации этой молекулы чрезвычайно велика:
Этим объясняется малая реакционная способность азота при обычной температуре (сравните с О2 и Cl2).
Химические свойства. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул нагреванием, облучением или другими способами.
Из металлов азот реагирует в обычных условиях только с литием, образуя нитрид:
С другими металлами он реагирует лишь при высоких температурах, образуя нитриды. С натрием, кальцием и магнием реакция идет только при нагревании:
Образующиеся нитриды полностью гидролизуются при контакте с водой:
С кислородом азот взаимодействует только в электрической дуге (3000-4000° С) (например, при грозовом разряде в атмосфере) или при очень сильном нагревании:
Поскольку на внешнем энергетическом уровне атома азота находится 5 электронов, азот проявляет степени окисления -3 и +5, а также +4, +3, +2, +1, -1 и -2.
Применение. В больших количествах азот употребляется для получения аммиака. Широко используется для создания инертной среды — наполнение электрических ламп накаливания и свободного пространства в ртутных термометрах, при перекачке горючих жидкостей. Им азотируют поверхность стальных изделий, т. е. насыщают их поверхность азотом при высокой температуре. В результате в поверхностном слое образуются нитриды железа, которые придают стали большую твердость. Такая сталь выдерживает нагревание до 500 °С без потери своей твердости.
Важное значение азот имеет для жизни растений и животных, поскольку он входит в состав белковых веществ. Соединения азота находят применение в производстве минеральных удобрений, взрывчатых веществ и во многих отраслях промышленности.
Аммиак. В огромных количествах азот используется для синтеза аммиака.
Реакция с водородом идет при нагревании (хотя процесс и экзотермический!) и очень высоком давлении и обязательно с катализатором:
Физические свойства. Аммиак — важнейшее соединение азота. В обычных условиях это — бесцветный газ, легче воздуха, с резким запахом. Аммиак сжижается при -33,35 °С и затвердевает при -77,7 °С.
Электронная формула молекулы аммиака такова:
Видно, что из четырех электронных пар при азоте три общие (связывающие) и одна неподеленная (несвязывающая).
Химическая связь N—Н полярная: положительный заряд сосредоточен на атомах водорода, отрицательный — на атоме азота. Вследствие этого между молекулами аммиака и образуется водородная связь, что можно изобразить так:
Благодаря водородным связям аммиак имеет сравнительно высокие температуры плавления и кипения, а также высокую теплоту испарения, он легко сжижается.
Раствор аммиака в воде представляет собой раствор гидроксида аммония, содержащий одновременно молекулярные частицы Nh4 и Nh5OH и ионы Nh5+ и ОН- :
Азот в аммиаке имеет наименьшую степень окисления и поэтому проявляет только восстановительные свойства. Так, например, при горении аммиака образуются азот и вода:
В присутствии катализатора аммиак может окисляться и до оксида азота NО:
При нагревании аммиака с галогенами, перокcидом водорода, оксидами тяжелых металлов образуется молекулярный азот:
Аммиак идет главным образом на производство азотной кислоты и различных удобрений — нитрата аммония Nh5NO3, карбамида (мочевины)(Nh3)2CO, аммофоса (смесь гидро- и дигидрофосфатов аммония (Nh5)2HPO4 и Nh5h3PO4).
Соли аммония. Продукты взаимодействия аммиака с кислотами представляют собой соли аммония:
Соли аммония по многим свойствам похожи на соли щелочных металлов, особенно на соли калия и рубидия. Такое сходство объясняется тем, что размер иона аммония (радиус 1,48 А) близок к размерам ионов К+ (1,33 Å) и Rb+ (1,48 Å).
Они проявляют общие свойства солей, т. е. взаимодействуют с растворами щелочей, кислот и других солей:
Все аммонийные соли растворимы в воде и при этом гидролизуются. Соли аммония термически неустойчивы и при нагревании разлагаются:
Оксиды азота. В оксидах азота степень его окисления меняется от 1+ до 5+. Оксиды N2O и NO—- бесцветные газы, оксид азота (IV) NO2 — бурый газ, получивший в промышленности название “лисий хвост”. Оксид азота (III) N2O3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы.
Оксиды N2O и NO не реагируют c водой и щелочами, тогда как N2O3 и N2O5, являясь ангидридами, при взаимодействии с водой дают соответствующие кислоты:
Азотистая кислота. HNO2 неустойчива, тогда как ее соли нитриты, устойчивы.
Оксид азота (IV) NO2 легко подвергается димеризации, уже при незначительном охлаждении образуя жидкость желто-зеленого цвета:
Поскольку образующаяся азотистая кислота неустойчива, то при нагревании реакция идет по-другому:
Если диоксид азота NO2 растворяют в воде в присутствии кислорода, то получают только азотную кислоту:
Последнюю реакцию используют в промышленности для получения азотной кислоты.
Азотная кислота. НNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, очень гигроскопична, “дымит” на воздухе. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Химические свойства. Под действием света азотная кислота частично разлагается с выделением NО2 и за счет этого приобретает светло-бурый цвет:
Азотная кислота принадлежит к числу наиболее сильных кислот, и для нее характерны все реакции, в которые вступают кислоты, — с основаниями, основными оксидами и т. д.
Специфическим свойством азотной кислоты является ее ярко выраженная окислительная способность. Сущность окисления различных веществ азотной кислотой заключается в том, что ион NO3- , имеющий в своем составе азот в степени окисления 5+, в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3- в связи с этим может протекать до различных веществ:
Какое из этих веществ образуется, т. е. насколько глубоко произошло восстановление азотной кислоты, в каждом конкретном случае зависит от природы восстановителя, от условий протекания реакции и от концентрации самой кислоты.
При прочих равных условиях образование тех или иных продуктов восстановления азотной кислоты зависит от концентрации. Азотная кислота обладает окислительной способностью при любой концентрации, при этом, однако, чем концентрированнее HNO3, тем менее глубоко она восстанавливается.
С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NO2; если HNO3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2—5), в зависимости от степени разбавления.
Чтобы восстановление HNO3 провести наиболее глубоко, необходимо использовать максимально разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоде. При использовании более концентрированной кислоты низшие оксиды азота (образованные в ходе реакции) окисляются концентрированной кислотой до высших.
Азотная кислота взаимодействует со всеми металлами, за исключением Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях также с Fe, Al и Сr, которые она пассивирует, однако при очень сильном нагревании HNO3 взаимодействует и с этими металлами.
Большинство неметаллов и сложных веществ восстанавливают HNO3, как правило, до NO (реже до NO2):
Азотная кислота окисляет при нагревании даже кремний:
Однако полного растворения образца кремния при этом не происходит, так как, едва начавшись, последняя реакция быстро прекращается, поскольку образующийся на поверхности кристаллический SiO2 (кислотный оксид с высшей степенью окисления кремния) препятствует дальнейшему протеканию реакции.
Если же взять смесь азотной и плавиковой кислот, то при нагревании происходит полное растворение образца кремния:
С помощью концентрированной HNO3 можно растворить также и золото. Для этого необходимо взять смесь, состоящую из одного объема концентрированной HNO3 и трех объемов концентрированной соляной кислоты (такую смесь называют царской водкой):
Действие царской водки объясняется тем, что концентрированная HNO3 окисляет НСl по реакции (*) до свободного хлора, который в момент выделения является очень сильным окислителем. По этой причине при растворении металлов в царской водке никогда не получаются соли азотной кислоты, а получаются соответствующие хлориды.
Разложение нитратов. При нагревании твердых нитратов практически все они разлагаются с выделением кислорода (единственным исключением является нитрат аммония), при этом все нитраты можно разделить на четыре группы.
Первую группу составляют нитраты щелочных металлов, которые при нагревании разлагаются на нитриты и кислород, например:
Вторую группу составляет большинство нитратов менее активных металлов (от щелочноземельных металлов до меди включительно), которые разлагаются на оксид металла, NO2 и кислород:
Третью группу составляют нитраты наиболее тяжелых металлов, разлагающиеся до свободного металла, NO2 и кислорода:
Четвертую группу составляет нитрат аммония.
Азотистая кислота. HNО2 принадлежит к слабым кислотам (К = 6Ч10-4 при 25 °С), она лишь немного сильнее уксусной. Азотистая кислота неустойчива и известна только в разбавленных растворах, в которых осуществляется равновесие
Нитриты, в отличие от самой кислоты, устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду:
Применение. Большие количества азотной кислоты расходуются на приготовление азотных удобрений, взрывчатых и лекарственных веществ, красителей пластмасс, искусственных волокон и др. материалов. Дымящая азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
uclg.ru
Что такое агрегатное состояние? Агрегатное состояние вещества
Вопросы о том, что такое агрегатное состояние, какими особенностями и свойствами обладают твердые вещества, жидкости и газы, рассматриваются в нескольких учебных курсах. Существует три классических состояния материи, со своими характерными чертами строения. Их понимание является важным моментом в постижении наук о Земле, живых организмах, производственной деятельности. Эти вопросы изучают физика, химия, география, геология, физическая химия и другие научные дисциплины. Вещества, находящиеся при определенных условиях в одном из трех базовых типов состояния, могут изменяться при повышении или понижении температуры, давления. Рассмотрим возможные переходы из одних агрегатных состояний в другие, как они осуществляются в природе, технике и повседневной жизни.
Что такое агрегатное состояние?
Слово латинского происхождения "aggrego" в переводе на русский язык означает «присоединять». Научный термин относится к состоянию одного и того же тела, вещества. Существование при определенных температурных значениях и разном давлении твердых тел, газов и жидкостей характерно для всех оболочек Земли. Помимо трех базовых агрегатных состояний, существует еще и четвертое. При повышенной температуре и неизменном давлении газ превращается в плазму. Чтобы лучше понять, что такое агрегатное состояние, необходимо вспомнить о мельчайших частицах, из которых состоят вещества и тела.
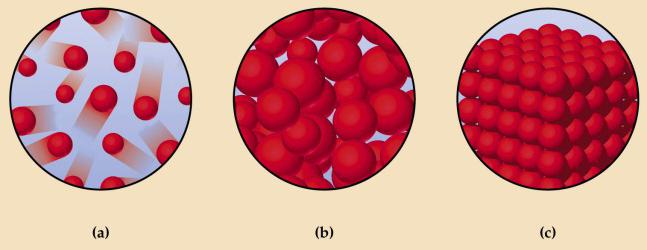
На схеме вверху показаны: а — газ; b — жидкость; с — твердое тело. На подобных рисунках кружочками обозначаются структурные элементы веществ. Это условное обозначение, на самом деле атомы, молекулы, ионы не являются сплошными шариками. Атомы состоят из положительно заряженного ядра, вокруг которого на большой скорости движутся отрицательно заряженные электроны. Знания о микроскопическом строении вещества помогают лучше понять различия, существующие между разными агрегатными формами.
Представления о микромире: от Древней Греции до XVII века
Первые сведения о частицах, из которых сложены физические тела, появились в Древней Греции. Мыслители Демокрит и Эпикур ввели такое понятие, как атом. Они считали, что эти мельчайшие неделимые частицы разных веществ обладают формой, определенными размерами, способны к движению и взаимодействию друг с другом. Атомистика стала наиболее передовым для своего времени учением Древней Греции. Но ее развитие затормозилось в средние века. Так как тогда ученых преследовала инквизиция римской католической церкви. Поэтому вплоть до нового времени не было внятной концепции, что такое агрегатное состояние вещества. Только после XVII века ученые Р. Бойль, М. Ломоносов, Д. Дальтон, А. Лавуазье сформулировали положения атомно-молекулярной теории, не утратившие своего значения и в наши дни.
Видео по теме
Атомы, молекулы, ионы — микроскопические частицы строения материи
Значительный прорыв в понимании микромира произошел в XX веке, когда был изобретен электронный микроскоп. С учетом открытий, сделанных учеными ранее, удалось сложить стройную картину микромира. Теории, описывающие состояние и поведение мельчайших частиц вещества, довольно сложные, они относятся к области квантовой физики. Для понимания особенностей разных агрегатных состояний материи достаточно знать названия и особенности основных структурных частиц, которые образуют разные вещества.
- Атомы — химически неделимые частицы. Сохраняются в химических реакциях, но разрушаются в ядерных. Металлы и многие другие вещества атомарного строения имеют твердое агрегатное состояние при обычных условиях.
- Молекулы — частицы, которые разрушаются и образуются в химических реакциях. Молекулярное строение имеют кислород, вода, углекислый газ, сера. Агрегатное состояние кислорода, азота, диоксидов серы, углерода, кислорода при обычных условиях — газообразное.
- Ионы — заряженные частицы, в которые превращаются атомы и молекулы, когда присоединяют или теряют электроны — микроскопические отрицательно заряженные частички. Ионное строение имеют многие соли, например поваренная, железный и медный купорос.
Есть вещества, частицы которых определенным образом расположены в пространстве. Упорядоченное взаимное положение атомов, ионов, молекул называют кристаллической решеткой. Обычно ионные и атомарные кристаллические решетки характерны для твердых веществ, молекулярные - для жидкостей и газов. Высокой твердостью отличается алмаз. Его атомная кристаллическая решетка образована атомами углерода. Но мягкий графит тоже состоит из атомов этого химического элемента. Только они по-другому расположены в пространстве. Обычное агрегатное состояние серы — твердое, но при высоких температурах вещество превращается в жидкость и аморфную массу.
Вещества в твердом агрегатном состоянии
Твердые тела при обычных условиях сохраняют объем и форму. Например, песчинка, крупинка сахара, соли, кусок горной породы или металла. Если нагревать сахар, то вещество начинает плавиться, превращаясь в вязкую коричневую жидкость. Прекратим нагревание — снова получим твердое вещество. Значит, одно из главных условий перехода твердого тела в жидкость — его нагревание или повышение внутренней энергии частиц вещества. Твердое агрегатное состояние соли, которую используют в пищу, тоже можно изменить. Но чтобы расплавить поваренную соль, нужна более высокая температура, чем при нагревании сахара. Дело в том, что сахар состоит из молекул, а поваренная соль - из заряженных ионов, которые сильнее притягиваются друг к другу. Твердые вещества в жидком виде не сохраняют свою форму, потому что кристаллические решетки разрушаются.
Жидкое агрегатное состояние соли при расплавлении объясняется разрывом связи между ионами в кристаллах. Освобождаются заряженные частички, которые могут переносить электрические заряды. Расплавы солей проводят электричество, являются проводниками. В химической, металлургической и машиностроительной промышленности твердые вещества превращают в жидкие для получения из них новых соединений или придания им разной формы. Большое распространение получили сплавы металлов. Есть несколько способов их получения, связанных с изменениями агрегатного состояния твердого сырья.

Жидкость — одно из базовых агрегатных состояний
Если налить в круглодонную колбу 50 мл воды, то можно заметить, что вещество сразу же примет форму химического сосуда. Но как только мы выльем воду из колбы, то жидкость сразу же растечется по поверхности стола. Объем воды останется тот же — 50 мл, а ее форма изменится. Перечисленные особенности характерны для жидкой формы существования материи. Жидкостями являются многие органические вещества: спирты, растительные масла, кислоты.
Молоко — эмульсия, т. е. жидкость, в которой находятся капельки жира. Полезное жидкое ископаемое — нефть. Добывают ее из скважин с помощью буровых вышек на суше и в океане. Морская вода тоже является сырьем для промышленности. Ее отличие от пресной воды рек и озер заключается в содержании растворенных веществ, в основном солей. При испарении с поверхности водоемов в парообразное состояние переходят только молекулы Н2О, растворенные вещества остаются. На этом свойстве основаны методы получения полезных веществ из морской воды и способы ее очистки.
При полном удалении солей получают дистиллированную воду. Она кипит при 100 °С, замерзает при 0 °С. Рассолы кипят и превращаются в лед при других температурных показателях. Например, вода в Северном Ледовитом океане замерзает при температуре на поверхности 2 °С.
Агрегатное состояние ртути при обычных условиях — жидкость. Этим серебристо-серым металлом обычно заполняют медицинские термометры. При нагревании столбик ртути поднимается по шкале, происходит расширение вещества. Почему же в уличных термометрах используется подкрашенный красной краской спирт, а не ртуть? Объясняется это свойствами жидкого металла. При 30-градусных морозах агрегатное состояние ртути меняется, вещество становится твердым.
Если медицинский термометр разбился, а ртуть вылилась, то собирать руками серебристые шарики опасно. Вредно вдыхать пары ртути, это вещество очень токсичное. Детям в таких случаях надо обратиться за помощью к родителям, взрослым.

Газообразное состояние
Газы не способны сохранять ни свой объем, ни форму. Заполним колбу доверху кислородом (его химическая формула О2). Как только мы откроем колбу, молекулы вещества начнут смешиваться с воздухом в помещении. Это происходит благодаря броуновскому движению. Еще древнегреческий ученый Демокрит считал, что частички вещества находятся в постоянном движении. В твердых телах при обычных условиях у атомов, молекул, ионов нет возможности покинуть кристаллическую решетку, освободиться от связей с другими частицами. Такое возможно только при поступлении большого количества энергии извне.
В жидкостях расстояние между частицами немного больше, чем в твердых телах, им требуется меньше энергии для разрыва межмолекулярных связей. К примеру, жидкое агрегатное состояние кислорода наблюдается только при снижении температуры газа до −183 °C. При −223 °C молекулы О2 образуют твердое вещество. При повышении температуры сверх приведенных значений кислород превращается в газ. Именно в таком виде он находится при обычных условиях. На промышленных предприятиях действуют специальные установки для разделения воздуха атмосферы и получения из него азота и кислорода. Сначала воздух охлаждают и сжижают, а затем постепенно повышают температуру. Азот и кислород превращаются в газы при разных условиях.
Атмосфера Земли содержит 21 % по объему кислорода и 78 % азота. В жидком виде эти вещества в газовой оболочке планеты не встречаются. Жидкий кислород имеет светло-синий цвет, им при высоком давлении заполняют баллоны для использования в медицинских учреждениях. В промышленности и строительстве сжиженные газы необходимы для проведения очень многих процессов. Кислород нужен для газовой сварки и резки металлов, в химии — для реакций окисления неорганических и органических веществ. Если открыть вентиль кислородного баллона, давление уменьшается, жидкость превращается в газ.
Сжиженные пропан, метан и бутан находят широкое применение в энергетике, на транспорте, в промышленности и хозяйственно-бытовой деятельности населения. Получают эти вещества из природного газа или при крекинге (расщеплении) нефтяного сырья. Углеродные жидкие и газообразные смеси играют важную роль в экономике многих стран. Но запасы нефти и природного газа сильно истощены. По оценкам ученых, этого сырья хватит на 100–120 лет. Альтернативный источник энергии - воздушный поток (ветер). Используются для работы электростанций быстротекущие реки, приливы на берегах морей и океанов.

Кислород, как и другие газы, может находиться в четвертом агрегатном состоянии, представляя собой плазму. Необычный переход из твердого состояния в газообразное — характерная черта кристаллического йода. Вещество темно-фиолетового цвета подвергается сублимации — превращается в газ, минуя жидкое состояние.
Как осуществляются переходы из одной агрегатной формы материи в другую?
Изменения агрегатного состояния веществ не связаны с химическими превращениями, это физические явления. При повышении температуры многие твердые тела плавятся, превращаются в жидкости. Дальнейшее повышение температуры может привести к испарению, то есть к газообразному состоянию вещества. В природе и хозяйстве такие переходы характерны для одного из главных веществ на Земле. Лед, жидкость, пар — это состояния воды при разных внешних условиях. Соединение одно и то же, его формула — Н2О. При температуре 0 °С и ниже этого значения вода кристаллизуется, то есть превращается в лед. При повышении температуры возникшие кристаллики разрушаются — лед тает, вновь получается жидкая вода. При ее нагревании образуется водяной пар. Испарение — превращение воды в газ — идет даже при низких температурах. Например, замерзшие лужи постепенно исчезают, потому что вода испаряется. Даже в морозную погоду мокрое белье высыхает, но только процесс этот более длительный, чем в жаркий день.
Все перечисленные переходы воды из одного состояния в другое имеют огромное значение для природы Земли. Атмосферные явления, климат и погода связаны с испарением воды с поверхности Мирового океана, переносом влаги в виде облаков и тумана на сушу, выпадением осадков (дождя, снега, града). Эти явления составляют основу Мирового круговорота воды в природе.

Как меняются агрегатные состояния серы?
При обычных условиях сера — это яркие блестящие кристаллы или светло-желтый порошок, т. е. это твердое вещество. Агрегатное состояние серы меняется при нагревании. Сначала при повышении температуры до 190 °C желтое вещество плавится, превращаясь в подвижную жидкость.
Если быстро вылить жидкую серу в холодную воду, то получается коричневая аморфная масса. При дальнейшем нагревании расплава серы он становится все более вязким, темнеет. При температуре свыше 300 °C агрегатное состояние серы снова изменяется, вещество приобретает свойства жидкости, становится подвижным. Эти переходы возникают благодаря способности атомов элемента образовывать цепочки разной длины.
Почему вещества могут находиться в разных физических состояниях?
Агрегатное состояние серы — простого вещества — твердое при обычных условиях. Диоксид серы — газ, серная кислота — маслянистая жидкость тяжелее воды. В отличие от соляной и азотной кислот она не летучая, с ее поверхности не испаряются молекулы. Какое агрегатное состояние имеет пластическая сера, которую получают при нагревании кристаллов?
В аморфном виде вещество имеет структуру жидкости, обладая незначительной текучестью. Но пластическая сера одновременно сохраняет форму (как твердое вещество). Существуют жидкие кристаллы, обладающие рядом характерных свойств твердых веществ. Таким образом, состояние вещества при разных условиях зависит от его природы, температуры, давления и других внешних условий.
Какие существуют особенности в строении твердых тел?
Имеющиеся различия между основными агрегатными состояниями материи объясняются взаимодействием между атомами, ионами и молекулами. Например, почему твердое агрегатное состояние вещества приводит к способности тел сохранять объем и форму? В кристаллической решетке металла или соли структурные частицы притягиваются другу к другу. В металлах положительно заряженные ионы взаимодействуют с так называемым «электронным газом» — скоплением свободных электронов в куске металла. Кристаллы солей возникают благодаря притяжению разноименно заряженных частиц — ионов. Расстояние между вышеперечисленными структурными единицами твердых тел намного меньше, чем размеры самих частиц. В этом случае действует электростатическое притяжение, оно придает прочность, а отталкивание недостаточно сильное.
Чтобы разрушить твердое агрегатное состояние вещества, надо приложить усилия. Металлы, соли, атомные кристаллы плавятся при очень высоких температурах. К примеру, железо становится жидким при температуре выше 1538 °С. Тугоплавким является вольфрам, из него изготавливают нити накаливания для электрических лампочек. Есть сплавы, которые становятся жидкими при температурах свыше 3000 °С. Многие горные породы и минералы на Земле находятся в твердом состоянии. Добывают это сырье с помощью техники в шахтах и карьерах.

Для отрыва даже одного иона от кристалла необходимо затратить большое количество энергии. Но ведь достаточно растворить соль в воде, чтобы кристаллическая решетка распалась! Это явление объясняется удивительными свойствами воды как полярного растворителя. Молекулы Н2О взаимодействуют с ионами соли, разрушая химическую связь между ними. Таким образом, растворение — это не простое перемешивание разных веществ, а физико-химическое взаимодействие между ними.
Как взаимодействуют молекулы жидкостей?
Вода может быть жидкостью, твердым веществом и газом (паром). Это ее основные агрегатные состояния при обычных условиях. Молекулы воды состоят из одного атома кислорода, с которым связаны два атома водорода. Возникает поляризация химической связи в молекуле, на атомах кислорода появляется частичный отрицательный заряд. Водород становится положительным полюсом в молекуле, притягивается атомом кислорода другой молекулы. Это слабое взаимодействие получило название «водородная связь».
Жидкое агрегатное состояние характеризуют расстояния между структурными частицами, сравнимые с их размерами. Притяжение существует, но оно слабое, поэтому вода не сохраняет форму. Парообразование происходит из-за разрушения связей, которое идет на поверхности жидкости даже при комнатной температуре.

Существуют ли межмолекулярные взаимодействия в газах?
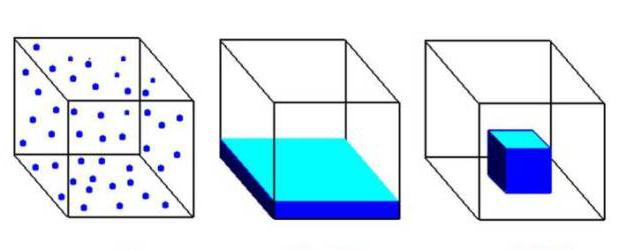
Газообразное состояние вещества по ряду параметров отличается от жидкого и твердого. Между структурными частицами газов существуют большие промежутки, намного превышающие размеры молекул. При этом силы притяжения совсем не действуют. Газообразное агрегатное состояние характерно для веществ, присутствующих в составе воздуха: азота, кислорода, диоксида углерода. На рисунке ниже первый куб заполнен газом, второй жидкостью, а третий — твердым вещество.
Многие жидкости являются летучими, с их поверхности отрываются и переходят в воздух молекулы вещества. Например, если к отверстию открытой бутылки с соляной кислотой поднести ватку, смоченную в нашатырном спирте, то появляется белый дым. Прямо в воздухе происходит химическая реакция между соляной кислотой и аммиаком, получается хлорид аммония. В каком агрегатном состоянии находится это вещество? Его частички, образующие белый дым, представляют собой мельчайшие твердые кристаллы соли. Этот опыт надо проводить под вытяжкой, вещества являются токсичными.
Заключение
Агрегатное состояние газа изучали многие выдающиеся физики и химики: Авогадро, Бойль, Гей-Люссак, Клайперон, Менделеев, Ле-Шателье. Ученые сформулировали законы, объясняющие поведение газообразных веществ в химических реакциях, при изменении внешних условий. Открытые закономерности не только вошли в школьные и вузовские учебники физики и химии. Многие химические производства основаны на знаниях о поведении и свойствах веществ, находящихся в разных агрегатных состояниях.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
 Духовное развитие Что такое альфа-состояние? Альфа-состояние: как войти?
Духовное развитие Что такое альфа-состояние? Альфа-состояние: как войти?Скажите, хотели бы вы стать более эффективным: быстрее думать, усваивать информацию, все запоминать? Звучит соблазнительно, не так ли? Если это вам интересно, то не лишним будет узнать о таком понятии, как состояние а...
 Здоровье Что такое агональное состояние?
Здоровье Что такое агональное состояние?Последний этап умирания называется агония. Агональное состояние характеризуется тем, что начинают активно работать компенсаторные механизмы. Это борьба с угасанием последних жизненных сил организма.Терминальны...
 Здоровье Что такое Терминальное Состояние?
Здоровье Что такое Терминальное Состояние?Критическое состояние, при котором все системы жизнедеятельности организма угасают, называется терминальным состоянием, предшествующим биологической смерти. Терминальное состояние - это обратимый процесс, который хара...
 Искусство и развлечения Что такое танец: состояние души или физкультура?
Искусство и развлечения Что такое танец: состояние души или физкультура? Балет или брейк–данс, кадриль или тектоник, полонез или хастл, хоровод или хип–хоп, - танец столь же многолик, сколь и загадочен. Назвать ли его проявлением физической культуры человека или видом иску...
 Образование Что такое возбужденное состояние атома
Образование Что такое возбужденное состояние атомаВ 1905 году Дж. Томсон предложил первую модель строения атома, согласно которой он представляет собой положительно заряженный шар, внутри которого располагаются частицы с отрицательным зарядом – электроны. Элект...
 Самосовершенствование Что такое смятение? Состояние крайнего замешательства, смущения, взволнованности
Самосовершенствование Что такое смятение? Состояние крайнего замешательства, смущения, взволнованностиКогда человек не знает, за что хвататься, становится невнимательным, рассеянным, иногда резким, и продуктивность его сил сводится к нулю – это признаки посетившего его душу состояния смятения. Как справится с на...
 Самосовершенствование Тревога - это что такое? Определение состояния
Самосовершенствование Тревога - это что такое? Определение состоянияПорой у нас возникают противоречивые чувства, которые мы не можем объяснить. Дома, на работе и в личной жизни вроде бы все хорошо, но что-то все равно не дает покоя. Многим знакомо такое состояние, как тревога. Это см...
 Образование Кристаллизация и плавление: график изменения агрегатного состояния вещества
Образование Кристаллизация и плавление: график изменения агрегатного состояния веществаДанная статья рассказывает, что такое кристаллизация и плавление. На примере различных агрегатных состояний воды объясняется, сколько требуется тепла на заморозку и оттаивание и почему эти величины различны. Показываю...
 Образование Агрегатное состояние вещества
Образование Агрегатное состояние веществаСостояние вещества обладает характерными качествами. Возможность или отсутствие вероятности сохранения формы и объема, существование либо отсутствие ближнего и дальнего порядка и др. – это «агрегатное сост...
 Образование Агрегатное состояние вещества
Образование Агрегатное состояние веществаФизическое или агрегатное состояние материи характеризуется ее определенными свойствами при конкретных условиях (давлении и температуре). То есть она может быть твердой, жидкой или газообразной. Изменение агрегатных с...
monateka.com
Физические свойства кислот — урок. Химия, 8–9 класс.
Агрегатное состояниеПри нормальных условиях (при температуре 0°C) кислоты могут быть как твёрдыми веществами, так и жидкостями.
Твёрдым веществом являются ортофосфорная h4PO4, кремниевая h3SiO3, уксусная Ch4COOH, борная h4BO3 и также лимонная кислота.
В жидком агрегатном состоянии находятся серная h3SO4 и азотная кислота HNO3.
Некоторые кислоты вообще не существуют в чистом виде, а представляют собой водные растворы.
Например, при растворении в воде соответствующих газов образуются плавиковая HF, соляная HCl, бромоводородная HBr, иодоводородная HI и сероводородная кислота h3S. В виде разбавленных водных растворов существует сернистая кислота h3SO3.
Цвет
Водные растворы кислот, как правило, являются бесцветными.Запах
Некоторые кислоты являются летучими и в концентрированном виде имеют резкий запах.
Например, резкий характерный запах имеют концентрированная азотная и концентрированная соляная кислота. Наверное, ни с чем другим невозможно перепутать характерный запах уксусной кислоты.Сероводородная кислота h3S имеет специфический «аромат» сероводорода, напоминающий запах тухлых яиц.Растворимость кислот в воде
В подавляющем большинстве кислоты хорошо растворяются в воде. Практически нерастворимой является кремниевая кислота h3SiO3. Плохо растворяется в воде борная кислота h4BO3.
Правила безопасности при работе с кислотами
Серная, соляная, уксусная кислоты могут вызывать сильные ожоги, разрушать ткани. Поэтому при работе с кислотами необходимо соблюдать особые меры предосторожности.
Обрати внимание!
Если кислота попала на одежду или на поверхность тела, то её необходимо очень быстро смыть большим количеством проточной воды или же нейтрализовать разбавленным нашатырным спиртом.
Если кислота попала на деревянную, металлическую или на другую поверхность, её нейтрализуют известью, мелом или содой.
Кислоты необходимо хранить в хорошо укупоренной посуде и в недоступном для детей месте. Обязательно на таре должна быть этикетка с названием кислоты.

Серная кислота является более сильной кислотой, чем соляная. Концентрированная серная кислота обугливает сахар, дерево, хлопок, шерсть и вызывает очень глубокие ожоги кожи. При её разбавлении водой выделяется очень большое количество теплоты.
Обрати внимание!
При приготовлении раствора серной кислоты необходимо следовать следующему правилу: кислоту льют в воду тонкой струйкой по стенке стеклянной посуды, но не наоборот.
Источники:
Оржековский П. А. и др. Химия: 8-й класс. — Москва: АСТ: Астрель, 2013.
Габриелян О. С. Химия: 8-й класс. — Москва: Дрофа, 2002.
www.yaklass.ru
Оксиды азота | Химическая энциклопедия

Для азота известны оксиды, отвечающие всем его положительным степеням окисления (+1, +2, +3, +4, +5). Оксид азота(І) N20 и оксид азота (II) NO — несолеобразующие оксиды, остальные — солеобразующие кислотные оксиды. Все оксиды азота, за исключением оксида азота(І), ядовиты.
Еще в XVIII в. было замечено, что вдыхание небольших количеств оксида азота(І) N2O приводит к безудержному веселью. Отсюда и название этого соединения — «веселящий газ». Длительное время его использовали в медицине для наркоза.
Оксиды азота
| Оксид азота(I) | N2O | Бесцветный газ | Несолеобразующий | — |
| Оксид азота(II) | NO | Бесцветный газ | Несолеобразующий | — |
| Оксид азота(III) | N2O3 | Темно-синяя жидкость | Кислотный | Азотистая кислота HNO2 |
| Оксид азота(IV) | NO2 | Бурый газ, ниже 21,2 °С — бурая жидкость | Кислотный | Смесь азотистой HNO2 и азотной HNO3 кислот |
| Оксид азота(V) | N2O5 | Бесцветные кристаллы | Кислотный | Азотная кислота HNO3 |
Все оксиды азота проявляют окислительные свойства, которые наиболее сильно выражены у N2O5:
2N2O5 + С = 4NO2 + СO2.
Наибольшее практическое значение имеют оксид азота(П) и оксид азота(ІУ). Только оксид азота(II) NO можно получить при непосредственном взаимодействии азота и кислорода:
N2 + O2 =t 2NO — Q.
Эта реакция протекает при температуре порядка 3000 °С в электрическом разряде. В природе она осуществляется во время грозы. При взаимодействии бесцветного оксида азота(II) с кислородом воздуха образуется оксид азота(ІV), имеющий бурую окраску:
2NO + O2 → 2NO2 + Q.
Поэтому говорят, что оксид азота(П) «буреет» на воздухе. Рассматриваемая реакция является экзотермической и обратимой. При повышении температуры и понижении давления равновесие в системе в соответствии с принципом Ле Шателье смещается влево. Поэтому в атмосфере могут одновременно присутствовать как оксид азота(II), так и оксид азота(IV).
При растворении оксида азота(IV) в охлажденной воде одновременно образуются две кислоты – азотистая HNO2 и азотная HNO3:
2NO2 + h3O = HNO2 + HNO3.
В присутствии кислорода образуется только азотная кислота:
4NO2 + 2h3O + O2 = 4HNO3. Вам необходимо включить JavaScript, чтобы проголосовать
abouthist.net
Физические свойства неметаллов — урок. Химия, 8–9 класс.
Из \(118\) известных на данный момент химических элементов \(22\) элемента образуют простые вещества, обладающие неметаллическими свойствами. Неметаллических простых веществ намного больше, чем самих неметаллических химических элементов. Причиной тому служит существование явления, называемого аллотропией.
Аллотропия — это способность атомов данного химического элемента образовывать несколько простых веществ, называемых аллотропными видоизменениями, или аллотропными модификациями.
Например, химический элемент кислород \(O\) образует простое вещество кислород O2, молекула которого состоит из двух атомов, и простое вещество озон O3, молекула которого состоит из трёх атомов данного элемента.
Химический элемент фосфор \(P\) образует множество аллотропных видоизменений, важнейшими из которых являются красный фосфор и белый фосфор.
Химический элемент углерод \(C\) образует встречающиеся в природе модификации — алмаз и графит.
Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Аллотропия присуща не всем неметаллических химическим элементам.
Например, водород, азот, элементы \(VII\)A и \(VIII\)A групп не имеют аллотропных модификаций, т. е. каждый из упомянутых элементов образует только одно простое вещество.
Кристаллическая решетка неметаллов
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.


Модели кристаллических решёток алмаза (слева) и графита. Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги — в книге
Другая часть неметаллов имеет молекулярную кристаллическую решетку. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому вещества молекулярного строения при обычных условиях могут быть газами, жидкостями или легкоплавкими твёрдыми веществами.
Кислород O2, озон O3, азот N2, водород h3, фтор F2, хлор Cl2, бром Br2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы — это всё вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов, как бы выполняющих роль молекул).


Модель молекулы серы (слева) и кристалл серы. Кристалл серы состоит из отдельных молекул \(S_8\)
Физические свойства неметаллов
Свойства неметаллических простых веществ отличаются большим разнообразием. Собственно говоря, их объединяет только то, что они, как правило, не обладают теми физическими свойствами, которые типичны для металлов, т. е. не обладают характерным металлическим блеском, ковкостью, пластичностью, высокой тепло- и электропроводностью.
Агрегатное состояние
Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
Газообразными неметаллами являются гелий \(He\), неон \(Ne\), аргон \(Ar\), криптон \(Kr\), ксенон \(Xe\) и радон \(Rn\). Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Такие химические элементы, как водород \(H\), кислород \(O\), азот \(N\), хлор \(Cl\), фтор \(F\) образуют газообразные вещества, состоящие из двухатомных молекул, соответственно — h3, O2, N2, Cl2, F2.
Из неметаллических простых веществ при обычных условиях жидкостью является только бром, молекулы которого двухатомны — Br2.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Например, химический элемент углерод образует такие твёрдые вещества, как алмаз и графит. Твёрдыми являются кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2.
Цвет и блеск
Только некоторые неметаллы в отличие от металлов имеют блеск. Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
Если для подавляющего большинства металлов характерны серебристо-серый или серебристо-белый цвета, то окраска неметаллов очень разнообразна. Белый цвет имеет белый фосфор, красный — красный фосфор, жёлтый — сера и фтор, красно-бурый — жидкий бром, жёлто-зелёный — хлор, фиолетовый цвет имеют пары иода, синий — жидкий кислород, серый — графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород.
 | |
Красный фосфор
| Белый фосфор
|
 |  |
Бром
| Хлор
|
 | |
Иод | Алмаз |
Неметаллы могут находиться в твёрдом, жидком и газообразном агрегатных состояниях.
Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеют озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2.
Пластичность
Неметаллы в твёрдом агрегатном состоянии не обладают пластичностью. Они являются хрупкими.
Электро- и теплопроводность
Неметаллы, за исключением графита, плохо проводят тепло и практически не проводят электрический ток (являются диэлектриками).
www.yaklass.ru