Валентные возможности атомов химических элементов. Азот в возбужденном состоянии
Валентные возможности атомов химических элементов
Понятие валентность происходит от латинского слова «valentia» и было известно еще в середине XIX века. Первое «пространное» упоминание валентности было еще в работах Дж. Дальтона, который утверждал, что все вещества состоят из атомов, соединенных между собой в определенных пропорциях. Затем, Франкланд ввел само понятие валентности, которое нашло дальнейшее развитие в трудах Кекуле, который говорил о взаимосвязи валентности и химической связи, А.М. Бутлерова, который в своей теории строения органических соединений связывал валентность с реакционной способностью того или иного химического соединения и Д.И. Менделеева (в Периодической системе химических элементов высшая валентность элемента определяется номером группы).
Основное состояние атома (состояние с минимальной энергией) характеризуется электронной конфигурацией атома, которая соответствует положению элемента в Периодической системе. Возбужденное состояние – это новое энергетическое состояние атома, с новым распределением электронов в пределах валентного уровня.
Графические электронные формулы
Электронные конфигурации электронов в атоме можно изобразить не только в виде электронных формул, но и с помощью электронно-графических формул (энергетических, квантовых ячеек). Каждая ячейка обозначает орбиталь, стрелка – электрон, направление стрелки (вверх или вниз) показывает спин электрона, свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении. Если в ячейке 2 электрона, такие электроны называются спаренными, если электрон 1 – неспаренный. Например:
6C 1s22s22p2

Орбитали заполняют следующим образом: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку на 2p подуровне три орбитали с одинаковой энергией, то каждый из двух электронов занял по одной орбитали. Одна орбиталь осталась свободной.
Определение валентности элемента по электронно-графическим формулам
Валентность элемента можно определить по электронно-графическим формулам электронных конфигураций электронов в атоме. Рассмотрим два атома – азота и фосфора.
7N 1s22s22p3
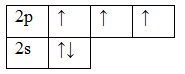
Т.к. валентность элемента определяется числом неспаренных электронов, следовательно, валентность азота равна III. Поскольку у атома азота нет свободных орбиталей, для этого элемента невозможно возбужденное состояние. Однако III, не максимальная валентность азота, максимальная валентность азота V и определяется номером группы. Поэтому, следует запомнить, что с помощью электронно-графических формул не всегда можно определить высшую валентность, а также все валентности, характерные для этого элемента.
15P 1s22s22p63s23p3
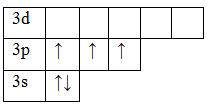
В основном состоянии атом фосфора имеет 3 неспаренных электрона, следовательно, валентность фосфора равна III. Однако, в атоме фосфора имеются свободные d-орбитали, поэтому электроны, находящиеся на 2s – подуровне способны распариваться и занимать вакантные орбитали d-подуровня, т.е. переходить в возбужденное состояние.
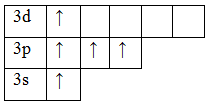
Теперь атом фосфора имеет 5 неспаренных электронов, следовательно для фосфора характерна и валентность, равная V.
Элементы, имеющие несколько значений валентности
Элементы IVA – VIIA групп могут иметь несколько значений валентности, причем, как правило, валентность изменяется ступенчато на 2 единицы. Такое явление обусловлено тем, что в образовании химической связи электроны участвуют попарно.
В отличие от элементов главных подгрупп, элементы В-подгрупп, в большинстве соединений не проявляют высшую валентность, равную номеру группы, например, медь и золото. В целом, переходные элементы проявляют большое разнообразие химических свойств, которое объясняется большим набором валентностей.
Рассмотрим электронно-графические формулы элементов и установим, в связи с чем элементы имеют разные валентности (рис.1).
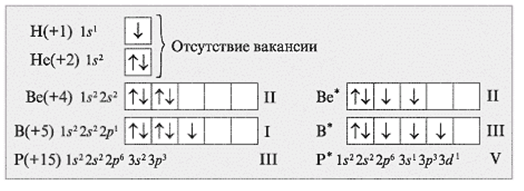
Задания: определите валентные возможности атомов As и Cl в основном и возбужденном состояниях.
Ответы:
33As 1s22s22p63s23p63d104s24p3
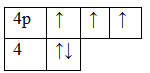
Основное состояние. Валентность равна III.
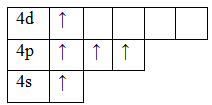
Возбужденное состояние. Валентность равна V.
17Cl 1s22s22p63s23p5
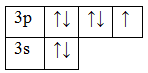
Основное состояние. Валентность равна I.
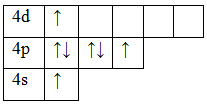
Возбужденное состояние 1. Валентность равна III.
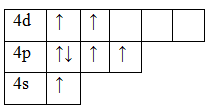
Возбужденное состояние 2. Валентность равна IV.
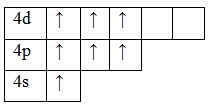
Возбужденное состояние 3. Валентность равна VII.
Атом - азот - Большая Энциклопедия Нефти и Газа, статья, страница 3
Атом - азот
Cтраница 3
Атом азота не может переходить в возбужденное состояние, так как на втором энергетическом уровне ( п 2) нет d - подуровня. [32]
Атом азота в молекуле аммиака имеет неподеленную электронную пару, которая может участвовать в образовании донорно-акцепторной связи. [33]
Атом азота в молекуле аммиака связан тремя ковалентными связями с атомами водорода и сохраняет при этом одну неподе-ленную электронную пару. [34]
Атом азота в невозбужденном состоянии характеризуется тремя вырожденными 2р - элект-ронами при наличии двух спаренных электронов 25-орбитали. Три неспаренных электрона на 2 / з-орбитали ответственны прежде всего за трехковалентность азота. Именно поэтому характеристическим летучим водородным соединением азота является аммиак, в котором атом азота образует три ковалентные связи по обменному механизму с тремя атомами водорода. У азота нет возможности промо-тирования электронов с переходом в возбужденное состояние, так как ближайшие орбитали при п - 3 ( 3s -, Зр - и Sd-оболочки) слишком высоки по энергии. Затраты энергии на промотирование с изменением главного квантового числа значительно больше, чем выигрыш в энергии за счет образования дополнительных связей. Поэтому максимальная валентность азота равна четырем. При этом три ковалентные связи могут быть образованы по обменному механизму, а одна - по донорно-акцепторному. Однако азот в состоянии однозарядного катиона N может образовать все четыре связи по обменному механизму. [35]
Атом азота не может переходить в возбужденное состояние, так как на втором энергетическом уровне ( п2) нет d - подуровня. [36]
Атом азота в молекуле аммиака имеет неподеленную электронную пару, которая может участвовать в образовании донорно-акцепторной связи. [37]
Атомы азота, подобно атомам кислорода и фтора, не имеют остовных / - электронов, и азот значительно отличается по своим свойствам от других элементов группы ( см. гл. [38]
Атом азота как бы дает электронную пару для образования связи и является поэтому донором электронной пары, а ион водорода принимает эту пару и является акцептором электронной пары. Поэтому данный вид ковалентной связи называют донорно-акцепторной связью. [39]
Атом азота имеет пять валентных электронов. При образовании молекулы N2rU три валентных электрона каждого атома азота участвуют в формировании двух ковалентных связей N - Н и одной ковалентной связи N-N, два оставшихся валентных электрона каждого атома азота составляют иеподеленную электронную пару. [40]
Атом азота в ареколинеи арекаидине связан с метильной группой. Это видно из того, что при действии соляной кислоты на эти соединения при 250 происходит выделение хлористого метила. Раньше считалось, что арекаидин представляет собой частично насыщенную N-метилпиперидинкарбоновую кислоту. [41]
Атомы азота, находясь в положениях 1 3, принимают участие в усилении результирующего электронного эффекта. Поэтому можно было бы ожидать, что пиримидин будет обладать свойствами, подобными свойствам пиридина, и в еще большей степени отличаться от бензола, чем последний. [42]
Атом азота приобретает положительный заряд вследствие обобществления четырех пар электронов. Наоборот, в случае пиридина наиболее неустойчива структура, в которой атом азота несет положительный заряд ( Е), поскольку атом азота в ней имеет лишь секстет электронов. [43]
Атом азота в ареколинеи арекаидине связан с метильной группой. Это видно из того, что при действии соляной кислоты на эти соединения при 250 происходит выделение хлористого метила. Раньше считалось, что арекаидин представляет собой частично насыщенную N-метилпиперидинкарбоновую кислоту. [44]
Атомы азота, находясь в положениях 1 3, принимают участие в усилении результирующего электронного эффекта. Поэтому можно было бы ожидать, что пиримидин будет обладать свойствами, подобными свойствам пиридина, и в еще большей степени отличаться от бензола, чем последний. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Строение атома азота (N), схема и примеры
Общие сведения о строении атома азота
Порядковый номер равен 7. Заряд ядра равен +7. Атомный вес – 14,007а.е.м. В природе встречаются два изотопа азота: 14N — 99,635 % и 15N — 0,365 % (в скобках указано их процентное соотношение).
Электронное строение атома азота
Атом азота имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –V – свидетельствует о том, что на внешнем электронном уровне атома азота находится 5 валентных электронов.
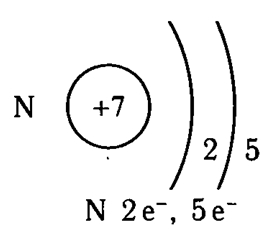
Рис. 1. Схематичное строение атома азота.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p3.
Азот – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
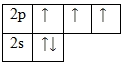
Возбужденного состояния нет. По числу неспаренных электронов можно сказать, что азот в соединениях проявляет валентность III. Однако, валентность так же определяется по номеру группы (V), следовательно, азот может проявлять две валентности – III и V.
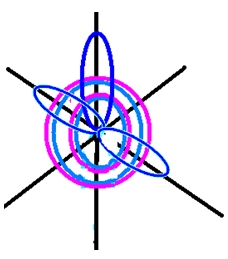
Рис. 2. Пространственное изображение строения атома азота.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Элементы подгруппы азота. Задачи 878
Задача 878.Дать сравнительную характеристику атомов элементов подгруппы азота, указав: а) электронные конфигурации; б) валентные возможности; в) наиболее характерные степени окисленности.Решение:а) Атомы элементов подгруппы азота имеют совпадающие по строению валентные подуровни (ns2np3) различные электронные остовы и вакантные подуровни. Два электрона валентных s-подуровней спарены, три электрона p-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р-подуровню. У фосфора есть один вакантный 3d-подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным.
б) Атом азота имеет два валентных 2s-электрона и три 2р-электрона, поэтому может проявлять степени окисления от -3 до +5 (-3, -2, -1, 0, +1, +2, +3, +4, +5). Фосфор, мышьяк, сурьма и висмут имеют одинаковую конфигурацию валентного уровня с атомом азота, но в возбуждённом состоянии их электрон с s-подуровня может занимать вакантную d-орбиталь [ns1hp3(n-1)d1]. Поэтому для этих элементов наиболее характерными степенями окисления являются -3, +3 (атомы находятся в стационарном состоянии) и +5 (атомы находятся в возбуждённом состоянии), исключением является фосфор, который может иметь степень окисления +1.
в) Имея три неспаренных р-электрона атомы элементов подгруппы азота в своём основном состоянии проявляют ковалентность равную 3, а в возбуждённом состоянии, кроме атома азота, ковалентность равную 5.
Задача 879. Описать электронное строение Nh4, Nh5+, N2O, HNO3. Какова степень окисленности азота в каждом из этих соединений?Решение:а) Электронная конфигурация валентного слоя атома азота 1s22s22p3. Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
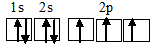
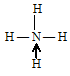
Три неспаренных электрона атома могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s1), имеющими по одному неспаренному электрону, с образованием молекулы Nh4. Электронная формула аммиака имеет вид:
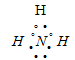

В молекуле аммиака азот имеет свободную электронную пару. Степень окисления азота -3.
б) Связывающая электронная пара атома азота 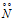 способна с ионом водорода, имеющим свободную атомную орбиталь
способна с ионом водорода, имеющим свободную атомную орбиталь  , образовывать ковалентную связь по донорно-акцепторному механизму. Так образуется катион аммония Nh5+ из молекулы аммиака и иона водорода:
, образовывать ковалентную связь по донорно-акцепторному механизму. Так образуется катион аммония Nh5+ из молекулы аммиака и иона водорода:
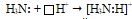
В результате образования донорно-акцепторной связи несвязывающая электронная пара атома азота становится связывающей, образуется четыре связи между одним атомом азота и четырьмя атомами водорода:
Все четыре связи равнозначны и по длине, и по энергии. Степень окисления азота +4.
в) Молекула N2O имеет электронное строение, которое рассматривается как резонансный гибрид двух асимметричных форм, обладающих линейной структурой:
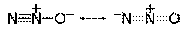
Центральный атом азота имеет две sр-гибридные орбитали. Молекула N2О обладает небольшим дипольным моментом, поэтому оксид диазота умеренно растворим в воде. Степень окисления азота +1.
г) Молекула HNO3 с позиций метода валентных связей имеет следующее строение:
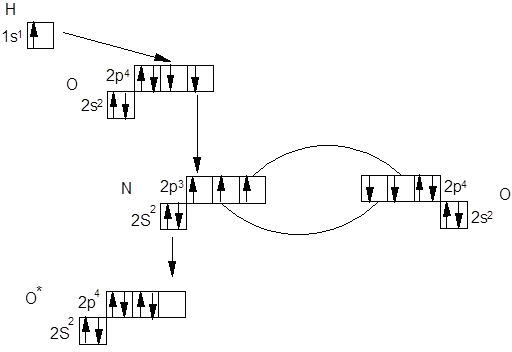
В молекуле HNO3 атом азота с одним атомом кислорода образует двойную связь за счет двух неспаренными электронов азота и кислорода, со вторым атомом кислорода азот образует одну связь за счет третьего неспаренного электрона азота и одного неспаренного электрона атома кислорода, а с третьим атомом кислорода азот образует связь за счет неподеленной электронной пары и свободной р-ячейки атома кислорода, образованной в результате объединения двух неспаренных электронов. Второй атом кислорода образует связь с атомом водорода за счет оставшегося неспаренного электрона и свободного электрона атома водорода. Однако современные методы исследования показали, что строение кислоты таково:
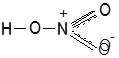
Отсюда видно, что молекула азотной кислоты имеет делокализованные связи. Степень окисления азота +5.
buzani.ru
Возбужденная молекула - азот - Большая Энциклопедия Нефти и Газа, статья, страница 1
Возбужденная молекула - азот
Cтраница 1
Возбужденные молекулы азота могут либо потерять энергию возбуждения ( процесс 8), либо при ударе второго рода передать ее на колебательное возбуждение молекулы кислорода, приводящее к ее диссоциации. [1]
При самовоздействии импульса СО2 - лазера возможен эффект кинетического охлаждения атмосферы за счет индуцированного излучением быстрого перехода поступательной энергии молекул воздуха в колебательную энергию возбужденных молекул азота. [2]
Первый из них - возбуждение молекул азота при столкновениях с электронами. Возбужденные молекулы азота могут либо потерять энергию возбуждения ( процесс 7), либо путем удара второго рода передать ее молекуле кислорода в виде колебательной энергии. Для простоты считают, что при этом молекула кислорода диссоциирует на атомы. [3]
II, показывает, что дезактивация возбужденных молекул азота при столкновениях с молекулами кислорода происходит более часто, чем дезактивация путем излучения. [4]
На рисунке 10.11 представлен спектр полярного сияния. Ионизованные молекулы азота при рекомбинации высвечивают синие и фиолетовые полосы спектра, а возбужденные молекулы азота высвечиваются красным светом. Возбужденные атомы кислорода высвечивают зеленую ( А 0 56 мкм) и красную ( 0 63 мкм) линии. Особенно интенсивными оказываются синие линии азота и зеленая линия кислорода, вследствие чего полярные сияния окрашиваются преимущественно в сине-зеленые тона. [5]
Образование активного азота, несомненно, связано с диссоциацией в электрическом разряде молекул азота на свободные атомы. Однако в явлениях, имеющих место в активном азоте, большую роль играет также образование метастабильных атомов и возбужденных молекул азота, сопровождаемое неупругими соударениями второго рода или спонтанным излучением. Послесвечение тесно связано с возвращением азота в нормальное состояние, но не всегда сопровождает такое возвращение. Наблюдаются стадии, когда все еще активный химически азот не светится. Яркость послесвечения активного азота зависит как от концентрации активного азота, так и от концентрации молекулярного азота, дополнительно введенного в активный. При расширении светящегося активного азота яркость его свечения уменьшается, при сжатии она увеличивается. Как уменьшение, так и увеличение яркости в этом случае почти пропорционально кубу объема газа. [6]
В присутствии азота к рассмотренному механизму добавляются реакции с участием молекул азота. В начале было предположено [118], что такими реакциями являются: электронное возбуждение молекул азота при столкновении с электронами, самотушение азота и тушение возбужденных молекул азота кислородом. [7]
Роль азота проявляется в трех последних процессах. Первый из них - возбуждение молекулы азота при соударении с электроном. Возбужденные молекулы азота могут либо потерять энергию возбуждения ( процесс 8), либо при ударе второго рода передать ее на колебательное возбуждение молекулы кислорода, приводящее к ее диссоциации. [9]
Роль азота проявляется - в трех последних процессах. Первый из них - возбуждение молекулы азота при соударении с электроном. Возбужденные молекулы азота могут либо потерять энергию возбуждения ( процесс 8), либо при ударе II рода - передать ее на колебательное возбуждение молекулы кислорода, приводящее к ее диссоциации. [10]
Кистяковский 7, пользуясь видоизменением того же аппарата, исследовал потенциалы ионизации азота и водорода на железе и других металлах. Он пришел к выводу, что положительная ионизация, наблюдающаяся на железе, меди и платине при 11 и 13 V, принадлежит соответственно адсорбированному азоту и водороду. Кроме того он нашел, что 11-вольтный потенциал для азота относится к возбужденным молекулам азота или атомному азоту, скорее всего к последнему. Впрочем, судя по другим экспериментальным исследованиям адсорбированных газов на металлических поверхностях, кажется невероятным, чтобы азот, адсорбируясь в атомном состоянии, мог сохранять в этом виде свойства газообразного состояния. [11]
В связи с проблемой неравновесного распределения продуктов реакции интересно, по-видимому, напомнить о работе, проведенной Одюбером перед второй мировой войной. Этим объясняется, почему до сих пор так мало физико-химиков берутся за такого рода исследования. Тем не менее Одюбер считает, что большинство химических реакций сопровождается испусканием ультрафиолетового излучения с энергиями в 150 - 160 ккал, что не просто объяснить, основываясь на данных классической химической кинетики. В последнем случае были обнаружены возбужденные молекулы азота, средняя продолжительность жизни которых при нормальном давлении составляла 2 - Ю 3 сек и повышалась до 5 - 10 2 сек при давлении в 2 см рт. ст. Из этой работы следует, что, принимая во внимание наблюдавшиеся за последние годы успехи в раз-питии фотонных счетчиков, было бы весьма желательно вновь вернуться к этому методу изучения химических реакций, особенно быстрых химических реакций. [12]
Как тепловой источник атомов, так и использование вспомогательных реакций дают заметные, но во многих случаях все же слишком малые выходы атомов. Несколько более высокая эффективность образования атомов обеспечивается пропусканием газовой смеси, содержащей распадающиеся молекулы, через электрический разряд. Этот метод более широко применяется, но он дает наряду с атомами целый ряд нежелательных примесей. В лабораторной практике используются стационарные и импульсные, низкочастотные и микроволновые разряды. Электронно-молекулярные столкновения в разряде приводят к диссоциации и ионизации газа, вслед за которыми происходят процессы перезарядки и ион-электронной рекомбинации. Нет полных оснований считать, что в получающейся смеси присутствуют только частицы, нужные экспериментатору; тем не менее этот метод при-меняется довольно часто. Для вытягивания ионов из смеси в качестве ловушки применяют заряженные сетки или удлинение пути от разряда до зоны реакции. В работе [44] дезактивация возбужденных молекул азота осуществлялась пропусканием смеси через стеклянную вату, так как при этом велика эффективная поверхность для столкновений. [13]
Страницы: 1
www.ngpedia.ru
29. Общая характеристика подгруппы азота
Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N) ; фосфор (P) ; мышьяк (As) ; сурьма (Sb) ; висмут (Bi) . Общая электронная формула элементов подгруппы азота: ns2np 3 – на внешнем энергетическом уровне эти элементы содержат пять валентных электронов, на что указывает номер группы – два электрона на s-подуровне и три не-спаренных электрона на р-подуровне. Это р-эле-менты. У каждого последующего нижестоящего атома нарастает энергетический уровень (N – 2s2 2p3; P – 3s2 3p3; As – 4s2 4p3; Sb – 5s2 5p3; Bi – 6s2 6p3), в связи с чем увеличивается радиус атома, уменьшается энергия ионизации, энергия сродства к электрону, электроотрицательность, ослабевают неметаллические свойства – усиливаются металлические.
Характерны следующие степени окисления: N – +1, +2, +3, +4, +5, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3. Характерные валентности: 3, 4, 5.
Азот пятивалентным быть не может – максимальная его валентность равна четырем, т. к. наивысшая валентность равна числу возможных квантовых ячеек на внешнем уровне – у азота их четыре (одна s– и три р-орбитали), следовательно, число ковалентных связей тоже четыре.
Итак, азот в невозбужденном состоянии имеет валентность три, а в возбужденном (при переходе электронов с s-подуровня) – четыре.
У фосфора и всех последующих элементов подгруппы имеется d-подуровень, куда могут переходить электроны с s– и р-подуровней, и в возбужденном состоянии они имеют валентность пять.
Водородные соединения элементов соответствуют формуле: RН3: NН3 – аммиак; РН3 – фосфин; AsН3 – арсин; SbН – стибин; BiН – висмутин. Все соединения – газы, химическая стойкость каждого последующего ослабевает, что связано с ростом порядкового номера элементов, ослабевания неметаллических свойств и усиления металлических.
Кислородные соединения подгруппы азота отвечают составу: R2О3, R2О5 , которые соответствуют кислотам типа: НRО2; НRО3; Н3RO4 – ортокислоты (азот ортокислоты не образует).
Характер оксидов элементов в направлении сверху вниз закономерно изменяется: N2О3, Р2О 3 обладают кислотными свойствами; As2О3, Sb2О3 имеют амфотерные свойства; Bi2О3 – основные свойства. R2О5 образуют только кислотные оксиды и соответствуют кислотам: НRО3, Н3RO4 (кроме азота). Сила кислот НRО3 сверху вниз убывает.
Резкие изменения наблюдаются и у простых веществ элементов подгруппы азота: азот, фосфор, мышьяк – неметаллы; сурьма и висмут – металлы.
30. Аммиак
Физические свойства: аммиак (Nh4) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; при охлаждении до -33,4 °C и нормальном давлении превращается в прозрачную жидкость, при 77,8 °C затвердевает. Массовая доля аммиака в концентрированном растворе – 25 %. Раствор Nh4 в воде – аммиачная вода или нашатырный спирт. Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат Nh4 ? Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода.
Химические свойства:
1) при растворении Nh4 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – Nh5+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию.
2) Nh4 взаимодействует с кислотами: Nh4 + Н2SO4 = Nh5НSO4;
3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2Nh4 = Сu + N2 + 3Н2О;
4) в кислороде Nh4 горит желтым пламенем: 4Nh4 + 3О2 = 2N2? + 6Н2О;
5) кислородом воздуха Nh4 окисляется в присутствии катализаторов: Pt, Cr2O3, Rh: 4Nh4 + 5О2 = 4NО? + 6Н2О;
6) при замещении водорода на металлы образуются амиды: Na + Nh4 = NaNh3 + 1/2 Н2;
7) водород в Nh4 может замещаться на галогены. При действии на раствор хлорида аммония газообразным хлором образуется хлорид азота: Nh5Cl + 3Cl2 = 4HCl + NCl3.
Нашатырь (хлорид азота).
Получение: в промышленности до концаХ1Х века аммиак получали как побочный продукт при коксовании каменного угля, который содержит до 1–2 % азота.
В начале XX века были разработаны новые промышленные способы получения аммиака, основанные на связывании или фиксации атмосферного азота.
В 1904 году появился циамидный способ, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция, образуя циамид кальция CaCN2, который при воздействии с водяным паром при давлении 0,6 МПа легко разлагается на аммиак и карбонат кальция:
Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия. Этими условиями явились высокое давление и низкая температура, использование катализаторов – губчатого железа с добавками активаторов (оксиды алюминия, калия, кальция, кремния, магния).
studfiles.net
Валентные состояния азота - Справочник химика 21
В отдельности растворенные перманганат калия и нитрит натрия могут храниться долгое время без изменения, следовательно, наблюдаемая реакция обусловлена двумя взаимосвязанными переходами, в результате которых изменяется степень окисления (валентное состояние) азота и марганца [c.325]
По-видимому, ионы МОг претерпевают превращение, в результате которого они отдают электроны и переходят в ионы с более. .. (высоким, низким) валентным состоянием азота. Такими ионами могут быть только ионы. ... [c.138]
В основном валентном состоянии азот может образовать три ковалентные связи, но тогда 2з -электронная пара остается неподеленной. В отличие от фосфора и остальных элементов 15-й группы, у которых возможно разрушение пз -неподеленной пары и [c.287]
При восстановлении амальгамированным цинком не мешают сульфаты, перхлораты и хлориды. Борная и борофтористоводородная кислоты также не мешают восстановлению. Нитраты и нитриты частично восстанавливаются до соединений с более низкими валентными состояниями азота, в том числе и до гидроксиламина, которые при последуюш ем титровании растворами окислителей способны окисляться и тем самым вызывать ошибку определения урана. [c.79]
Рассмотрим структуру аммиака. Если бы эта молекула возникала из атома азота в его основном состоянии (15)2(25)2(2/ ) , то валентные углы должны были бы составлять 90° (связи образованы посредством чистых р-орбит). В реальной структуре валентные углы близки к тетраэдрическим, так что атом азота, по-видимому, образует связи посредством гибридных 5рЗ-орбит и неподеленная пара электронов занимает одну из таких орбит. В соответствующем валентном состоянии азота пять валентных электронов занимают гибридные орбиты, каждая из которых является на одну четверть 25-орбитой и на три четверти 2р-орбитой. Такое состояние можно записать в виде sf что соответствует возбуждению от 25-электрона на 2р-уровень. Поэтому тетраэдрическая структура аммиака сама по себе менее устойчива, чем структура с взаимно перпендикулярными связями. Однако это отличие больше, чем отличие в нестабильности, обусловленное взаимным отталкиванием несвязанных атомов водорода, которые в перпендикулярной структуре оказываются гораздо ближе друг к другу. При превращении аммиака в ион аммония присоединением протона тетраэдрическая геометрия азота сохраняется и дальнейшего изменения энергии возбуждения не происходит. [c.175]
Изменение валентного состояния азота в молекуле хинальдина и сопутствующее ему повышение подвижности водорода метильной группы служат причиной необычного соотношения скоростей дейтерообмена с амфотерным и протофильным растворителями— со спиртом и аммиаком [8]. Обычно константа скорости обменной реакции с участием жидкого аммиака на 4— 6 порядков больше константы скорости реакции в спиртовом растворе (стр. 39). Однако в опытах с хинальдином (а также с а-пиколином) обмен водорода в спиртовом растворе совершается на порядок быстрее, чем с жидким аммиаком. Это может быть объяснено образованием водородной связи между атомом [c.54]
Таким образом, подвижность атомов водорода метильной группы хинальдина, количественно оцениваемая нри помощи водородного обмена, зависит от валентного состояния азота гетероцикла. Его можно изменять не скачком, как того требует теория Бренстеда, а постепенно, папример последовательно, повышая степень полярности водородной связи и, наконец, превращая гетероцикл в соль четвертичного аммониевого основания. [c.366]
Из сказанного о валентных состояниях азота, кислорода и фтора следует, что эти атомы не возбуждаются при соединении с другими атомами. В отличие от них их аналоги фосфор, сера и хлор — могут вступать в соединения в возбужденном состоянии. Действительно, валентные электроны этих атомов расположены на третьем энергетическом уровне, на котором кроме одной 5- и трех р-орбит имеются еще пять свободных -орбит, так что при возбуждении, например, атома фосфора один из его 3 -электронов переходит на 3 -орбиту. Поскольку эта орбита принадлежит тому же энергетическому уровню, на возбуждение не потребуется затраты большого количества энергии. В возбужденном состоянии атом фосфора будет иметь 5 непарных электронов. Фосфор, следовательно, может выступать как трехвалентный элемент (в нормальном состоянии) и как пятивалентный элемент (в возбужденном состоянии). [c.100]
Анион бензил образуется при добавлении еще одного я-электрона в бензильный радикал, при этом не возникает ни одной дополнительной 0-связи. Что касается анилина, то здесь необходимо предварительно уточнить вопрос о валентном состоянии азота в ЫНг-группе. Если валентное состояние имеет электронную конфигурацию (2з) (2рж) (2р ) (2рг), то азот может образовать три а-связи за счет своих чистых р-кО. Неподеленная пара находится на 2в-орбитали и неспособна к взаимодействию с системой я-электронов [c.84]
СНз)зМ—О), или б) вследствие отдачи электрона, как в ионах аммония. Такая потеря электрона дает конфигурацию валентного состояния азота (в виде Ы+) с четырьмя неспаренными электронами на А р -гибридных орбиталях, аналогичных орбиталям нейтрального атома углерода, в то время как (что уже отмечено выше) присоединение электрона (например, в МНг) оставляет для образования связи только два электрона. В этом случае атом азота (в виде Ы ) [c.156]
ВАЛЕНТНЫЕ СОСТОЯНИЯ АЗОТА [c.11]
Затем он просит назвать новые функциональные группы — нитро-, амино-, диазо- и азофункциональные группы. Учащиеся должны определить валентное состояние азота в этих функциональных группах (в нитрогруппе азот пятивалентен, в аминогруппе — трехвалентен, в диазогруппе один атом азота трехвалентен, а второй — пятивалентен кроме того, в этой функциональной группе тройная связь между атомами азота в азосоединенрях оба атома азота трехвалентны и между ними двойная связь). [c.135]
Внутри аминогруппы также существует соответствующее взаимовлияние, взаимодействие (противоречие) между составляющими ее атомами. Это обусловливается, во-первых, различной электроотрицательностью атомов водорода и азота, а значит, и полярностью образуемой ими связи, во-вторых, наличием неподеленной пары электронов у атома азота, которая несет в себе две противоположные тенденции. С одной стороны, эта пара электроно1В может образовывать координационную (биполярную — внутримолекулярную) связь с ионом водорода гидроксильной группы, оттягивая его на себя, с другой стороны, за счет этой пары группа Nh3 может вступать в различные реакции. Этими различиями между азотом и водородом в аминогруппе объясняется разнообразие ее реакций (замещение водорода на другие группы, образование солей и окисление аминов до спиртов, сопровождающиеся изменением валентного состояния азота с +3 до +5 за счет неподеленной пары электронов). [c.131]
Данные таблицы 18 показывают, что максимальное число неспаренных электронов, а соответственно и высшая валентность элемента равны номеру группы, в которой он находится. Исключениями являются фтор Р, 1шслород О и азот К, атомы которых не могут переходить в возбужденное состояние. (Характер химических связей и валентное состояние азота в соединениях типа НзО , ННОз и др., где азот формально пятивалентен, будут рассмотрены в следу-юш ем параграфе.) [c.126]
chem21.info














