Тема 4. Ацетиленовые углеводороды. Физические свойства ацетилена
Физические свойства ацетилена
Ацетилен газ со слабым чесночным запахом, конденсируется в жидкость при температуре84С и давлении 62 атм.
Смеси ацетилена с воздухом взрывоопасны. Жидкий ацетилен взрывает при попадании в него пыли.
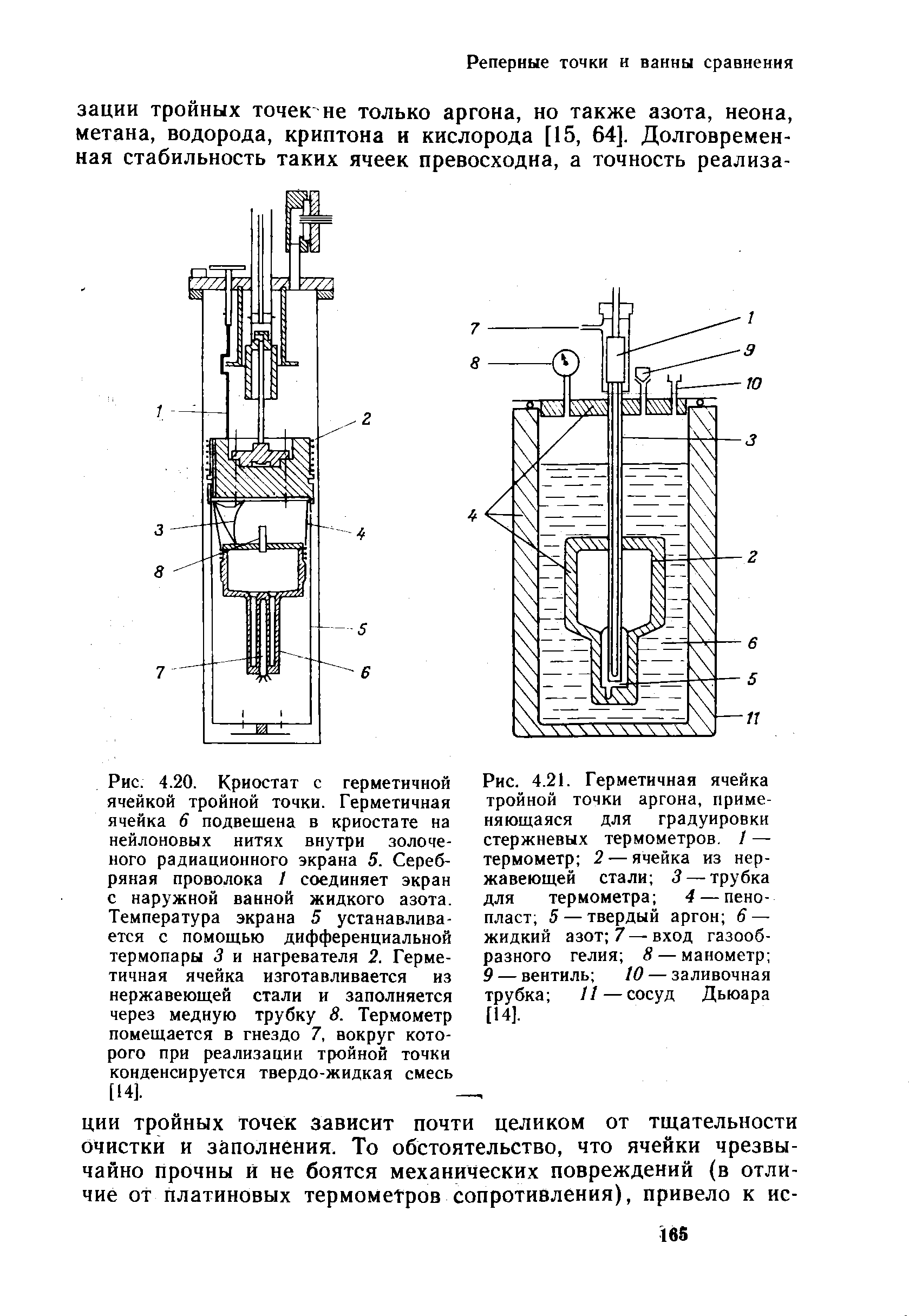
Хранят и транспортируют ацетилен либо в адсорбированном состоянии на активированном угле, либо в растворах карбонильных соединений. 1 объем ацетона поглощает 25 объемов ацетилена (при нормальных условиях). Перевозят ацетилен в баллонах заполненных активированным углем. Ацетилен легко разлагается на углерод и водород при нагревании.
Химические свойства
Реакции присоединения
Водород на катализаторах гидрирования восстанавливает алкины до алканов.
Чтобы остановить реакцию на стадии образования алкенов используют специальные добавки к катализаторам благородной группы:
Из химических восстановителей используют гидриды.
В отличии от гидрирования каталитического, которое приводит к образованию цис-алкенов, химические восстановители даюттранс-алкены.
В настоящее время в промышленности применяют жидкие гидриды алюминия:
(RO)2AlHжидкость светло-желтого цвета,
R=C4H9.
Метод широко используется в промышленности для получения хлорвинила, дихлорэтана, тетрахлорэтилена и других хлорпроизводных.
Реакция протекает по электрофильному механизму:
Реакция применяется для синтеза тетрахлорэтилена. В промышленности получают всевозможные продукты с применением влажной окиси или гидроокиси Caагенты мягкого отщепленияHX(дегидрогалогенирующие реагенты).
Для получения тетрахлорэтилена применяют двухстадийный метод:
Присоединение хлора к ацетиленам протекает очень бурно, безопасное хлорирование можно проводить в растворе переносчика хлора:
[SbCl5·Cl2HCCCl3]комплекс пятихлористой сурьмы с пентахлорэтаном.
Реакции нуклеофильного присоединения к ацетиленам
Вода относится к нейтральным нуклеофилам.
Механизм реакции:
Активирование ацетилена комплексом со ртутью
Спирты несколько более сильные нейтральные нуклеофилы, чем вода:
.
Реакция присоединения спиртов к ацителенам называется винилированием спиртов:
Виниловые эфиры устойчивая форма существования виниловых спиртов (енолов).
Некоторые свойства виниловых эфиров
Виниловые эфиры более реакционоспособны в реакциях электрофильного присоединения [AE], чем этилены.
Алкоксигруппа благодаря сопряжению вызывает значительное увеличение электронной плотности на двойной связи, что способствует легкости образования -комплекса с электрофильными реагентами.
Так например, реакция с бромом протекает с количественным выходом:
В присутствии кислот виниловые эфиры могут полимеризоваться по катионному механизму:
ПВБЭ, так называемый бальзам Шостаковского, обладает антисептическими свойствами, является заменителем пенициллинов.
ПВА используется в качестве лаков и клеев; при гидролизе полвинилацетата образуется поливиниловый спирт:
Поливиниловый спирт незаменим для приготовления лаков и эмалей.
Все производные акриловой кислоты находят широкое применение в качестве полимерных материалов с индивидуальными свойствами. Например, полиакриламид используется в качестве синтетического клея, а метилметакрилат – органического стекла.
Проводят смесью серной и азотной кислот с целью получения тетранитрометана.
В условиях реакции динитроуксусный альдегид окисляется, декарбоксилируется и донитровывается:
- Линейная полимеризация
Может проходить как димеризация или тримеризация:
Винилацетилен используют в промышленности для получения хлоропрена.
В присутствии ацетиленида меди ацетилен образует вещество купрен:
Если использовать карбонил железа в качестве катализатора, то можно получить даже циклооктатетраен:
ИсетьТехГаз - технические газы - Ацетилен
Общие сведения

Ацетилен — ненасыщенный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. В природе на Земле практически не встречается, т.к. из-за присутствия кислорода это крайне неустойчивое соединение, получается путем синтеза. Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Впервые газообразный ацетилен получил в 1836 г. Эдмунд Дэви при разложении водой карбида калия, полученного при сплавлении металлического калия с углем: К2С2 + 2Н2О = С2Н2 + 2КОН.
С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (CaC2 + 2h3O = C2h3 + Ca(OH)2, который в свою очередь получали прокаливанием смеси угля и негашеной извести (СаО + 3С = СаС2 + СО), этот газ стали использовать для освещения. В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Физические свойства
При нормальных условиях — бесцветный газ, запах которого напоминает запах чеснока, малорастворим в воде, легче воздуха. Чистый ацетилен при охлаждении сжижается при -83,8°С, а при дальнейшем понижении температуры быстро затвердевает. Он умеренно растворим в воде (1150 мл в 1 л воды при 15°С и атмосферном давлении) и хорошо в органических растворителях, особенно в ацетоне (25 л в 1 л ацетона при тех же условиях и 300 л под давлением 12 атм). Термодинамически ацетилен неустойчив: он взрывается при нагревании до 500° С, а при обычной температуре - при повышении давления до 2 атм. Поэтому его хранят в баллонах, наполненных пористым инертным материалом, который пропитан ацетоном.
Химические свойства
Для ацетилена (этина) характерны реакции присоединения, димеризации, полимеризации, цикломеризации.
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м3. При сгорании температура пламени достигает 3300°С (5972 °F). Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди. Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция , а также при дегидрировании двух молекул метана при температуре свыше 1400°C.
Применение
Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с газами — с кислородом и с ацетиленом. Газы из баллонов поступают в специальную горелку. При сгорании ацетилена в кислороде получается очень горячее пламя; максимальная его температура (3200° С) достигается при содержании ацетилена 45% по объему. В таком пламени очень быстро расплавляются даже толстые куски стали.
Как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (карбидка).
Ацетилен может служить исходным продуктом для синтеза многих более сложных органических соединений. Эта область применения ацетилена в настоящее время является самой обширной. Ацетилен - реакционноспособное соединение, вступающее в многочисленные реакции. Химия ацетилена богата. Из него можно получить сотни разнообразных соединений.
Он используется в производстве взрывчатых веществ (ацетилениды), для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Преимущества ацетилена при газопламенной обработке металлов
Применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и тд.). Однако, преимущество ацетилена – в самой высокой температуре горения, которая достигает 3200 ° С. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
Сравнительные характеристики пламени при сварке различным газами
| Газ | Температура пламени, °C |
| Ацетилен | 3000 - 3200 |
| МАФ | 2930 |
| Пропан | 2600-2750 |
| Водород | 2100-2500 |
| Метан | 2000-2200 |

Хранение и перевозка ацетилена
Хранят и перевозят ацетилен в заполненных инертной пористой массой (древесным углем или литой пористой массой) стальных баллонах белого цвета (с красной надписью «АЦЕТИЛЕН») в виде раствора в ацетоне под давлением 1,5-2,5 МПа. Растворенный ацетилен в баллонах перевозят всеми видами транспорта в соответствии с правилами перевозки опасных грузов, действующими на данном виде транспорта.
Опасные факторы и меры безопасности
Ацетилен - взрывоопасный газ. С воздухом образует взрывоопасную смесь. Температура самовоспламенения ацетилена 335°С. Температура воспламенения ацетилено-воздушных смесей 305-470°С, ацетилено-кислородных 297-306°С,
При хранении ацетилена и его применении необходимо заботиться о достаточной вентиляции и учесть правила классификации электрооборудования. Открытое пламя и курение категорически запрещены.
Ацетилен обладает слабым токсическим действием. При длительном вдыхании технического ацетилена появляется рвота и головокружение.
Ацетилен взрывоопасен при следующих условиях:
- при нагреве до 450-500°С и одновременном повышении давления от 1,5 –2,0 атмосфер ацетилен взрывается без внешнего источника воспламенения;
- в смеси с воздухом, если в воздухе содержится ацетилена в пределах от 2,3–80,7% по объему;
- в смеси с кислородом, если ацетилена содержится в пределах от 2,3-93% по объему;
- ацетилено-воздушные и ацетилено-кислородные смеси взрываются при наличии искры, открытого огня, нагретой поверхности или какого-либо другого источника воспламенения.
- при длительном соприкосновении ацетилена с красной медью и серебром образуются взрывчатые соединения, которые взрываются при ударе и повышении температуры;
- при контакте с водой ацетилен способен образовывать твердый кристаллогидрат, представляющий собой кристаллическое вещество белого цвета, напоминающий снег или лед.
Все применяемые материалы, в т.ч. неметаллические части, как, например, заглушки вентилей, прокладки и мембраны должны обладать стойкостью к ацетилену и его растворителям.
Ацетиленовая проводка должна быть стальной. Детали, изготовленные из серебра, меди или сплава, содержащего более 65% меди, нельзя применять из-за опасности образования взрывоопасных соединений меди и ацетилена.
it-gas.ru
Тема 4. Ацетиленовые углеводороды
ПЛАН
4.1. Номенклатура углеводородов ряда ацетилена.
4.2. Физические свойства ацетиленовых углеводородов.
4.3. Способы получения.
4.4. Химические свойства.
4.1. Номенклатура углеводородов ряда ацетилена
Алкинами называются ненасыщенные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов СnН2n-2.
По номенклатуре ИЮПАК наличие тройной связи в молекуле обозначается суффиксом -ин, который заменяет суффикс -ан в названии соответствующего алкана.
Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи.
4.2. Физические свойства ацетиленовых углеводородов
Физические свойства. По физическим свойствам алкины напоминают алканы и алкены. Низшие алкины C2-C4 представляют собой газы, С5-C16 – жидкости, высшие алкины – твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов.
4.3. Способы получения
2. Важнейший из алкинов – ацетилен – получают в промышленности путем высокотемпературного крекинга метана:
В лаборатории ацетилен можно получить гидролизом карбида кальция:
4.4. Химические свойства
Тройная связь образуется двумя атомами углерода в sp-гибридном состоянии. Две s -связи расположены под углом 180°, а две p -связи расположены во взаимно перпендикулярных областях. Наличие p -связей обусловливает способность алкинов вступать в реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p -электронная плотность тройной связи расположена более комплексно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 – сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера – поливинилхлорида:
3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (П) (реакция Кучерова):
На первой стадии реакции образуется непредельный спирт, в котором гидроксогруппа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой большинства енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом p -связь между атомами углерода разрывается и образуется p -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С = О по сравнению с двойной связью С = С.
В результате реакции гидратации только ацетилен превращается в альдегид, гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. Так, пропин превращается в ацетон:
4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т, е, проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s -связи º С–Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами.
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и Nh5Cl ацетилен димеризуется, давая винилацетилен:
Винилацетилен обладает большой реакционноспособностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:
6. Реакции окисления и восстановления. Алкины окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты:
В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
Применение. Ацетилен применяется в качестве исходного сырья для многих промышленных химических синтезов. Из него получают уксусную кислоту, синтетический каучук, поливинилхлоридные смолы. Тетрахлорэтан СНСl2–CHCl2 – продукт присоединения хлора к этилену – служит хорошим растворителем жиров и многих органических веществ и, что очень важно, безопасен в пожарном отношении. Ацетилен используют для автогенной сварки металлов.
studfiles.net
Урок-конспект "Ацетилен, его строение, свойства, получение, применение."
Урок « Ацетилен, его строение, свойства, поучение, применение. Гомологический ряд ацетилена. Изомерия.»
Цели урока:
познакомиться с гомологическим рядом, номенклатурой, и изомерией непредельных углеводородов ряда ацетилена;
рассмотреть физические и химические свойства на основе ранее полученных знаний о кратной связи и логической цепочки « состав – строение - свойства»;
выяснить области применения представителей данного класса органических веществ;
закрепить полученные знания.
Задачи урока:
Формирование представлений о химических свойствах ацетилена и его гомологов на основе строения.
Формирование информационно-коммуникативных компетенций учащихся при поиске информации, при работе с разными источниками информации.
Совершенствование умений и навыков учащихся в написании изомеров непредельных углеводородов, в составлении уравнений химических реакций для ацетилена и его гомологов.
Тип урока: комбинированный
Оборудование:
Шаростержневая модель молекулы ацетилена
Раздаточный материал по теме «Углеводороды»
Интернет-ресурсы;
презентация
Ход урока
I.Организационный момент: объявление темы, целей и задач урока. II. Изучение темы урока по плану:
Состав: общая формула, простейшие представители данного класса, номенклатура соединений.
Особенности строения: наличие тройной (кратной) связи, тип гибридизации.
Изомерия молекул и ее виды.
Свойства веществ: физические и химические.
Применение.
Подведение итогов урока, выставление оценок.
Домашнее задание.
II. Изучение новой темы.
1. Алкины – это непредельные (ненасыщенные) углеводороды, с одной тройной углерод - углеродной связью С≡С в цепи и общей формулой Сnh3n-2
2. Строение. Состав алкинов.
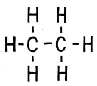
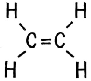
C2H6 C2h5 C2h3
На доске записаны формулы углеводородов. Чем они отличаются? Числом атомов водорода.
Первая формула принадлежит этану (предельному углеводороду), вторая этилену (непредельному углеводороду), а третья принадлежит еще более ненасыщенному соединению – ацетилену. Давайте составим структурные формулы этих углеводородов.
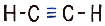
Сn h3n+2
Cnh3n
Cnh3n-2
Ацетилен еще более ненасыщенный угеводород, чем этан и этилен..
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2h3
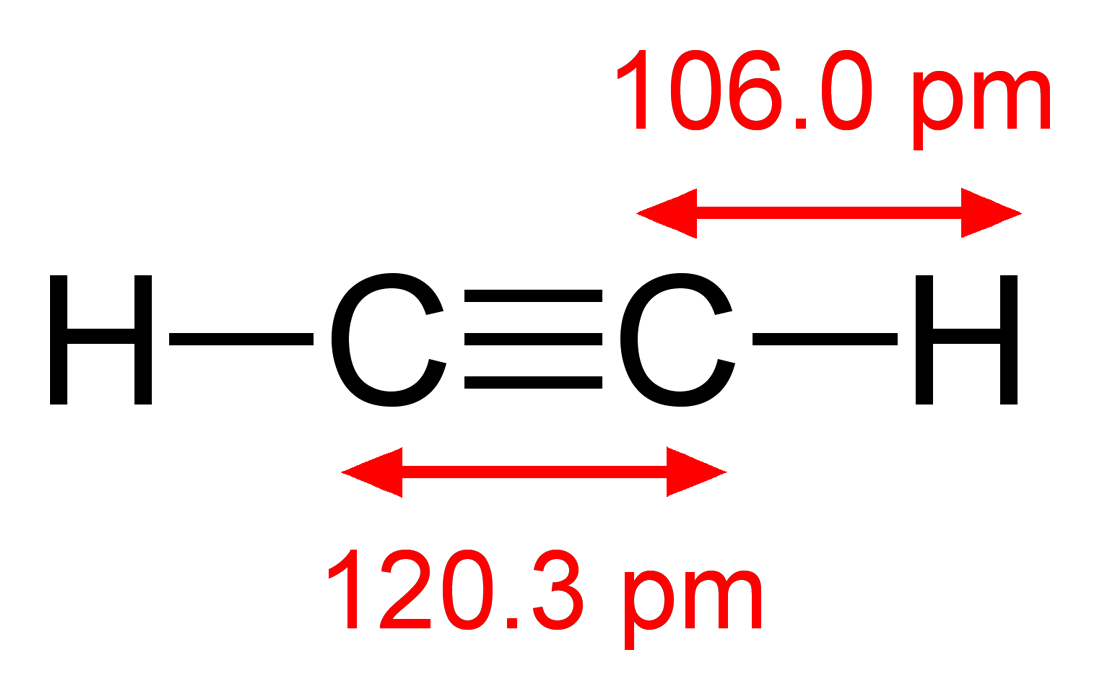
Структурная формула ацетилена H–C≡C–H
Электронная формула H : С : : : С : Н
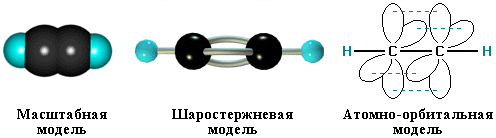
Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s- и p-орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s-орбиталями атомов H, и между ними и атомами С тоже образуются σ -связи.
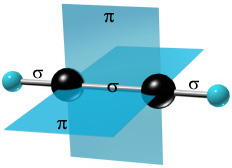
Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ - и двух π -связей.
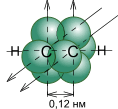
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.

Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p-орбитали взаимно перекрываются, и образуются две π -связи, которые относительно непрочные и в химических реакциях легко разрываются.
Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ - и двух π -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
Запомните!
1. Длина связи 0,12 нм
2. Угол 180
3. Линейная молекула
4. Связи – σ и 2π
5. Sp- гибридизация
3. Физические свойства
С2Н2 – Ацетилен – бесцветный газ, легче воздуха, с резким запахом, малорастворим в воде,
4. Изомерия и номенклатура
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):

2. Составить все возможные изомеры гексина.
3. Построить следующие структурные формулы алкенов:
а) 3метил пентин-1, б) 4,4диметил пентин-2, в) 2,5диэтилгексин-3
5.Химические свойства алкинов
1). Горение. Ацетилен горит светящимся пламенем и образует много копоти. Чем больше в горящем веществе углерода и чем меньше водорода, тем больше коптящего пламени получается. Часть углерода просто не успевает перевариться в углекислый газ и дает частицы сажи от которых пламя становиться светящимся.
2 С2Н2 + 5 О2 = 4СО2 + 2 Н2О
Реакции присоединения
2). Галогенирование
(как и алкены обесцвечивают бромную воду!)
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан)
3). Гидрогалогенирование
* Ch4-C≡CH + HBr AlBr3→ Ch4-CBr=Ch3
2-бромпропен
* - используется пр. Морковникова
4). Полимеризация
В определенных условиях ацетилен способен полимеризоваться в бензол. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
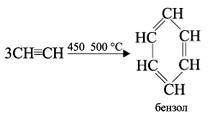
Получение ацетилена.
Ацетилен химически активен, поэтому в природе не встречается. Его получают:
1. Из метана, тo есть основного компонента природного газа: 2СН4 → С2Н2+ 3h3
2.Ацетилен в лаборатории получают карбидным способом. В карбид кальция наливают дистиллированную воду и опускают газоотводную трубку в перманганат калия. Раствор обесцвечивается. CaC2 + 2h3O → Ca(OH)2 + C2h3↑
Применение ацетилене.
Для сварки и резки металлов.
Из ацетилена поучают полихлорвинил из которого изготавливают новогодние искусственные елочки, искусственные кожи , клеенки, линолиум.
Ацетилен дешевое химическое сырье, из которого получают пластмассы, каучуки, резину, химические волокна.
Переработав ацетилен можно получить этиловый спирт, уксусную кислоту, растворители, ароматические углеводороды.
Обобщение и закрепление знаний: Закончите следующие фразы:
1 Алкины - это…
2. Общая формула алкинов…
3 Простейший алкин…
4. Связь в молекуле ацетилена между углеродными атомами…
5. Физические свойства ацетилена…
6. Характерные химические реакции алкинов…
7. Ацетилен применяется для…
Осуществить превращения:
Метан → Ацетилен → Этилен → Этан → Хлорэтан
Задание на дом: § 16, Составить кроссворд по теме « Алкины», ацетилен.
infourok.ru
Ацетилен

C2h3 – химическая формула ацетилена.
Чистый ацетилен – газ, не имеющий цвета и запаха; использующийся в технологическом процессе обладает едким запахом.
Температура затвердевания = -83 C. В твердом состоянии не используется, так как взрывоопасен.
Для полного сгорания 1 объема ацетилена необходимо 2,5 объема кислорода.
Сгорание происходит по следующей химической реакции:
C2h3 + 2,5O2 = 2CO2 + h3O
Основные свойства ацетилена:
1. Хорошая растворимость в ацетоне.
В 1 л ацетона растворяется 20 л ацетилена, при этом растворимость увеличивается пропорционально давлению. Данное свойство используется при закачке ацетилена в баллоны.
2. При длительном соприкосновении с медью в присутствии влаги, образуется взрывоопасное вещество – ацетиленид меди.
3. При повышении температуры и давления, ацетилен взрывается, причиной этому является процесс полимеризации, то есть соединения молекул ацетилена с образованием таких веществ как бензол (C6H6), нафталин (C10H8) и стирол (C8H8).
Этот процесс сопровождается выделением большого количества тепла, что приводит к взрыву ацетилена.
Получение ацетилена (в растворенном состоянии).
Получают двумя способами:
- Из карбида кальция путем воздействия на него водой.
- Из углеводородосодержащих газов.
Карбид кальция – вещество серого цвета в разломе, удельный вес состовляет 2,2 г/см3, получают его путем спекания негашеной извести (CaO) с углеродом при температуре 1900-2000 C.
Химическая формула процесса получения карбида кальция:
CaO + 3C = CaC2 + CO
После расплавления карбид выливают в изложницы.
После затвердевания производится дробление карбида на следующие фракции:
>= 2, 2/8, 8/15, 15/25, 25/80.
После этого карбид укладывается в жестяные барабаны, которые плотно закрывают, так как карбид очень гигроскопичен (поглощает водяные пары из воздуха)
Ацетилен из карбида получают по следующей реакции, при этом используют ацетиленовые генераторы:
CaC2 + h3O = C2h3 + Ca(OH)2
Газообразный ацетилен хранится в стальных баллонах под давлением 1,9 МПа или 19 кгс/см2.
При этом ацетилен в баллоне находится в растворенном состоянии.
Перед закачкой ацетилена в баллон помещается пористая масса (чаще всего активированный уголь): 280 г активированного угля на 1л объема баллона и 300-320 г ацетона.
Вся аппаратура для транспортировки и хранения газа выполнена из стали.
Ацетиленовый баллон – белый с красной надписью.
Также по теме:svarder.ru
Ацетилен — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
| Ацетилен | |
 | |
  | |
| Систематическоенаименование | Этин |
| Традиционные названия | Ацетилен |
| Хим. формула | C2h3 |
| Молярная масса | 26,038[1] г/моль |
| Плотность | 1,0896 г/л |
| Т. плав. | -80,8 1277 мм Hg °C |
| Т. кип. | −83,6 °C |
| Тройная точка | −80,55 |
| Кр. точка | 35,2°С; 6,4 МПа |
| Мол. теплоёмк. | 44,036 Дж/(моль·К) |
| Энтальпия образования | -227,4 кДж/моль |
| pKa | 25 |
| Растворимость в воде | 10018 мл/100 мл |
| Растворимость в этаноле | 60018 мл/100 мл |
| Гибридизация | sp |
| Рег. номер CAS | 74-86-2 |
| SMILES |
[chemapps.stolaf.edu/jmol/jmol.php?model=C%23C C#C] |
| Номер ООН | 1001 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Ацетиле́н (по ИЮПАК — этин) — непредельный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. При нормальных условиях — бесцветный газ.
Получение
В лаборатории
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция[2] (Ф. Вёлер, 1862 год),
<math>\mathsf{CaC_2 + 2H_2O \rightarrow Ca(OH)_2 + C_2H_2\uparrow}</math>а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
<math>\mathsf{2CH_4 \rightarrow C_2H_2 + 3H_2}</math>В промышленности
В промышленности ацетилен получают из карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом. Карбидный метод позволяет получать чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз менее энергозатратен, но образующийся ацетилен имеет низкую концентрацию в газовом потоке и требует выделения. Экономические оценки обоих методов многочисленны, но противоречивы[3][:стр. 274].
Получение пиролизом
Электрокрекинг
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500—3000 °С:
<math>\mathsf{CaO + 3C \rightarrow CaC_2 + CO}</math>Известь получают из карбоната кальция:
<math>\mathsf{CaCO_3 \rightarrow CaO + CO_2}</math>Далее карбид кальция обрабатывают водой:
<math>\mathsf{CaC_2 + 2H_2O \rightarrow C_2H_2 + Ca(OH)_2}</math>Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Физические свойства
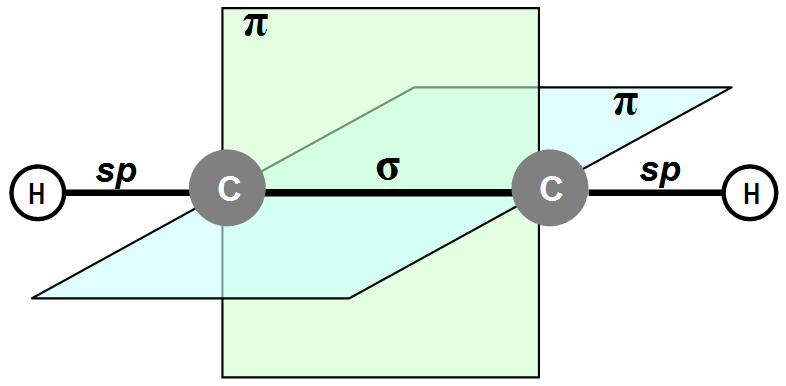 При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах[4]. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[5]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[6].
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах[4]. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[5]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[6].
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа[7] при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[8].
Ацетилен обнаружен на Уране и Нептуне.
Химические свойства
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> ClCH=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в ~500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60-70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
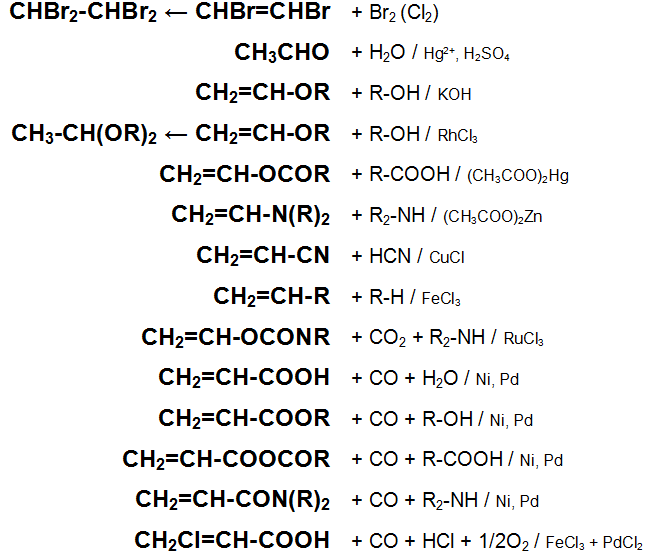
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
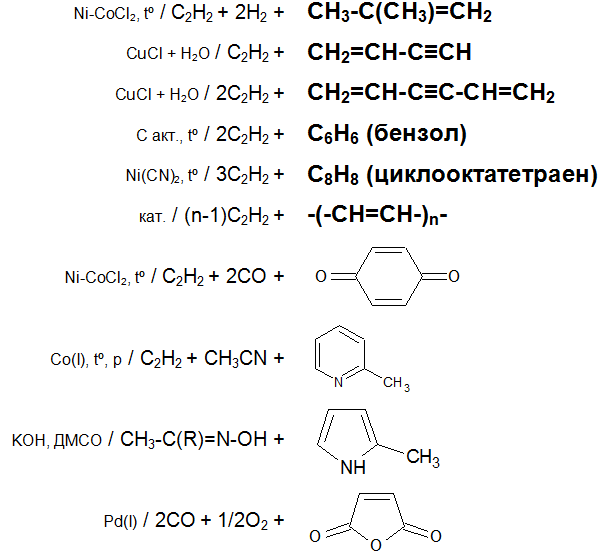
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
История
Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
Применение
 Ацетилен используют:
Ацетилен используют:
- для газовой сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях (вместе с аммиаком)[9]
Безопасность
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5—100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углём) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5—2,5 МПа.
Напишите отзыв о статье "Ацетилен"
Примечания
- ↑ [protect.gost.ru/document.aspx?control=7&id=162285 ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия]
- ↑ [www.youtube.com/watch?v=6ei5LGn165M Видео данного процесса]
- ↑ Лапидус А. Л., Голубева И. А., Жагфаров Ф. Г. Газохимия. Учебное пособие. — М.: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1.
- ↑ [www.ngpedia.ru/id31656p1.html Большая энциклопедия нефти и газа. Неприятный запах — ацетилен]. Проверено 10 октября 2013.
- ↑ Корольченко. Пожаровзрывоопасность веществ, 2004, с. 198.
- ↑ Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72.
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- ↑ [www.it-gas.ru/acetilen.html Ацетилен]. Проверено 10 октября 2013.
- ↑ [www.izvestia.ru/news/523787 В России разработали ракетный двигатель на аммиаке — Известия]
Литература
- Миллер С. А. Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969. — Т. 1. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
Ссылки
Отрывок, характеризующий Ацетилен
– Ты подожди лучше, когда замуж выйдет… – Ты знаешь, – сказал Анатоль, – j'adore les petites filles: [обожаю девочек:] – сейчас потеряется. – Ты уж попался раз на petite fille [девочке], – сказал Долохов, знавший про женитьбу Анатоля. – Смотри! – Ну уж два раза нельзя! А? – сказал Анатоль, добродушно смеясь.Следующий после театра день Ростовы никуда не ездили и никто не приезжал к ним. Марья Дмитриевна о чем то, скрывая от Наташи, переговаривалась с ее отцом. Наташа догадывалась, что они говорили о старом князе и что то придумывали, и ее беспокоило и оскорбляло это. Она всякую минуту ждала князя Андрея, и два раза в этот день посылала дворника на Вздвиженку узнавать, не приехал ли он. Он не приезжал. Ей было теперь тяжеле, чем первые дни своего приезда. К нетерпению и грусти ее о нем присоединились неприятное воспоминание о свидании с княжной Марьей и с старым князем, и страх и беспокойство, которым она не знала причины. Ей всё казалось, что или он никогда не приедет, или что прежде, чем он приедет, с ней случится что нибудь. Она не могла, как прежде, спокойно и продолжительно, одна сама с собой думать о нем. Как только она начинала думать о нем, к воспоминанию о нем присоединялось воспоминание о старом князе, о княжне Марье и о последнем спектакле, и о Курагине. Ей опять представлялся вопрос, не виновата ли она, не нарушена ли уже ее верность князю Андрею, и опять она заставала себя до малейших подробностей воспоминающею каждое слово, каждый жест, каждый оттенок игры выражения на лице этого человека, умевшего возбудить в ней непонятное для нее и страшное чувство. На взгляд домашних, Наташа казалась оживленнее обыкновенного, но она далеко была не так спокойна и счастлива, как была прежде. В воскресение утром Марья Дмитриевна пригласила своих гостей к обедни в свой приход Успенья на Могильцах. – Я этих модных церквей не люблю, – говорила она, видимо гордясь своим свободомыслием. – Везде Бог один. Поп у нас прекрасный, служит прилично, так это благородно, и дьякон тоже. Разве от этого святость какая, что концерты на клиросе поют? Не люблю, одно баловство! Марья Дмитриевна любила воскресные дни и умела праздновать их. Дом ее бывал весь вымыт и вычищен в субботу; люди и она не работали, все были празднично разряжены, и все бывали у обедни. К господскому обеду прибавлялись кушанья, и людям давалась водка и жареный гусь или поросенок. Но ни на чем во всем доме так не бывал заметен праздник, как на широком, строгом лице Марьи Дмитриевны, в этот день принимавшем неизменяемое выражение торжественности. Когда напились кофе после обедни, в гостиной с снятыми чехлами, Марье Дмитриевне доложили, что карета готова, и она с строгим видом, одетая в парадную шаль, в которой она делала визиты, поднялась и объявила, что едет к князю Николаю Андреевичу Болконскому, чтобы объясниться с ним насчет Наташи. После отъезда Марьи Дмитриевны, к Ростовым приехала модистка от мадам Шальме, и Наташа, затворив дверь в соседней с гостиной комнате, очень довольная развлечением, занялась примериваньем новых платьев. В то время как она, надев сметанный на живую нитку еще без рукавов лиф и загибая голову, гляделась в зеркало, как сидит спинка, она услыхала в гостиной оживленные звуки голоса отца и другого, женского голоса, который заставил ее покраснеть. Это был голос Элен. Не успела Наташа снять примериваемый лиф, как дверь отворилась и в комнату вошла графиня Безухая, сияющая добродушной и ласковой улыбкой, в темнолиловом, с высоким воротом, бархатном платье. – Ah, ma delicieuse! [О, моя прелестная!] – сказала она красневшей Наташе. – Charmante! [Очаровательна!] Нет, это ни на что не похоже, мой милый граф, – сказала она вошедшему за ней Илье Андреичу. – Как жить в Москве и никуда не ездить? Нет, я от вас не отстану! Нынче вечером у меня m lle Georges декламирует и соберутся кое кто; и если вы не привезете своих красавиц, которые лучше m lle Georges, то я вас знать не хочу. Мужа нет, он уехал в Тверь, а то бы я его за вами прислала. Непременно приезжайте, непременно, в девятом часу. – Она кивнула головой знакомой модистке, почтительно присевшей ей, и села на кресло подле зеркала, живописно раскинув складки своего бархатного платья. Она не переставала добродушно и весело болтать, беспрестанно восхищаясь красотой Наташи. Она рассмотрела ее платья и похвалила их, похвалилась и своим новым платьем en gaz metallique, [из газа цвета металла,] которое она получила из Парижа и советовала Наташе сделать такое же. – Впрочем, вам все идет, моя прелестная, – говорила она. С лица Наташи не сходила улыбка удовольствия. Она чувствовала себя счастливой и расцветающей под похвалами этой милой графини Безуховой, казавшейся ей прежде такой неприступной и важной дамой, и бывшей теперь такой доброй с нею. Наташе стало весело и она чувствовала себя почти влюбленной в эту такую красивую и такую добродушную женщину. Элен с своей стороны искренно восхищалась Наташей и желала повеселить ее. Анатоль просил ее свести его с Наташей, и для этого она приехала к Ростовым. Мысль свести брата с Наташей забавляла ее. Несмотря на то, что прежде у нее была досада на Наташу за то, что она в Петербурге отбила у нее Бориса, она теперь и не думала об этом, и всей душой, по своему, желала добра Наташе. Уезжая от Ростовых, она отозвала в сторону свою protegee. – Вчера брат обедал у меня – мы помирали со смеху – ничего не ест и вздыхает по вас, моя прелесть. Il est fou, mais fou amoureux de vous, ma chere. [Он сходит с ума, но сходит с ума от любви к вам, моя милая.] Наташа багрово покраснела услыхав эти слова. – Как краснеет, как краснеет, ma delicieuse! [моя прелесть!] – проговорила Элен. – Непременно приезжайте. Si vous aimez quelqu'un, ma delicieuse, ce n'est pas une raison pour se cloitrer. Si meme vous etes promise, je suis sure que votre рromis aurait desire que vous alliez dans le monde en son absence plutot que de deperir d'ennui. [Из того, что вы любите кого нибудь, моя прелестная, никак не следует жить монашенкой. Даже если вы невеста, я уверена, что ваш жених предпочел бы, чтобы вы в его отсутствии выезжали в свет, чем погибали со скуки.] «Стало быть она знает, что я невеста, стало быть и oни с мужем, с Пьером, с этим справедливым Пьером, думала Наташа, говорили и смеялись про это. Стало быть это ничего». И опять под влиянием Элен то, что прежде представлялось страшным, показалось простым и естественным. «И она такая grande dame, [важная барыня,] такая милая и так видно всей душой любит меня, думала Наташа. И отчего не веселиться?» думала Наташа, удивленными, широко раскрытыми глазами глядя на Элен. К обеду вернулась Марья Дмитриевна, молчаливая и серьезная, очевидно понесшая поражение у старого князя. Она была еще слишком взволнована от происшедшего столкновения, чтобы быть в силах спокойно рассказать дело. На вопрос графа она отвечала, что всё хорошо и что она завтра расскажет. Узнав о посещении графини Безуховой и приглашении на вечер, Марья Дмитриевна сказала: – С Безуховой водиться я не люблю и не посоветую; ну, да уж если обещала, поезжай, рассеешься, – прибавила она, обращаясь к Наташе.
Граф Илья Андреич повез своих девиц к графине Безуховой. На вечере было довольно много народу. Но всё общество было почти незнакомо Наташе. Граф Илья Андреич с неудовольствием заметил, что всё это общество состояло преимущественно из мужчин и дам, известных вольностью обращения. M lle Georges, окруженная молодежью, стояла в углу гостиной. Было несколько французов и между ними Метивье, бывший, со времени приезда Элен, домашним человеком у нее. Граф Илья Андреич решился не садиться за карты, не отходить от дочерей и уехать как только кончится представление Georges. Анатоль очевидно у двери ожидал входа Ростовых. Он, тотчас же поздоровавшись с графом, подошел к Наташе и пошел за ней. Как только Наташа его увидала, тоже как и в театре, чувство тщеславного удовольствия, что она нравится ему и страха от отсутствия нравственных преград между ею и им, охватило ее. Элен радостно приняла Наташу и громко восхищалась ее красотой и туалетом. Вскоре после их приезда, m lle Georges вышла из комнаты, чтобы одеться. В гостиной стали расстанавливать стулья и усаживаться. Анатоль подвинул Наташе стул и хотел сесть подле, но граф, не спускавший глаз с Наташи, сел подле нее. Анатоль сел сзади. M lle Georges с оголенными, с ямочками, толстыми руками, в красной шали, надетой на одно плечо, вышла в оставленное для нее пустое пространство между кресел и остановилась в ненатуральной позе. Послышался восторженный шопот. M lle Georges строго и мрачно оглянула публику и начала говорить по французски какие то стихи, где речь шла о ее преступной любви к своему сыну. Она местами возвышала голос, местами шептала, торжественно поднимая голову, местами останавливалась и хрипела, выкатывая глаза. – Adorable, divin, delicieux! [Восхитительно, божественно, чудесно!] – слышалось со всех сторон. Наташа смотрела на толстую Georges, но ничего не слышала, не видела и не понимала ничего из того, что делалось перед ней; она только чувствовала себя опять вполне безвозвратно в том странном, безумном мире, столь далеком от прежнего, в том мире, в котором нельзя было знать, что хорошо, что дурно, что разумно и что безумно. Позади ее сидел Анатоль, и она, чувствуя его близость, испуганно ждала чего то. После первого монолога всё общество встало и окружило m lle Georges, выражая ей свой восторг. – Как она хороша! – сказала Наташа отцу, который вместе с другими встал и сквозь толпу подвигался к актрисе. – Я не нахожу, глядя на вас, – сказал Анатоль, следуя за Наташей. Он сказал это в такое время, когда она одна могла его слышать. – Вы прелестны… с той минуты, как я увидал вас, я не переставал…. – Пойдем, пойдем, Наташа, – сказал граф, возвращаясь за дочерью. – Как хороша! Наташа ничего не говоря подошла к отцу и вопросительно удивленными глазами смотрела на него. После нескольких приемов декламации m lle Georges уехала и графиня Безухая попросила общество в залу. Граф хотел уехать, но Элен умоляла не испортить ее импровизированный бал. Ростовы остались. Анатоль пригласил Наташу на вальс и во время вальса он, пожимая ее стан и руку, сказал ей, что она ravissante [обворожительна] и что он любит ее. Во время экосеза, который она опять танцовала с Курагиным, когда они остались одни, Анатоль ничего не говорил ей и только смотрел на нее. Наташа была в сомнении, не во сне ли она видела то, что он сказал ей во время вальса. В конце первой фигуры он опять пожал ей руку. Наташа подняла на него испуганные глаза, но такое самоуверенно нежное выражение было в его ласковом взгляде и улыбке, что она не могла глядя на него сказать того, что она имела сказать ему. Она опустила глаза. – Не говорите мне таких вещей, я обручена и люблю другого, – проговорила она быстро… – Она взглянула на него. Анатоль не смутился и не огорчился тем, что она сказала. – Не говорите мне про это. Что мне зa дело? – сказал он. – Я говорю, что безумно, безумно влюблен в вас. Разве я виноват, что вы восхитительны? Нам начинать.
wiki-org.ru
Ацетилен - это... Что такое Ацетилен?
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2h3 обнаружен на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 2621 °C)Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
Применение
 Ацетиленовая лампа
Ацетиленовая лампа Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком)[2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Примечания
Ссылки
dik.academic.ru