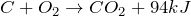Формулы и характеристики воды и диоксида углерода. Формула диоксида углерода
Формулы и характеристики воды и диоксида углерода
Вспенивающим агентом в процессе водного вспенивания пенополиуретанов выступает образующийся при реакции воды с изоцианатом газообразный диоксид углерода (СО2).

Физические свойства
В газообразной форме диоксид углерода (CO2, двуокись углерода, углекислый газ) тяжелее воздуха, бесцветен и не имеет запаха. При атмосферном давлении CO2 может существовать только в твердой или газообразной фазе. Жидкость при таком давлении образоваться не может. При температуре –78.4°C СО2 переходит в твердую фазу, образуя сухой лед. При повышении температуры сухой лед превращается в пар.
Молярная масса: 44,01 г/моль.
Плотность: в твердой фазе — 1512 кг/м3, в жидком состоянии — 771 кг/м3, в виде газа при нормальных условиях — 1.98 кг/м3.
Растворимость в воде: 1,45 кг/м3 (при температуре +15 °С в одном объеме воды растворяется один объем CO2).
Удельная теплоемкость: 846 Дж/(кг·К).
Удельная теплота плавления: 25,13 кДж/моль
Коэффициент теплопроводности при 20 °С: 0,0162 Вт/(м·К)
Характеристики безопасности
Диоксид углерода негорюч и нетоксичен. Этот газ входит в состав атмосферного воздуха, где его содержание составляет около 0,04% (400 ppm). Тем не менее повышение концентрации CO2 во вдыхаемом воздухе негативно отражается на самочувствии человека. Согласно ГН 2.2.5.2100-06 среднесменная ПДК СО2 — 5000 ppm или 9000 мг/м3. Разовая ПДК СО2 — 15000 ppm или 27000 мг/м3 (для R22, согласно ПОТ РМ 015-2000, 500 ppm или 3000 мг/м3). Практический предел концентрации (ППК) для СО2 составляет 0,07 кг/м3.
Диоксид углерода имеет нулевой озоноразрушающий потенциал, при этом он является основным парниковым газом, а его способность влиять на климат принята за единицу измерения потенциала глобального потепления. Следует отметить, что ПГП многих традиционных ХФУ/ГХФУ/ГФУ-вспенивателей значительно (в сотни и тысячи раз) превышает ПГП диоксида углерода. Кроме того, в отличие от пентана, углекислый газ, попадая в атмосферу, не способствует образованию фотохимического смога.
foamunion.ru
Углерод диоксид, строение - Справочник химика 21
Чаще всего встречаются координационные числа 2, 3, 4 и 6 (табл. 1-6). Ион или молекула с центральным атомом, имеющим координационное число 2, может иметь линейное строение (как диоксид.углерода, О—С—О, в котором атомы расположены на одной прямой) либо изогнутое строение, как молекула воды, Н О. Возможные структуры ионов или молекул с координационными числами 3, 4 и 6 показаны на рис. 1-6. [c.34]
При химическом взаимодействии атомов образуются молекулы. Молекулы бывают одноатомные (например, молекулы гелия Не), двухатомные (азота N2, оксида углерода СО), многоатомные (воды Н2О, бензола Се Не) и полимерные (содержащие до сотен тысяч и более атомов — молекулы металлов в компактном состоянии, белков, кварца). При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом. Поэтому при сравнительно небольшом числе химических элементов число различных веществ очень велико. Состав и строение молекул определяют состояние вещества при выбранных условиях и его свойства. Например, диоксид углерода СО2 при обычных условиях — газ, взаимодействующий с водой, а диоксид кремния 8102 — твердое полимерное вещество, в воде не растворяющееся. При химических явлениях молекулы разрушаются, но атомы сохраняются. Во многих химических процессах атомы и молекулы могут переходить в заряженное состояние с образованием ионов — частиц, несущих избыточный положительный или отрицательный заряды. [c.18]Каталитические процессы широко распространены в природе и эффективно используются в различных отраслях промышленности, иауки и техники. Так, в химической промышленности посредством гетерогенных каталитических процессов получают десятки миллионов тонн аммиака из азота воздуха и водорода, азотной кислоты путем окисления аммиака, триоксида серы окислением 50г воздухом и др. В нефтехимической промышленности более половины добываемой нефти посредством каталитических процессов крекинга, рифор-минга и т. п. перерабатывается в более ценные продукты — высококачественное моторное топливо, различного вида мономеры для получения полимерных волокон и пластмасс. К многотоннажным каталитическим процессам относятся процессы получения водорода путем конверсии диоксида углерода и метана, синтез спиртов, формальдегида и многие другие. Можно утверждать, что для любой реакции может быть создан катализатор. Теория катализа должна раскрывать закономерности элементарного каталитического акта, зависимость каталитической активности от строения и свойств катализатора и реагирующих молекул и тем самым создать необходимые предпосылки для предсказания строения и свойств катализатора для конкретной реакции, указать пути его получения. К описанию скорости каталитического процесса можно подходить, используя основные положения формальной кинетики и метод переходного состояния. При этом целесообразно сперва выделить общие закономерности катализа, присущие всем видам каталитических процессов, а затем рассмотреть некоторые специфические особенности отдельных групп каталитических процессов. [c.617]
В кислородных соединениях кремния связи значительно более прочные, чем в соединениях углерода с кислородом, что объясняется особенностями строения диоксида кремния и силикатов. Структурные единицы кристаллического диоксида кремния, как и многих кристаллических силикатов, представляют собой тетраэдры, [c.200]
Молекула диоксида углерода имеет линейное строение (л/)-гибридизация орбиталей атома С ), ее электронная формула [c.150]
Все вещества, которые нас окружают и которые мы используем в своей деятельности, условно можно разделить на две большие совокупности возникшие естественным путем в ходе эволюции Земли и полученные искусственно, синтетически. К первым можно отнести кислород воздуха, воду, глину (глинозем), различные соли, нефть, уголь, т. е. вещества минерального, растительного и животного происхождения. С ними вы познакомились в курсе природоведения и в начальном курсе химии. Одни из этих веществ играют очень важную и заметную роль в тех постоянно и непрерывно идущих процессах круговорота веществ, которые создают устойчивый баланс их в атмосфере и гидросфере. Так, достаточно устойчивым, постоянным оказывается и поддерживается отношение (баланс) углекислого газа и кислорода воздуха. Химическое изучение и описание этих веществ показывает, что они имеют разнообразные состав, строение и свойства. Так, в атмосфере находятся атомы инертных газов (Не, Ме, Аг, Кг, Хе), молекулы кислорода Оа, азота N2, диоксида углерода (углекислого газа) СОг, пары воды Н2О, озон Оз, некоторое количество газообразных и твердых веществ (пыль), являющихся как результатом естественных процессов, так и отходами (выбросами, побочными продуктами) химических производств, транспорта, переработки сырья и т. п. [c.5]
Графические фор/лулы были составлены на основании изучения свойств и химических реакций веществ, но еще не учитывали внутреннего строения молекул и кристаллов. Какие выводы можно сделать, сравнивая графические формулы диоксида углерода и кремния [c.185]
Химическое изучение и описание этих веществ показывает, что они имеют разнообразные состав, строение и свойства. В атмосфере находятся атомы инертных газов (Не, Ме, Аг, Кг, Хе), молекулы кислорода О2, азота N2, диоксида углерода (углекислого газа) СО2, пары воды Н2О, озон О3, некоторые количества газообразных и твердых веществ (пыль), являющихся как результатом естественных процессов, так и отходами (выбросами, побочными продуктами) химических производств, транспорта, переработки сырья и т. п. [c.6]
Диоксид углерода (углекислый газ ) СОз. Молекула СО имеет линейное строение. Каждый атом кислорода присоединен к атому углерода двой- [c.468]
При исследовании строения неизвестного органического соединения обычно начинают с того, что проводят элементный анализ. Для этого определенное количество (обычно несколько миллиграммов) чистого соединения сжигают в специальном приборе. Количество получившихся диоксида углерода и воды измеряют и вычисляют процентное содержание углерода и водорода в соединении. Если в соединении имеются и другие элементы, например галоген, сера или азот, то чаще всего производят проверку на ионы галогена, серы или на элементарный азот. Из этих данных вычисляют процентное содержание соответствующего элемента в соединении. Содержание кислорода обычно находят, вычитая из 100 /о процентное содержание всех остальных элементов в соединении. [c.18]
Реакция йодной кислоты с быг -диолами имеет важное значение в химии углеводов, которые в своем составе содержат немало таких пар гидроксильных групп. В то время как свободные аль-дозы и кетозы под действием йодной кислоты полностью окисляются до муравьиной кислоты, формальдегида и диоксида углерода, такие производные, как метилгликозиды, подвергаются окислительному расщеплению с образованием продуктов, характерных для циклического строения исходного вещества. Например, метилглюкозид может иметь фуранозную и пиранозную циклические структуры, которые удается различить по продуктам окисления йодной кислотой. Пиранозид должен взаимодействовать с двумя молекулами йодной кислоты с образованием одной молекулы муравьиной кислоты при расщеплении связей, отмеченных на схеме. Фуранозное производное также должно реагировать с двумя молекулами йодной кислоты, давая одну молекулу формальдегида и различные остаточные фрагменты. Муравьиную кислоту можно легко отличить от формальдегида, определив тем самым пяти- и шестичленные структуры исходных сахаров. [c.276]
Однако к фазам переменного состава относятся и растворы. В газовых растворах, несмотря на их однородность, имеется смесь молекул (например, молекул кислорода, азота, диоксида углерода и т. п.). В жидких растворах отсутствуют молекулы с качественно новым химическим строением по сравнению с химическим строением исходных компонентов. Твердые растворы обладают кристаллохимическим строением компонента-растворителя. В отличие от твердых растворов химическое соединение переменного состава характеризуется присущим только ему кристаллохимическим строением, не свойственным строению компонентов. Поэтому в противоположность твердым растворам свойства соединений переменного состава резко отличаются от свойств составляющих веществ. [c.29]
Нельзя отождествлять степень окисления с валентностью элемента, если даже абсолютные их значения совпадают. Валентность атома, определяемая как число химических связей, которыми данный атом соединен с другими атомами, не может иметь знака (+ или —) и равняться нулю. Поэтому особенно неудачны выражения положительная и отрицательная валентность и тем более нулевая валентность , бытующие поныне в химической литературе. Рассмотрим пример метана СНд, метилового спирта СНзОН, формальдегида НСОН, муравьиной кислоты ИСООН и диоксида углерода СОа, в которых валентность углерода равна четырем, а степени окисления его равны соответственно —4, —2, О, + 2 и -1-4. Кроме того, для установления валентности атома требуется знание химического строения соединения, а определение степени окисления производится в отрыве от строения вещества, т. е. формально. [c.72]
По теории Льюиса — Лэнгмюра (1916—1918) электронные октеты (дублет у водорода) образовывались общими парами электронов, принадлежавшими обоим атомам. Эту связь назвали ковалентной или атомной. Изображая точками электроны внешнего слоя атомов, можно представить строение молекул хлора, азота, диоксида углерода и ацетилена, по Льюису, следующим образом [c.107]
Экспериментально установлено, что дипольный момент молекулы диоксида углерода СО2 равен нулю. Достаточно ли этой информации, а также электронной формулы молекулы, чтобы определить, имеет она изогнутое или линейное строение Объясните ответ. [c.146]
Оранжево-желтый, при нагревании разлагается без плавления. Имеет ионное строение (Na+)(0 ). Реагирует с водой, кислотами, моно- и диоксидом углерода. Сильный окислитель. Получение см. 26 , 406 . [c.19]
Оранжево-желтый, при нагревании разлагается, плавится под избыточным давлением. Имеет ионное строение (К+)(0 ). Реагирует с водой, кислотами, моно- и диоксидом углерода, озоном, калием, аммиаком. Очень сильный окислитель. Получение см. 43 . [c.30]
Оранжево-желтый. При нагревании разлагается, плавится под избыточным давлением О2. Имеет ионное строение (Rb+)(0 ). Энергично реагирует с водой, кислотами, озоном, моно- и диоксидом углерода, аммиаком. Очень сильный окислитель. Получение см. 63 , 69 . [c.41]
При энергичном окислении кетона получены уксусная кислота Hj OOH и диоксид углерода. Какое строение имел кетон [c.357]
Тяжелая часть нефти представляет собой сложную смесь неидентифицированных углеводородов и гетеросоединений самого разнообразного строения. Для решения практических задач определяют содержание отдельных классов или групп веществ асфальтенов, силикагелевых смол и масел. Среди последних различают соединения парафиновой, нафтеновой и ароматической основы. Кислород воздуха, взаимодействующий с нефтяным сырьем, расходуется в различных реакциях окисления. Часть кислорода образует воду и диоксид углерода, другая — химически связывается компонентами сырья. С повышением температуры окисления увеличивается доля кислорода, расходуемого на образование воды. В целом процесс окисления характеризуется переходом масел в смолы и смол в асфальтены. В масляной части наибольшая скорость окисления наблюдается у тяжелых ароматических углеводородов, в то время как парафино-нафтеновая группа углеводородов почти не затрагивается. [c.287]
Молекула диоксида углерода ди1магнитна, неполярна, связь СО характеризуется высокой прочностью ( =803 кДж/моль), межъядерное расстояние d o составляет 0,116 нм, что на 0,027 нм короче длины одинарной связи СО ( со=0,143 нм). Объясните приведенные экспериментальные данные, исходя из строения молекулы СО2. [c.12]
Относительно малая активность углерода и кремния при обычной температуре — следствие их полимерного строения и большой энергии связи между атомами. Более высокая реак-ционноспоообность кремния, чем углерода, обусловлена устойчивостью образую-щихся соединений, а также другими причинами (размер частиц, строение поверхности, содержание примесей). При обычной температуре углерод и кремний не изменяются (не реагируют) на воздухе. При более высокой температуре образуются диоксиды. Вода при повышенной температуре восстанавливается ими до Нг [c.555]
Определите строение соединения СбНеО,,, которое очень легко разлагается на ацетон и диоксид углерода. [c.108]
Диоксид СО2 — газ, бесцветный, слегка кисловатый на вкус, в 1,5 раза тяжелее воздуха. При комнатной температуре под давлением около 60,6-10 Па переходит в бесцветную жидкость. При ее охлаждении в результате испарения СО2 частично превращается в твердую снегоподобную массу ( сухой лед ). Во всех агрегатных состояниях диоксид углерода состоит из линейных, бездипольных, неассоциированных молекул Oj. Химическое строение диоксида углерода определяется sp-гибридизацией центрального атома углерода и образованием дополнительных я .р-связей [c.184]
По химическому строению молекулы СО, химическим и физическим свойствам оксид углерода проявляет большое сходство с молекулярным азотом. Молекулы СО и Мг изоэлектронны, имеют равную молекулярную массу, высокий порядок связи и относятся к самым прочным двухатомным частицам. В химическом от-ношеиии оксид СО совсем не похож на диоксид углерода. В отличие от СО оксид углерода не обладает кислотной природой. Для него наиболее характерны реакции окисления и присоединения. Первые обусловлены степенью окисления углерода в СО (+2), а вторые — неподелепными электронными парами атомов углерода и кислорода. [c.185]
Именно линейное строение молекулы диоксида углерода объясняет отсутствие электрического момента диполя в ней. Поэтому в диоксиде углерода также наблюдается р-гибри-дизация центрального атома углерода. Что касается атомов кислорода, у них происходит р -гибридизация, в результате чего у каждого атома остается по одному чистому (негибридному) [c.113]
Однако к фазам переменного состава относятся и растворы, В газовых растворах, несмотря на их однородность, имеется смесь молекул (например, молекул кислорода, азота, диоксида углерода и т,п, в воздухе), В жидких растворах отсутствуют молекулы с качественно новым химическим строением по сравнению с химическим строением исходных компонентов. Однако в растворах неорганических веществ часто возникают новые структурные образования (неопределенные сольваты, гидраты, гидратированные ионы и т,д,), не относящиеся к типическим новообразованиям. Твердые растворы обладают кристаллохимическим строением компонента-растворителя, В отличие от твердых растворов химическое соединение переменного состава характеризуется присущим только ему кристаллохимическим строением, не свойственным строению компонентов. Поэтому в противоположность твердым растворам свойства соединений переменного состава резко отличаются от свойств составляющих веществ. [c.22]
Дисульфид углерода (сероуглерод) СЗг — низкокипящая горючая жидкость. Пары его очень токсичны и легко воспламеняются. Он почти нерастворим в воде, является хорошим растворителем многих органических веществ, например, жиров, красок и др., а также некоторых неорганических вещёств (бром, иод, сера, белый фосфор). Во всех агрегатных состояниях сероуглерод представляет собой линейные неассоциированные молекулы С82, Его химическое строение аналогично структуре СО2, Поэтому молекула С82 также не имеет электрического момента диполя. Реакционная способность сероуглерода в обычных условиях невысока. Он горит синим пламенем с образованием диоксидов серы и углерода [c.363]
Состав и количество продуктов радиационной деструкции зависят от химического строения полимеров. Так, при деструкции полиэтилена, полипропилена, полистирола, полибутадиена основным летучим (Еродуктом деструкции является воиород, при деструкции полимерных кислот и сложных эфиров выделяются оксид и диоксид углерода, при радиолизе поливинилхлорида и поливипилиденхлорила — хлорид водорода и хлор. [c.213]
В отличие от ненаправленных электростат пче-ских сил, действующих в ионных веществах, ковалентные связи характеризуются направленностью в пространстве, что приводит к вполне определенному расположению атомов в молекулах. Например, в молекуле диоксида углерода три атома располагаются линейно О = С = О. В жидком или газообразном диоксиде углерода молекулы СО2 свободно совершают вращательное и поступательное движения, но три атома, образующие каждую молекулу, почти не изменяют своею линейного расположения. Молекула воды также состоит из трех атомов, но она имеет изогнутое строение, причем связи О - Н образуют угол 104 40. Для того чтобы объяснить строение, присущее молекулам типа СО2 и Н2О, следует рассмотреть пространственное распреде- [c.132]
Белый (иногда желтоватый из-за примеси Na02). При нагревании на воздухе желтеет и разлагается, плавится под избыточным давлением О2. Имеет ионное строение (Na+)2(02 ). Поглощает СО2 из воздуха. Полностью разлагается водой, кислотами. Энергично реагирует с кислородом, серой, натрием, моно и диоксидом углерода. Проявляет окислительно-восстановительные свойства. Получение см. 23 , 25 28 . [c.19]
chem21.info
формула, свойства и области применения :: ashanet.ru
Диоксид углерода (углекислый газ) - часто встречающееся в природе соединение. Оно образуется при окислении различных органических веществ. Наиболее часто встречающиеся процессы образования этого соединения - гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.
Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
Формула
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так:
Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде – в одном литре воды при 20 ⁰С растворяется около 0,88 л CO2. Небольшое понижение температуры кардинально меняет ситуацию – в том же литре воды при 17⁰С может раствориться 1,7 л CO2. При сильном охлаждении это вещество осаждается в виде снежных хлопьев – образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации - угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.
В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + h3O;
NaOH + CO2 = NaHCO3.
Угольная кислота и раствор СО2
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
CO2 + h3O ↔ h3CO3.
Равновесие довольно сильно сдвинуто влево – лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура – тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.
Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н+ и соединения НСО3- . В очень небольшом количестве образуются ионы СО3-.
Угольная кислота – двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные – гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Ca(OH)2 + CO2 = CaCO3↓ + h3O.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение – карбонат кальция превращается в растворимое вещество – гидрокарбонат кальция. Реакция протекает по такому пути:
CaCO3 + h3O + CO2 = Ca(HCO3)2.
Получение диоксида углерода
Если требуется получить небольшое количество СО2,можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
CaCO3 + HCl = CaCl2 + h3O + CO2 ↑.
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
СН4 + 2О2 → 2h3O + CO2.
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
CaCO3 = CaO + CO2 ↑.
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.
В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
ashanet.ru
Двуокись углерода - это... Что такое Двуокись углерода?
| Другие названия | углекислый газ, углекислота,сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.;771 кг/м³, жидкий;1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | 0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Оксиды | COC3O2C2OCO3 |
| Если не указано иное, данные даны дляматериалов при стандартных условиях (25 °C, 100 кПа)Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Не следует путать с Диоксин.Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
dik.academic.ru
Диоксид углерода - Википедия
| Диоксид углерода | |
| Диоксид углерода | |
| углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) | |
| CO2 | |
| бесцветный газ | |
| 44,01 г/моль | |
| газ 1,97680 кг/м³ж. 9250°С, 35,5 ат кг/м³тв. 1560-78,5 кг/м³ | |
| 8,5·10-5 Па·с (10°C; 5,7 МПа) | |
| 13,77±0,01 эВ[1] | |
| -78,5 °C | |
| -56,6°C; 0,52 МПа | |
| 31,1 °C; 7,38 МПа | |
| 846 Дж/(кг·К) | |
| 25,13 кДж/моль | |
| 56,5±0,1 атм[1] | |
| 1,45 кг/м³ | |
| 124-38-9 | |
| 280 | |
| 204-696-9 | |
| E290 | |
| FF6400000 | |
| 16526 | |
| 1013 | |
| 274 | |
| S9, S23, S36 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях) без запаха, с химической формулой CO2.
Плотность при нормальных условиях 1,98 кг/м³ (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[2]. Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Свойства[ | ]
Физические[ | ]
Оксид углерода (IV) — углекислый газ, газ без запаха и цвета, тяжелее воздуха, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации −78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (1 объём углекислого газа в одном объёме воды при 15 °С).
Химические[ | ]
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы:[3]:
2Mg+CO2→2MgO+C{\displaystyle {\mathsf {2Mg+CO_{2}\rightarrow 2MgO+C}}}Взаимодействие с оксидом активного металла:
CaO+CO2→CaCO3{\displaystyle {\mathsf {CaO+CO_{2}\rightarrow CaCO_{3}}}}При растворении в воде образует угольную кислоту:
CO2+h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows H_{2}CO_{3}}}}Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
Ca(OH)2+CO2→CaCO3↓+h3O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\rightarrow CaCO_{3}\downarrow +H_{2}O}}} (качественная реакция на углекислый газ) KOH+CO2→KHCO3{\displaystyle {\mathsf {KOH+CO_{2}\rightarrow KHCO_{3}}}}Биологические[ | ]
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[4].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, и уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[5].
Содержание углекислого газа в крови человека приблизительно таково:
| кПа | 5,5[6]—6,8[6] | 4,8 | 4,7[6]—6,0[6] |
| мм рт.ст. | 41—51 | 36 | 35[7]—45[7] |
Углекислый газ (CO2) транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Большая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[8], при помощи реакции CO2 + h3O → h3CO3 → H+ + HCO3-.
- Около 5 % — 10 % углекислого газа растворено в плазме крови[8].
- Около 5 % — 10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[8].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[8].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 40 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению). Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение[ | ]
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение[ | ]
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими[9].
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[10]
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31°С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31°С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа,— таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации[ | ]
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[11].
Углекислый газ в природе[ | ]
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[12].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность[ | ]
Углекислый газ нетоксичен, но по воздействию его повышенных концентраций в воздухе на воздуходышащие живые организмы его относят к удушающим газам (англ.). Незначительные повышения концентрации до 2—4 % в помещениях приводят к развитию у людей сонливости и слабости. Опасными концентрациями считаются уровни около 7—10 %, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), в зависимости от концентрации, в течение времени от нескольких минут до одного часа. При вдыхании воздуха с высокими концентрациями газа смерть наступает очень быстро от удушья[13].
Хотя, фактически, даже концентрация 5—7 % CO2 не смертельна, уже при концентрации 0,1 % (такое содержание углекислого газа наблюдается в воздухе мегаполисов) люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоких содержаниях кислорода большая концентрация CO2 сильно влияет на самочувствие.
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья и после удаления пострадавшего из загазованной атмосферы быстро наступает полное восстановление здоровья[14].
См. также[ | ]
Примечания[ | ]
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0103.html
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Проверено 24 сентября 2013.
- ↑ А. С. Егоров. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009
- ↑ How much carbon dioxide do humans contribute through breathing?. Проверено 30 апреля 2009. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry. — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм.рт.ст. с использованием коэффициента пересчёта 0.133322 кПа/мм.рт.ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide. solarnavigator.net. Проверено 12 октября 2007.
- ↑ Углекислотная установка для аквариума
- ↑ Большая Энциклопедия Нефти и Газа
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. ОПРЕДЕЛЕНИЕ СОСТАВА МЕТОДОМ ГАЗОВОЙ ХРОМАТОГРАФИИ С ОЦЕНКОЙ НЕОПРЕДЕЛЕННОСТИ. Часть 6. ОПРЕДЕЛЕНИЕ ВОДОРОДА, ГЕЛИЯ, КИСЛОРОДА, АЗОТА, ДИОКСИДА УГЛЕРОДА И УГЛЕВОДОРОДОВ C1 — C8 С ИСПОЛЬЗОВАНИЕМ ТРЕХ КАПИЛЛЯРНЫХ КОЛОНОК.
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. (1967). «Carbon Dioxide Tolerance Studies». Brooks AFB, TX School of Aerospace Medicine Technical Report SAM-TR-67-77. Проверено 2008-05-02.
Литература[ | ]
- Вукалович М. П., Алтунин В. В. Теплофизические свойства двуокиси углерода. — М.: Атомиздат, 1965. — 456 с.
- Тезиков А. Д. Производство и применение сухого льда. — М.: , 1960. — 86 с.
- Гродник М. Г., Величанский А. Я. Проектирование и эксплуатация углеслотных установок. — М.: , 1966. — 275 с.
- Талянкер Ю. Е. Особенности хранения баллонов со сжиженным газом // . — 1972. — № 11.
Ссылки[ | ]
encyclopaedia.bid