CO2 + Nh4 = ? уравнение реакции. Co2 с чем реагирует
С чем реагирует CO2
Диоксид углерода проявляет кислотные свойства, а значит ответ на вопрос «с чем реагирует CO2» упрощается: с основными и амфотерными оксидами, основаниями, амфотерными гидроксидами и некоторыми солями. Теперь расскажем о свойствах этого соединения несколько подробнее.При нагревании «аморфного» углерода на воздухе он энергично взаимодействует с кислородом, причем по реакции
![Rendered by QuickLaTeX.com \[C + O_2 \rightarrow CO_2 + 94 kJ\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ab88b658eadaeceff43bf49e62fbd39e_l3.png)
образуется двуокись углерода. В лабораторных условиях углекислый газ удобно получать действием соляной кислоты на известняк или мрамор по реакции:
![Rendered by QuickLaTeX.com \[CaCO_3 + 2HCl \rightarrow CaCl_2+ CO_2_{gas} + H_2O.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3fdd17a62989646decfe950753f73928_l3.png)
Диоксид углерода представляет собой бесцветный газ со слегка кисловатым запахом и вкусом. Под давлением около 60 атм он уже при обычных температурах сгущается в бесцветную жидкость (которую хранят и перевозят в стальных баллонах). При сильном охлаждении 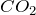 застывает в белую снегообразную массу, под обычным давлением возгоняющуюся при
застывает в белую снегообразную массу, под обычным давлением возгоняющуюся при 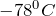 .В воде двуокись углерода растворима довольно хорошо (приблизительно 1:1 по объему). При растворении происходит её частичное взаимодействие с водой, ведущее к образованию угольной кислоты:
.В воде двуокись углерода растворима довольно хорошо (приблизительно 1:1 по объему). При растворении происходит её частичное взаимодействие с водой, ведущее к образованию угольной кислоты:
![Rendered by QuickLaTeX.com \[H_2O + CO_2 \rightleftharpoons H_2CO_3.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-52154cadbf34ef065de16751105e4259_l3.png)
Углекислый газ играет важную роль в биологических (фотосинтез), природных (парниковый эффект) и геохимических (растворение в океанах и образование карбонатов) процессах. В больших количествах он поступает в окружающую среду в результате сжигания органического топлива, гниения отходов и т.д.
ru.solverbook.com
С какими соединениями оксид углерода 4 реагирует? С какими веществами вступает в реакцию углекислый газ?
Углекислый газ, известный также как оксид углерода 4, реагирует с рядом веществ, образуя самые различные по своему составу и химическим свойствам соединения. Состоящий из неполярных молекул, он имеет очень слабые межмолекулярные связи и может находиться только в виде газа, если температура выше, чем 31 градус по Цельсию. Углекислый газ представляет собой химическое соединение, состоящее из одного атома углерода и двух атомов кислорода.

Оксид углерода 4: формула и основная информация
Углекислый газ присутствует в атмосфере Земли при низкой концентрации и действует как парниковый газ. Его химическая формула СО2. При высокой температуре он может существовать исключительно в газообразном состоянии. В своем твердом состоянии его называют сухим льдом.
Углекислый газ является важным компонентом углеродного цикла. Он исходит из множества природных источников, включая вулканическую дегазацию, сжигание органического вещества и дыхательные процессы живых аэробных организмов. Антропогенные источники углекислого газа в основном связаны с сжиганием различных ископаемых видов топлива для производства электроэнергии и транспорта.

Он также продуцируется различными микроорганизмами из ферментации и клеточного дыхания. Растения превращают углекислый газ в кислород во время процесса, называемого фотосинтезом, используя как углерод, так и кислород для образования углеводов. Кроме того, растения также выделяют кислород в атмосферу, который затем используется для дыхания гетеротрофными организмами.
Углекислый газ (СО2) в организме
Оксид углерода 4 реагирует с разными веществами и является газообразным продуктом отходов от метаболизма. Существует более чем 90% его в крови в форме бикарбоната (НСО3). Остальное - это либо растворенный СО2, либо угольная кислота (h3CO3). За балансирование этих соединений в крови отвечают такие органы, как печень и почки. Бикарбонат - это химическое вещество, которое действует как буфер. Она удерживает уровень рН крови на необходимом уровне, избегая повышения кислотности.

Структура и свойства углекислого газа
Двуокись углерода (CO2) представляет собой химическое соединение, которое является газом при комнатной температуре и выше. Он состоит из одного атома углерода и двух атомов кислорода. Люди и животные выделяют углекислый газ, когда выдыхают. Кроме того, он образуется всегда, когда что-то органическое сжигается. Растения используют углекислый газ для производства продуктов питания. Этот процесс называется фотосинтезом.
Свойства углекислого газа изучались шотландским ученым Джозефом Блэком еще в 1750-х годах. Это парниковый газ, способный улавливать тепловую энергию и оказывать воздействие на климат и погоду на нашей планете. Именно он является причиной глобального потепления и повышения температуры поверхности Земли.
Биологическая роль
Оксид углерода 4 реагирует с разными веществами и является конечным продуктом в организмах, которые получают энергию от разрушения сахаров, жиров и аминокислот. Это процесс известен как клеточное дыхание, характерное для всех растений, животных, многих грибов и некоторых бактерий. У высших животных углекислый газ перемещается в крови из тканей тела в легкие, где он выдыхается. Растения получают его из атмосферы для использования при фотосинтезе.
Сухой лед
Сухой лед или твердый диоксид углерода представляет собой твердое состояние газа CO2 с температурой-78,5 °C. В естественном виде это вещество не встречается в природе, но производится человеком. Оно бесцветно и может использоваться для приготовления газированных напитков, как охлаждающий элемент в емкостях с мороженым и в косметологии, например для замораживания бородавок. Пары сухого льда вызывают удушье и могут привести к смерти. При использовании сухого льда стоит проявлять осторожность и профессионализм.
При обычном давлении он не будет плавиться из твердого вещества в жидкость, а вместо этого переходит непосредственно из твердого вещества в газ. Это называется сублимацией. Он будет меняться непосредственно от твердого тела к газу при любой температуре, превышающей экстремально низкие температуры. Сухой лед сублимируется при нормальной температуре воздуха. При этом выделяется углекислый газ, который не имеет запаха и цвета. Двуокись углерода может быть сжижена при давлении выше 5,1 атм. Газ, который выделяется из сухого льда, настолько холодный, что при смешивании с воздухом он охлаждает водяной пар в воздухе до тумана, который выглядит как густой белый дым.
Получение, химические свойства и реакции
В промышленности оксид углерода 4 получают двумя способами:
- Путем сжигания топлива (C + O2 = CO2).
- Путем термического разложения известняка (CaCO3 = CaO + CO2).
Полученный объем оксида углерода 4 подвергается очистке, сжижается и закачивается в специальные балоны.
Являясь кислотным, оксид углерода 4 реагирует с такими веществами, как:
- Вода. При растворении образуется угольная кислота (h3CO3).
- Щелочные растворы. Оксид углерода 4 (формула CO2) вступает в реакцию со щелочами. При этом образуются средние и кислые соли (NaHCO3).
- Основные оксиды. При этих реакциях образуются соли карбонаты (CaCO3 и Na2CO3).
- Углерод. Когда оксид углерода 4 реагирует с горячим углем, образуется оксид углерода 2 (угарный газ), который может вызвать отравление. (CO2 + C = 2CO).
- Магний. Как правило, углекислый газ не поддерживает горение, только при очень высоких температурах он может реагировать с некоторыми металлами. Например, зажженный магний будет продолжать гореть в CO2во время окислительно-восстановительной реакции (2Mg + CO2 = 2MgO + C).

Качественная реакция оксида углерода 4 проявляется при пропускании его через известняковую воду (Ca(OH)2 или через баритовую воду (Ba(OH)2. Можно наблюдать помутнение и выпадение осадка. Если после этого продолжать дальше пропускать углекислый газ, то вода снова станет прозрачной, так как нерастворимые карбонаты преобразуются в растворимые гидрокарбонаты (кислые соли угольной кислоты).

Двуокись углерода также образуется при сжигании всего углеродсодержащего топлива, такого, как метан (природный газ), нефтяные дистилляты (бензин, дизельное топливо, керосин, пропан), уголь или древесина. В большинстве случаев вода также выделяется.
Углекислый газ (двуокись углерода) состоит из одного атома углерода и двух атомов кислорода, которые удерживаются вместе ковалентными связями (или делением электронов). Чистый углерод очень редок. Он встречается в природе только в виде минералов, графита и алмаза. Несмотря на это, он является строительным блоком жизни, который в сочетании с водородом и кислородом образует основные соединения, из которых состоит все на планете.
Такие углеводороды, как уголь, нефть и природный газ - это соединения, состоящие из водорода и углерода. Этот элемент содержится в кальците (CaCo3), минералах в осадочных и метаморфических породах, известняке и мраморе. Это элемент, который содержит все органические вещества - от ископаемого топлива до ДНК.
fb.ru
С чем реагируют основные оксиды?
Основные оксиды реагируют: 1. с водой, если металл, образующий оксид, стоит в ряду напряжений ДО магния. При этом образуется основание (щёлочь) . 2. с кислотами и кислотными оксидами с образованием солей. (см. предыдущий ответ) 3. С водородом, если металл не реагирует с водородом; в результате образуется металл и вода
С кислотами, с кислотными оксидами.
Основные оксиды реагируют с кислотными оксидами, образуя соли. Эти реакции требуют нагревания, поэтому возможность их протекания определяется термической устойчивостью соли. Термически более устойчивы соли щелочных и щелочно-земельных металлов, поэтому оксиды этих металлов реагируют с большинством кислотных оксидов: Na2O + CO2 t Na2CO3 CaO + CO2 t Ca CO3 K2O + SO3 t K2 SO4 3 BaO + P2O5 t Ba3 (PO4)2 CaO + SiO2 t CaSiO3 Соли остальных металлов термически менее устойчивы и в условиях синтеза полностью или частично разлагаются. Например, нельзя получить ZnCO3 и FeCO3 по реакциям ZnO + CO2 и FeO + CO2, поскольку уже при температуре = 500С эти карбонаты разлагаются. Основные оксиды образуют соли при сплавлении с амфотерными оксидами. K2O + Al2O3 t 2KAlO2 метаалюминат калия Na2O + ZnO t Na2ZnO2 цинкат натрия MgO + Al2O3 t Mg(AlO2)2 метаалюминат магния 3. отношение к кислотам и основаниям. Основные оксиды реагируют только с кислотами, т. е. с веществами, химическая сущность которых противоположна таковой для основных оксидов. В данных реакциях образуется соль и вода. K2O + h3SO4 t K2SO4 + h3O CuO + 2HNO3 t Cu(NO3)2 + h3O 3CaO + 2h4PO4 t Ca3(PO4)2 + 3 h3O При сплавлении основные оксиды активных металлов реагируют с амфотерными основаниями. Na2O + Al(OH)3 t 2NaAlO2 + 3 h3O CaO + Zn(OH)2 t CaZnO2 + h3O
1) основный оксид + вода = щелочь 2) основный оксид + кислота = соль + вода 3) основный оксид + амфотерный оксид = соль 4) основный оксид + кислотный оксид = соль
touch.otvet.mail.ru
Оксид кремния (IV) » HimEge.ru
В природе:
SiO2 — кварц, горный хрусталь, аметист, агат, яшма, опал, кремнезём (основная часть песка)Al2O3 •2SiO2 • 2h3O — каолинит (основная часть глины)K2O • Al2O3 • 6SiO2 — ортоклаз (полевой шпат)
Физические свойстваТвёрдое, тугоплавкое вещество, t°пл.= 1728°C, t°кип.= 2590°C, атомная кристаллическая решетка.
Химические свойства оксида кремния
SiO2 — кислотный оксид, ему соответствует кремниевая кислота Н2SiO31) При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов с образованием солей — силикатов:
SiO2 + CaO → CaSiO3
SiO2 + 2NaOH → Na2SiO3 + h3O
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + K2CO3 → K2SiO3 + CO2
2) С водой не реагирует
3) С плавиковой кислотой (гексафторкремниевая кислота):SiO2 + 4HF → SiF4 + 2h3OSiO2 + 6HF → h3[SiF6] + 2h3O(реакции лежат в основе процесса травления стекла)
Окислительно — восстановительные реакции
Взаимодействие с металлами
При температуре выше 1000 °С реагирует с активными металлами,при этом образуется кремний:
SiO2 + 2Mg → Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg → Mg2Si + 2MgO.
Взаимодействие с неметаллами
Реагирует с водородом:
SiO2 + 2Н2 → Si + 2Н2O.
Взаимодействует с углеродом:
SiO2 + 3С → SiС + 2СO.

himege.ru
CO2 + Nh4 = ? уравнение реакции
В результате взаимодействия диоксида углерода с гидратом аммиака (CO2 + Nh4 = ?) происходит образование гидрокарбоната аммония. Молекулярное уравнение имеет следующий вид:
![Rendered by QuickLaTeX.com \[ CO_2 + (NH_3 \cdot H_2O) \rightarrow NH_4HCO_3.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0ebb436258ca0fce13c1b7d2fa308b25_l3.png)
Диоксид углерода 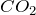 или углекислый газ при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.Химически
или углекислый газ при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.Химически 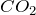 инертен, что обусловлено высокой энергией связи
инертен, что обусловлено высокой энергией связи 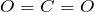 . С сильными восстановителями при высоких температурах
. С сильными восстановителями при высоких температурах 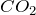 проявляет окислительные свойства. Углем он восстанавливается до угарного газа:
проявляет окислительные свойства. Углем он восстанавливается до угарного газа:
![Rendered by QuickLaTeX.com \[CO_2 + C \rightarrow 2CO (1000^{0}C).\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1630a023b026911360bd4a6a2d76fde0_l3.png)
Магний, зажженный на воздухе, продолжает гореть и в атмосфере 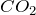 :
:
![Rendered by QuickLaTeX.com \[CO_2 + 2Mg \rightarrow 2MgO + C.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cc9a8ed24d2c86327c4049f97934aa41_l3.png)
Углекислый газ проявляет кислотные свойства: реагирует со щелочами, гидратом аммиака. Восстанавливается водородом.
![Rendered by QuickLaTeX.com \[CO_2 + NaOH_dilute \rightarrow NaHCO_3;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d61c4265649d62b0c2c4149f0d25fc74_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + NH_3\cdotH_2O \rightarrow NH_4HCO_3;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c378463792f769703aca9da6e75e6432_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + 4H_2 \rightarrow CH_4 + 2H_2O (200^{0}C, kat = Cu_2O).\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-512d5869c863fd2a4436a6db270c7e65_l3.png)
В лабораториях диоксид углерода обычно получают, действуя на мрамор 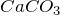 соляной кислотой в аппарате Киппа:
соляной кислотой в аппарате Киппа:
![Rendered by QuickLaTeX.com \[ CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2_gas.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ecb25e3841d9bd6cb60baa8bda8d2ffa_l3.png)
В промышленности большие количества диоксида углерода получают при обжиге известняка:
![Rendered by QuickLaTeX.com \[ CaCO_3 \rightarrow CaO + CO_2_gas.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5325e0bec88e95b91b0f89dfde58f771_l3.png)
Углекислый газ используется в пищевой промышленности в качестве консерванта и разрыхлителя. Основной компонент для заправки огнетушителей. Нашел применение в медицине, при производстве пневматического оружия и в авиамоделировании.
ru.solverbook.com
Что с чем реагирует? (Химия)
Основные оксиды Основные оксиды - это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие: K2O (окись калия), CaO (окись кальция), FeO (окись железа 2-валентного). Рассмотрим химические свойства оксидов на примерах 1. Взаимодействие с водой: - взаимодействие с водой с образованием основания (или щёлочи) CaO+h3O = Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!) 2. Взаимодействие с кислотами: - взаимодействие с кислотой с образованием соли и воды (раствор соли в воде) CaO+h3SO4 = CaSO4+ h3O (Кристаллы этого вещества CaSO4 известны всем под названием "гипс"). 3. Взаимодействие с кислотными оксидами: образование соли CaO+CO2=CaCO3 (Это вещество известно всем - обычный мел!) Кислотные оксиды Кислотные оксиды - это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами. Примерами кислотных окислов могут быть: CO2 (всем известный углекислый газ), P2O5 - оксид фосфора (образуется при сгорании на воздухе белого фосфора), SO3 - триокись серы - это вещество используют для получения серной кислоты. - химическая реакция с водой CO2+h3O=h3CO3 - это вещество - угольная кислота - одна из слабых кислот, её добавляют в газированную воду для "пузырьков" газа. С повышением температуры растворимость газа в воде уменьшается, а его излишек выходит в виде пузырьков. - реакция с щелочами (основаниями): CO2+NaOH=Na2CO3 - образовавшееся вещество (соль) широко используется в хозяйстве. Её название - кальцинированная сода или стиральная сода, - отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую! - реакция с основными оксидами: CO2+MgO=MgCO3 - получившая соль - карбонат магния - ещё называется "горькая соль". Амфотерные оксиды Амфотерные оксиды - это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами). Наиболее частое применение слово "амфотерный" в нашем случае относится к оксидам металлов. Примером амфотерных оксидов могут быть: ZnO - окись цинка (белый порошок, часто применяемый в медицине для изготовления масок и кремов), Al2O3 - окись алюминия (называют еще "глинозёмом"). Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например: - реакция с кислотным оксидом: ZnO+h3CO3 = ZnCO3 + h3O - Образовавшееся вещество - раствор соли "карбоната цинка" в воде. - реакция с основаниями: ZnO+2NaOH=Na2ZnO2+h3O - полученное вещество - двойная соль натрия и цинка.
touch.otvet.mail.ru
SO3 + CO2 = ? уравнение реакции
Реакция взаимодействия между оксидами серы (VI) и углерода (IV) (SO3 + CO2 = ?) невозможна, поскольку оба этих соединения обладают кислотными свойствами.Оксид серы (VI) (cерный ангидрид) производится в гигантских промышленных масштабах каталитическим окислением 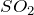 с целью получения серной кислоты. Он образуется также при термическом распаде сульфатов и пиросульфатов:
с целью получения серной кислоты. Он образуется также при термическом распаде сульфатов и пиросульфатов:
![Rendered by QuickLaTeX.com \[ Na_2S_2O_7 \rightarrow Na_2SO_4 + SO_3_{gas}.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-37f304dc3e9041db5761eb59021d1f12_l3.png)
Серный ангидрид – одно из самых реакционноспособных соединений. Он проявляет окислительные свойства, например превращает уголь в углекислый газ:
![Rendered by QuickLaTeX.com \[ 2SO_3 + C \rightarrow 2SO_2 + CO_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-573eee9c900b5fc2bd47313dba651c51_l3.png)
Особенности взаимодействия 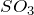 с галогенводородами связаны с ростом восстановительных свойств в ряду HCl – HBr – HI. Окислительные свойства
с галогенводородами связаны с ростом восстановительных свойств в ряду HCl – HBr – HI. Окислительные свойства 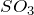 усиливаются с ростом температуры. При слабом нагревании
усиливаются с ростом температуры. При слабом нагревании 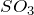 реагирует с газообразным HCl, образуя хлорсульфоновую кислоту
реагирует с газообразным HCl, образуя хлорсульфоновую кислоту 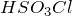 :
:
![Rendered by QuickLaTeX.com \[ SO_3 + HCl \rightarrow HO(Cl)SO_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2676f7c017fd076a1aa2c5dfe0f1b273_l3.png)
При повышении температуры HCl восстанавливает 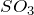 до
до 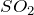 с одновременным образованием
с одновременным образованием 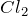 . При действии на HBr триоксида серы при
. При действии на HBr триоксида серы при 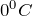 выделяются
выделяются 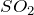 и свободный бром:
и свободный бром:
![Rendered by QuickLaTeX.com \[ 2SO_3 + 2HBr \rightarrow SO_2_gas + Br_2 + H_2SO_4.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3f7054221d2eedb0d444f33083c33026_l3.png)
Иодистым водородом 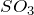 восстанавливается до
восстанавливается до 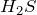 даже при охлаждении ниже
даже при охлаждении ниже 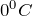 :
:
![Rendered by QuickLaTeX.com \[ SO_3 + 8HI \rightarrow H_2S_gas + 4I_2 + 3H_2O.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9e91792f9840ebf5e3a703cb3cff7640_l3.png)
Серный ангидрид бурно взаимодействует с водой с выделением большого количества теплоты. Термически неустойчив. Его термическая диссоциация на 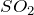 и
и 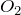 начинается при
начинается при 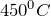 , а при
, а при 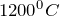 в газовой фазе полностью отсутствуют молекулы
в газовой фазе полностью отсутствуют молекулы 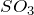 .
.
ru.solverbook.com




















