Ацетилен: химические свойства, получение, применение, меры предосторожности. Химические свойства ацетилена
21. Ацетилен и его гомологи
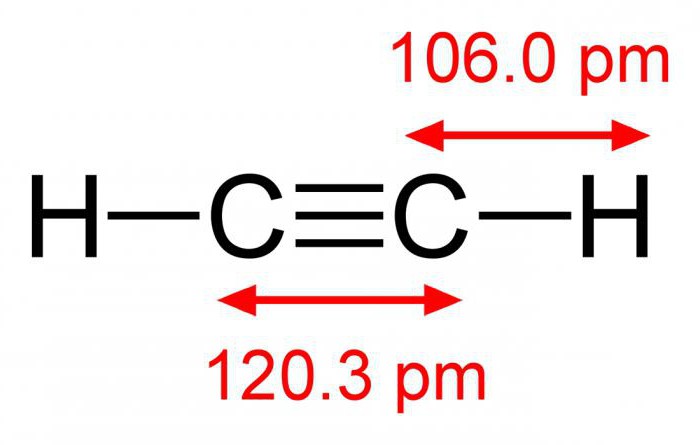
Ацетилен – это непредельный углеводород, который содержит тройную связь, состоящую из одной δ-связи и двух π-связей.
Особенности строения:
1) первый представитель ряда ацетилена – бесцветный газ.
Особенности бесцветного газа:
а) немного растворим в воде;
б) его молекулярная формула С2Н2;
2) в молекуле ацетилена еще на два атома водорода меньше, чем в молекуле этилена;
3) π-связь уступает по прочности основной δ-связи, поэтому и по месту π-связей могут проходить реакции окисления и присоединения.
Структурная формула ацетилена: НС≡СН.
1) тройная связь в молекуле ацетилена означает, что атомы углерода в ней соединены тремя парами электронов;
2) исследования строения молекулы ацетилена показывают, что атомы углерода и водорода в молекуле ацетилена расположены на одной прямой;
3) молекула ацетилена имеет линейное строение;
4) атомы углерода соединены между собой одной δ-связью и двумя π-связями.
Особенности строения молекулы ацетилена:
1) в такой молекуле каждый атом углерода соединен δ-связями только с двумя другими атомами (атом углерода и атом водорода) и в гибридизации здесь участвуют лишь два электронных облака – одного s-электрона и одного р-электрона.
Это случай sр-гибридизации.
Суть состоит в том, что два гибридных облака, которые образуются в виде несимметричных объемных восьмерок, стремятся максимально удалиться друг от друга и устанавливают связи с другими атомами во взаимно противоположных направлениях под углом 180°;
2) облака двух других р-электронов не участвуют в гибридизации.
Они сохраняют форму симметричных объемных восьмерок и при боковом перекрывании с подобными облаками другого углеродного атома образуют две π-связи.
Гомологи ацетилена:
1) подобно метану и этилену, ацетилен начинает собой гомологический ряд;
2) это ряд ацетиленовых углеводородов с одной тройной связью между атомами углерода в молекуле;
3) согласно систематической номенклатуре название таких углеводородов образуются путем замены суффикса – ан соответствующих предельных углеводородов на – ин;
4) как и этиленовые углеводороды, атомы углерода нумеруются начиная с того конца, к которому ближе кратная (тройная) связь:
а) этин СН≡СН;
б) бутин-1 СН≡С-СН2-СН3;
в) бутин-2 СН3-С≡С-СН3.
Особенности изомерии: а) обусловлена разветвлением углеродного скелета; б) характерное положение тройной связи; в) помогает в получении и использовании ацетилена в различных сферах.
22. Химические свойства ацетилена
1) ацетилен данного ряда углеводородов имеет большое практическое значение;
2) в отличие от метана и этилена, ацетилен горит ярким пламенем.
Примеры горения ацетилена: сварочные работы на стройках, в мастерских, на заводах.
Во всех этих случаях не видно образования копоти.
В данном случае: а) частички углерода сильно раскаляются в средней части пламени; б) придают ему яркость; в) в конечном итоге сгорают полностью.
При сварочных работах вместо воздуха используется кислород. При этом достигается полное сгорание ацетилена, возрастает температура пламени до 3000 °C. Смеси ацетилена с воздухом и кислородом взрывоопасны;
3) π-связь уступает по прочности основной δ-связи;
4) по месту π-связей могут проходить реакции присоединения и окисления.
Если в цилиндр, заполненный ацетиленом, налить раствор перманганата калия, раствор быстро обесцветится;
5) ацетилен, как и этилен, легко окисляется;
6) из реакций присоединения для ацетилена характерно взаимодействие с бромом.
Две стадии реакции присоединения при взаимодействии ацетилена с бромом:
1) сначала бром присоединяется по месту одной π-связи и образуется 1,2-дибромэтен: СН = СН + Вr2 → ВrСН=СНВr;
2) затем присоединяется вторая молекула брома по второй π-связи, продуктом реакции является 1,1,2,2-тетрабромэтан: ВrСН=СНВr + Вг2 → Вr2СН– СНВr2;
3) в присутствии катализатора (платины, никеля) к ацетилену может присоединяться водород.
При этом ацетилен сперва превращается в этилен, а затем в этан:
4) при присоединении хлороводорода по одной из π-связей образуется газообразное вещество хлорэтен (хлорвинил). Катализатором данной реакции является хлорид ртути:
5) присоединение воды (гидратация) происходит в присутствии катализатора Hg2+ в кислой среде (реакция М.Г. Кучерова). При этом ацетилен образует ацетальдегид, а его гомологи – соответствующие кетоны:
studfiles.net
Химические свойства ацетилена, основные химические реакции, применение
Синтетический каучук, этиловый спирт, уксусная кислота, поливинилхлоридные смолы, бензол – это далеко не полный перечень важнейших химических соединений. Их производит промышленность органического синтеза. Получают эти продукты из ацетилена. Химические свойства ненасыщенных углеводородов с тройной связью, к которым относится данное вещество, обуславливают их способность к реакциям присоединения, окисления и полимеризации. Отдельно нужно сказать о высокой энергоемкости газа.

Поэтому этин в смеси с кислородом применяется в сварке металлических деталей. Они могут быть изготовлены из чугуна, стали и цветных металлов. Горение ацетилена можно контролировать, что является большим преимуществом. Вещество используют в качестве сырья для производства полимеров, растворителей, волокон и других ценных материалов. Наличие двойных связей в молекуле обеспечивает способность к присоединению атомов других химических элементов. При сгорании соединения выделяется много тепла. В нашей статье мы подробно изучим перечисленные выше химические свойства ацетилена, называемого еще этином, а также выясним способы получения его в промышленности.
Как строение молекулы обуславливает свойства органического вещества
Линейная молекула этина содержит в своем составе два атома углерода, связанных между собой одной сигма- и двумя пи-связями. Углеродные атомы находятся в состоянии sp-гибридизации. Два атома водорода вместе с углеродным скелетом располагаются в плоскости молекулы, а двойные связи ориентированы во взаимно перпендикулярных плоскостях. Такие реакции ацетилена, как окисление бромной воды или присоединение галогеноводородов, происходят по месту разрыва пи-связей. По сравнению с веществами ряда этилена, эти процессы протекают у алкинов намного активнее. Это обусловлено присутствием в их молекулах тройной связи. Она же объясняет и тот факт, что реакция присоединения осуществляется в две стадии: сначала образуются соединения ряда этена, затем – конечный продукт, относящийся к предельным углеводородам или их галогенопроизводным.
Физическая характеристика и получение
Агрегатная форма этина при обычных условиях – газ. Ацетилен легче воздуха и плохо растворяется в воде. Его формула – C2h3, молекулярная масса – 26 г/моль. Вещество кипит при температуре порядка 83,8 °C. Как любой газ, может сжиматься под давлением, но процесс сопровождается взрывом. Соединение очень энергоемко, удельная теплота сгорания равна 14000 ккал/м3. Ацетилен получают из карбида кальция или этана.
Основной и экономически выгодный промышленный способ получения углеводорода – это пиролиз. Он имеет несколько разновидностей, среди которых наиболее перспективными считаются гомогенный и окислительный процессы. Исходным сырьем в них служит метан, молекулы которого дегидрируют. Достаточно давно в химии применяют карбидный метод. Здесь реагируют между собой карбид кальция и вода. Ацетилен, полученный этим способом, что очень важно, практически не содержит примесей. Однако сам процесс энергоемок и требует больших расходов электроэнергии.
Реакция гидрирования
Примером гетерогенной каталитической реакции, характерной для непредельных углеводородов с тройной связью между атомами углерода, может служить взаимодействие их с водородом. Нагревание и наличие никелевого катализатора – это главные условия проведения гидрирования. Как мы уже говорили ранее, для химических свойств ацетилена присущи реакции присоединения. Они проходят в два этапа.

Сначала происходит разрыв одной пи-связи и к свободным валентностям углеродных атомов присоединяются два атома водорода. Образуется алкен, в данном случае – этилен. Затем происходит разрушение одной непредельной связи в его молекуле и возникает предельное соединение – этан. Ацетилен, как мы видим, в результате гидрирования полностью утратил двойные связи и превратился в насыщенный углеводород.
Качественная реакция на этин
В органической химии применяют реакции, с помощью которых определяют присутствие в веществе определенного комплекса атомов или вида химической связи. Они называются качественными. Чтобы доказать в молекулах алкинов наличие двух непредельных пи-связей, используют такой реактив, как бромная вода. Ацетилен пропускают через бурый раствор Br2 и наблюдают его обесцвечивание. Получают продукт – тетрабромэтан, который относится к веществам – галогенопроизводным насыщенных углеводородов.
Поливинилхлоридные смолы
Важное практическое значение имеет реакция присоединения к этину хлороводорода, которая на первой стадии завершается образованием хлорвинила. Его молекулы сохраняют в своем составе двойную связь, что обеспечивает их способность к соединению друг с другом и формированию полимера.

Химические свойства ацетилена, в особенности реакция полимеризации его производного – хлорвинила, обеспечили возможность создания целой группы веществ с уникальными техническими характеристиками. Например, термовиль и фибровиль – волокна, применяемые для получения сверхпрочных тканей, используемых в пошиве спецодежды. Современные строительные, дренажные и отделочные работы невозможно представить без поливинилхлоридных труб, пенопластов и напольных покрытий. Они легкие, прочные, устойчивые к коррозии и значительно дешевле изделий из натуральных материалов: металла или древесины.
Реакция М. Г. Кучерова
Говоря о хорошо известных химических свойствах вещества, например, реакциях полимеризации, присоединения или горения ацетилена, мы упоминали о том, что газ практически нерастворим в воде. Однако в присутствии нитрата или сульфата ртути в качестве катализатора происходит реакция, впервые проведенная еще в XIX веке известным российским ученым М. Г. Кучеровым. В ней продуктом взаимодействия между водой и этином является уксусный альдегид. Он, в свою очередь, относится к соединениям, наиболее востребованным в промышленности, так как служит сырьем для получения этилового спирта в реакции восстановления.

Если же ацетальдегид окислить, то получим еще одно важное органическое вещество – уксусную кислоту. В последнее время реакция М. Г. Кучерова применяется в меньших масштабах по причине токсичности используемого катализатора. Сейчас все чаще в качестве исходного сырья используют этан. Ацетилен получают в результате его дегидрогенизации.
В нашей статье мы рассмотрели основные химические свойства и получение ацетилена, а также его применение в промышленности.
fb.ru
химические свойства, получение, применение, меры предосторожности :: SYL.ru
Ацетилен (или по международной номенклатуре - этин) - это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена - C2h3. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Получение
Все методы промышленного получения ацетилена сходятся к двум типам: гидролиз карбида кальция и пиролиз различных углеводородов. Последний требует меньших энергозатрат, но чистота продукта довольно низкая. У карбидного метода - наоборот.
Суть пиролиза заключается в том, что метан, этан или другой легкий углеводород при нагреве до высоких температур (от 1000 °C) превращается в ацетилен с выделением водорода. Нагрев может осуществятся электрическим разрядом, плазмой или сжиганием части сырья. Но проблема состоит в том, что в результате реакции пиролиза может образовываться не только ацетилен, но и еще множество разных продуктов, от которых необходимо впоследствии избавляться.
2Ch5 → C2h3 + 3h3
Карбидный метод основан на реакции взаимодействия карбида кальция с водой. Карбид кальция получают из его оксида, сплавляя с коксом в электропечах. Отсюда и такой высокий расход энергии. Зато чистота ацетилена, получаемого таким способом, крайне высока (99,9 %).
CaC2 + h3O → C2h3 + Ca(OH)2
В лаборатории ацетилен также можно получить дегидрогалогенированием дигалогенпроизводных алканов с помощью спиртового раствора щелочи.
Ch3Cl-Ch3Cl + 2KOH → C2h3 + 2KCl + 2h3O
Физические свойства ацетилена
Ацетилен - это газ без цвета и запаха. Хотя примеси могут давать ему чесночный запах. Практически не растворим в воде, немного растворим в ацетоне. При температуре -83,8 °C сжижается.
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
Реакции присоединения:
- Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.
- Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.
- Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.
- Присоединение синильной кислоты.
CH≡CH + HCN → Ch3=CH-CN
Реакции замещения:
- Взаимодействие ацетилена с металл-органическими соединениями.
CH≡CH + 2C2H5MgBr → 2C2H6 + BrMgC≡CMgBr
- Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + h3
- Взаимодействие с комплексными солями меди и серебра.
- Взаимодействие с амидом натрия.
CH≡CH + 2NaNh3 → NaC≡CNa + 2Nh4
Реакции полимеризации:
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор - соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл - циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.
Это далеко не все химические свойства ацетилена.
Применение
Структурная формула ацетилена указывает нам на довольно прочную связь между атомами углерода. При ее разрыве, например при горении, выделяется очень много энергии. По этой причине ацетиленовое пламя обладает рекордно высокой температурой - около 4000 °C. Его используют в горелках для сварки и резки металла, а также в ракетных двигателях.
Пламя горения ацетилена имеет также очень высокую яркость, поэтому его часто используют в осветительных приборах. Используется он и во взрывотехнике. Правда, там применяется не сам ацетилен, а его соли.
Как видно из разнообразных химический свойств, ацетилен может применяться как сырье для синтеза других важных веществ: растворителей, лаков, полимеров, синтетических волокон, пластмасс, органического стекла, взрывчатых веществ и уксусной кислоты.
Безопасность
Как уже говорилось, ацетилен - огнеопасное вещество. С кислородом или воздухом он способен образовывать крайне легковоспламеняющиеся смеси. Чтобы вызвать взрыв, достаточно одной искры от статического электричества, нагрева до 500 °C или небольшого давления. При температуре 335 °C чистый ацетилен самовоспламеняется.
Из-за этого ацетилен хранят в баллонах под давлением, которые наполнены пористым веществом (пемза, активированный уголь, асбест). Таким образом, ацетилен распределяется по порам, уменьшая риск взрыва. Часто эти поры пропитывают ацетоном, из-за чего образуется раствор ацетилена. Иногда ацетилен разбавляют другими, более инертными газами (азот, метан, пропан).
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
www.syl.ru
химические свойства, получение, применение, меры предосторожности
Ацетилен (или по международной номенклатуре - этин) - это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена - C2h3. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Получение
Все методы промышленного получения ацетилена сходятся к двум типам: гидролиз карбида кальция и пиролиз различных углеводородов. Последний требует меньших энергозатрат, но чистота продукта довольно низкая. У карбидного метода - наоборот.
Суть пиролиза заключается в том, что метан, этан или другой легкий углеводород при нагреве до высоких температур (от 1000 °C) превращается в ацетилен с выделением водорода. Нагрев может осуществятся электрическим разрядом, плазмой или сжиганием части сырья. Но проблема состоит в том, что в результате реакции пиролиза может образовываться не только ацетилен, но и еще множество разных продуктов, от которых необходимо впоследствии избавляться.
2Ch5 → C2h3 + 3h3
Карбидный метод основан на реакции взаимодействия карбида кальция с водой. Карбид кальция получают из его оксида, сплавляя с коксом в электропечах. Отсюда и такой высокий расход энергии. Зато чистота ацетилена, получаемого таким способом, крайне высока (99,9 %).
CaC2 + h3O → C2h3 + Ca(OH)2
В лаборатории ацетилен также можно получить дегидрогалогенированием дигалогенпроизводных алканов с помощью спиртового раствора щелочи.
Ch3Cl-Ch3Cl + 2KOH → C2h3 + 2KCl + 2h3O
Физические свойства ацетилена
Ацетилен - это газ без цвета и запаха. Хотя примеси могут давать ему чесночный запах. Практически не растворим в воде, немного растворим в ацетоне. При температуре -83,8 °C сжижается.
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
Реакции присоединения:
- Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.

- Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.

- Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.

- Присоединение синильной кислоты.
CH≡CH + HCN → Ch3=CH-CN
Реакции замещения:
- Взаимодействие ацетилена с металл-органическими соединениями.
CH≡CH + 2C2H5MgBr → 2C2H6 + BrMgC≡CMgBr
- Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + h3
- Взаимодействие с комплексными солями меди и серебра.

- Взаимодействие с амидом натрия.
CH≡CH + 2NaNh3 → NaC≡CNa + 2Nh4
Реакции полимеризации:
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор - соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл - циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.

Это далеко не все химические свойства ацетилена.
Применение
Структурная формула ацетилена указывает нам на довольно прочную связь между атомами углерода. При ее разрыве, например при горении, выделяется очень много энергии. По этой причине ацетиленовое пламя обладает рекордно высокой температурой - около 4000 °C. Его используют в горелках для сварки и резки металла, а также в ракетных двигателях.
Пламя горения ацетилена имеет также очень высокую яркость, поэтому его часто используют в осветительных приборах. Используется он и во взрывотехнике. Правда, там применяется не сам ацетилен, а его соли.
Как видно из разнообразных химический свойств, ацетилен может применяться как сырье для синтеза других важных веществ: растворителей, лаков, полимеров, синтетических волокон, пластмасс, органического стекла, взрывчатых веществ и уксусной кислоты.
Безопасность
Как уже говорилось, ацетилен - огнеопасное вещество. С кислородом или воздухом он способен образовывать крайне легковоспламеняющиеся смеси. Чтобы вызвать взрыв, достаточно одной искры от статического электричества, нагрева до 500 °C или небольшого давления. При температуре 335 °C чистый ацетилен самовоспламеняется.
Из-за этого ацетилен хранят в баллонах под давлением, которые наполнены пористым веществом (пемза, активированный уголь, асбест). Таким образом, ацетилен распределяется по порам, уменьшая риск взрыва. Часто эти поры пропитывают ацетоном, из-за чего образуется раствор ацетилена. Иногда ацетилен разбавляют другими, более инертными газами (азот, метан, пропан).
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
www.nastroy.net
22. Химические свойства ацетилена. Шпаргалка по органической химии
22. Химические свойства ацетилена
1) ацетилен данного ряда углеводородов имеет большое практическое значение;
2) в отличие от метана и этилена, ацетилен горит ярким пламенем.
Примеры горения ацетилена: сварочные работы на стройках, в мастерских, на заводах.
Во всех этих случаях не видно образования копоти.
В данном случае: а) частички углерода сильно раскаляются в средней части пламени; б) придают ему яркость; в) в конечном итоге сгорают полностью.
При сварочных работах вместо воздуха используется кислород. При этом достигается полное сгорание ацетилена, возрастает температура пламени до 3000 °C. Смеси ацетилена с воздухом и кислородом взрывоопасны;
3) π-связь уступает по прочности основной δ-связи;
4) по месту π-связей могут проходить реакции присоединения и окисления.
Если в цилиндр, заполненный ацетиленом, налить раствор перманганата калия, раствор быстро обесцветится;
5) ацетилен, как и этилен, легко окисляется;
6) из реакций присоединения для ацетилена характерно взаимодействие с бромом.
Две стадии реакции присоединения при взаимодействии ацетилена с бромом:
1) сначала бром присоединяется по месту одной π-связи и образуется 1,2-дибромэтен: СН = СН + Вr2 → ВrСН=СНВr;
2) затем присоединяется вторая молекула брома по второй π-связи, продуктом реакции является 1,1,2,2-тетрабромэтан: ВrСН=СНВr + Вг2 → Вr2СН– СНВr2;
3) в присутствии катализатора (платины, никеля) к ацетилену может присоединяться водород.
При этом ацетилен сперва превращается в этилен, а затем в этан:
4) при присоединении хлороводорода по одной из π-связей образуется газообразное вещество хлорэтен (хлорвинил). Катализатором данной реакции является хлорид ртути:
5) присоединение воды (гидратация) происходит в присутствии катализатора Hg2+ в кислой среде (реакция М.Г. Кучерова). При этом ацетилен образует ацетальдегид, а его гомологи – соответствующие кетоны:
librolife.ru
Разработка урока по химии (10 класс)
Разработка урока по химии
10 класс
Урок 8
Тема урока: Алкины. Ацетилен, его получение пиролизом метана и карбидным способом. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация. Применение ацетилена на основе свойств. Реакция полимеризации винилхлорида. Поливинилхлорид и его применение.
Цели урока:
- Изучить общую формулу, номенклатуру, физические свойства представителей гомологического ряда алкинов, их строение, химические свойства первого представителя гомологического ряда алкинов - ацетилена, применение.
- Развить общеучебные компетенции, логическое мышление.
- Повысить познавательный интерес учащихся, показать важность знания органической химии.
Тип урока: УПНЗ
Информационно-методическое обеспечение: слайды, схемы, материалы коллекций, таблицы по теме урока.
Характеристика деятельности учащихся: фронтальная, индивидуальная, работа у доски.
Виды контроля: Опрос.
Ход урока
I. Организационный момент урока
II. Актуализация знаний
Опрос по основным понятиям:
Углеводороды
Насыщенные и ненасыщенные соединения
Алкины: формула ряда, первый представитель ряда, основные свойства, способы получения, применение.
III. Проверка домашнего задания
IV. Изложение нового материала
Алкины – непредельные углеводороды, молекулы которых помимо одинарных С-С- связей содержат одну тройную С≡С-связь.
Общая формула ряда – Сnh3n-2
Особенности номенклатуры алкинов
Принадлежность углеводорода к классу алкенов отражают суффиксом –ин:
С2Н2 CH≡CH этин (ацетилен)
С3Н4 CH≡C-СН3 пропин
С4Н6 CH≡C-СН2-СН3 бутин-1
и т.д.
Правила названия соединений остаются такими же, как и для алкенов, лишь суффикс заменяется на –ин.
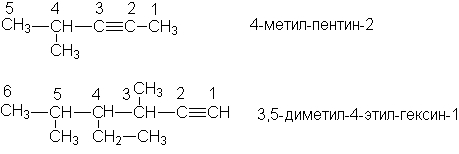
Изомерия алкенов
Структурная изомерия.
Изомерия строения углеродной цепи.
Изомерия положения тройной связи.
Межклассовая изомерия.
Приведите примеры изомеров каждого типа, назовите их!
Особенности строения молекул (на примере ацетилена)
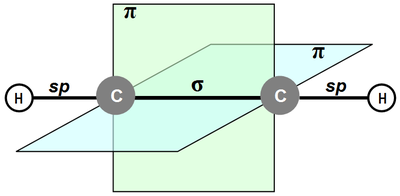
В ацетилене углерод находится в состоянии sp-гибридизации (в гибридизации участвуют одна s и 1 p-орбиталь). У каждого атома углерода в молекуле этилена – 2 гибридные sp-орбитали и по две негибридные р-орбитали. Оси гибридных орбиталей располагаются в одной плоскости, а угол между ними равен 180°.Такие орбитали каждого атома углерода пересекаются с аналогичными другого атома углерода и s-орбиталями двух атомов водовода, образуя σ-связи С-С и С-Н.
Схема образования σ-связей в молекуле ацетилена
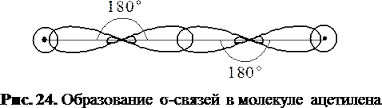
Четыре негибридные р-орбитали атомов углерода перекрываются во взаимноперпендикулярных плоскостях, которые расположены перпендикулярно к плоскости σ-связей. Так образуются две π-связи.
С≡С = σ + 2 π
Схема образования π-связей в молекуле этилена
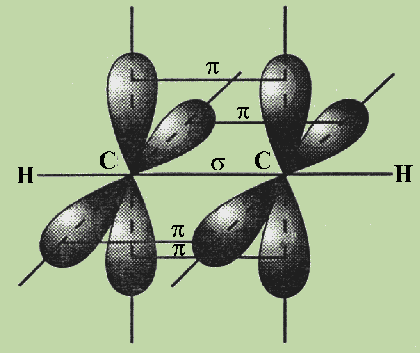
Строение молекулы ацетилена
Физические свойства
Ацетилен – газ, легче воздуха, малорастворим в воде, без запаха. С воздухом образует взрывоопасные смеси.
В ряду алкинов с увеличением молекулярной массы возрастает температура кипения.
Опишите физические свойства ацетилена в виде таблицы в тетради!
Получение
Способы получения ацетилена:
Из карбида кальция. (Лабораторный способ)
СаС2 + 2Н2О → С2Н2 ↑ + Са(ОН)2
Получение карбида кальция (в промышленности):
СаО + 3С СаС2 + СО↑
оксид кальция кокс карбид кальция
СаСО3 CaO + CO2
карбонат кальция оксид кальция
Термическое разложение метана.
2СН4 С2Н2 + 3Н2↑
Способы получения гомологов ацетилена – углеводородов ряда алкинов:
Дегидрогалогенирование - отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода:
Реакция идет под действием спиртового раствора щелочей на галогенпроизводные.
2Н5ОНСН3 - СВr2 - СН3 + 2КОН
→
СН3-С ≡ СН + 2КВr + 2Н2О,
2,2 – дибромпропан пропин
Химические свойства
Реакции присоединения
Взаимодействие с галогенами
Качественная реакция на наличие кратных связей – обесцвечивание бромной воды!
Реакции присоединения идут в две стадии.
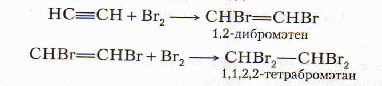
С водородом – гидрирование
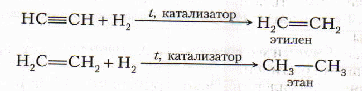
kt – Ni, Pt, Pd.
С галоенводородами

(1-хлорэтен) – винилхлорид
С водой - гидратация (реакция Кучерова).
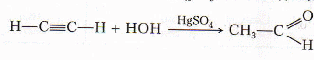
ацетальдегид
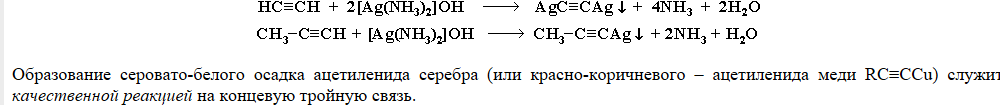
С металлами.
Продукт реакций – ацетилениды – малорастворимые, неустойчивые, взрывоопасные вещества!
Образование серовато-белого осадка ацетиленида серебра или красно-коричневого осадка ацетиленида меди – качественная реакция на концевую тройную связь!
Реакции окисления.
Горение.
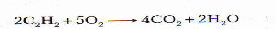
Реакция с раствором перманганата калия.
Обесцвечивание раствора перманганата калия (ярко-розовая окраска) – качественная реакция на кратные связи!
Продуктами реакции окисления могут быть разные вещества, если окисление полное – то, основные продукты реакции – углекислый газ и вода.

Реакции полимеризации.
Ацетилен может полимеризоваться в бензол и винилацетилен.
Полимеризация винилхлорида
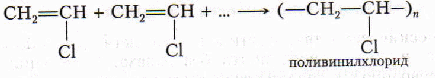
Из поливинилхлорида (ПВХ) получают прочную пластмассу, искусственную кожу, клеенку, диэлектрики и др.
Применение ацетилена
Сырье в органическом синтезе (производство волокон, красителей, лаков, лекарств, ПВХ, хлорорпренового каучука, уксусной кислоты, растворителей и др.)
При резке и сварке металлов.
V. Закрепление знаний.
Решение задач и упражнений
с.54 – упр.1,3,5,6.
с.55 – упр.8
с.55 – задачи 1.
VI. Рефлексия. Подведение итогов урока
VII. Домашнее задание
Параграф 13,
с. 55 – задачи 2, 3
Объясните отличия между строением молекул этилена и ацетилена.
Какой углеводород является ближайшим гомологом этина?
Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения, укажите условия протекания реакций, назовите продукты реакции:
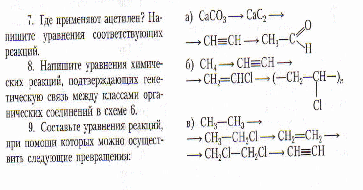
infourok.ru
Ацетилен, строение, физические и химические свойства — Информио
Дисциплина: Органическая химия
Тема: Ацетилен, строение, физические и химические свойства.
Учебная цель: Продолжить формирование у студентов понятия о кратных связях, познакомить с тройной связью между атомами углерода и её электронным строением. Сформировать представление о физических и химических свойствах ацетилена на основе его строения и в сопоставлении со свойствами этилена. Закрепить умения выводить формулы органических веществ по массовым долям элементов.
Развивающая цель: Продолжить развитие представлений о взаимном влиянии атомов в молекулах ацетиленовых углеводородов.
Воспитательная цель: Воспитание убеждённости в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде.
Оборудование: Мультимедийный проектор. Диск "Строение органических веществ", таблица "Строение С2Н2", карточки-задания, модели строения молекул ацетилена и этилена, пластилин.
Реактивы: CaC2, воронка делительная, колба 250 мл, оборудование для получения ацетилена, кристаллизатор со снегом, штатив, раствор KMnO4, Br2 /Н2О.
Ход урока
Опрос. 3 студентов работают у доски.
Карточка № 1
1. Какой объем водорода выделится при каталитическом получении дивинила из 1 м3бутана (н.у.).
2. Будут ли иметь цис- транс - формы каучуки СКД (дивиниловый) и фторкаучук.
доказать, написав цис- транс формы.
Карточка № 2
1. Перечислить основные направления в развитии производства синтетических каучуков. Назвать виды сырья для получения каучука (подтвердить уравнениями реакций).
Карточка № 3.
1. Вулканизация каучука (изобразить схемой).
(С места по карточкам работают 2 студентов).
Карточка № 4.
1. Свойства и строение натурального каучука.
Карточка № 5.
1. Дать определение диеновых углеводородов, перечислить их свойства.
Фронтальный опрос:
- Какие вам известные синтетические каучуки?
- В чем отличие каучуков стереорегулярного строения и нестереорегулярного? Примеры.
- Какие различия в свойствах резины и каучука вы можете отметить? Чем объяснить это различие?
- Что такое эбонит?
Подведение итогов опроса.
Изучение нового материала.
Беседа по вопросам.
- Как построена молекула С2Н4?
- Какой тип гибридизации электронных облаков углеродных атомов в молекуле этилена?
- Чем отличается сигма-связь от пи-связи?
- Какова длина связи С=С в молекуле этилена и валентный угол между направлениями связей?
Ацетилен.
Вывод молекулярной формулы ацетилена. Задачу студент решает у доски.
При горении 5,2 г газообразного вещества образовалось 8,96 л СО2 (н.у.) и 0,2 M h3O. Д (Н)=13. Найти молекулярную формулу вещества.
Ответ:молекулярная формула ацетилена - С2Н2.
Демонстрация электронной и структурной формул молекулы С2Н2, проволочной модели С2Н2. Студенты делают сравнения со строением молекулы этилена.
В молекуле ацетилена у каждого атома углерода по 1 электрону идет на образование сигма- связи и по 2 электрона на образование 2 пи-связей. Тип гибридизации -sp.
Самостоятельная работа: Студенты изготавливают из пластилина шаростержневую модель С2Н2.
Вопрос: Изменяется ли расстояние между атомами углерода по сравнению со связями С - С в этане , С=С в этилене С2Н4? (студенты показывают сближение атомов углерода, большее сплющивание шариков).
Для сравнения студенты заполняют самостоятельно таблицу. Один студент работает у доски.
| Углеводород | Тип связи | Длина связи | Валентный Угол | Тип гибридизации | Форма молекулы |
| Этан | С-С | 1,54 | 109° 28י | SP3 | Трёхмерная тетраэдрическая |
| Этилен | С=С | 1,34 | 120° | SP2 | Плоская |
| Ацетилен | С≡С | 1,2 | 180° | SP | Линейная |
После рассмотрения таблицы, студенты переходят к изучению физических и химических свойств ацетилена.
Демонстрация опытов.
Опыт 1. «Горящий снег». В кристаллизатор со снегом опускаем карбид кальция. Выделяющийся газ поджигаем.
Студенты самостоятельно записывают уравнение реакции получения ацетилена из карбида кальция и реакцию его горения.
СаС2 +НОН= С2Н2+ Са(ОН)2
С2Н2+О2=4СО2+2Н2О+Q
Ацетилен горит коптящим пламенем (повышенное содержание углерода в молекуле).
Опыт 2. Растворимость в воде.
Ацетилен пропускается через пробирку с Н2О, Наблюдение: выделение газа. Вода как бы кипит.
Вывод: ацетилен плохо растворим в воде.
Опыт 3. Окисление ацетилена водным раствором перманганата калия KMnО4.
Через подкисленный раствор KMnO4 попускаем ацетилен, происходит обесцвечивание раствора перманганата калия.
Вывод: ацетилен относится к непредельным углеводородам. Это качественная реакция на соединения с кратной связью.
Опыт 4. Обесцвечивание Br2 /Н2О ацетиленом.
Пропускаем ацетилен через бромную воду, она обесцвечивается.
Реакции присоединения идут по месту разрыва тройной связи.
Далее студенты работают с материалом учебника. Продолжают изучать химические свойства ацетилена.
Свойства аналогичны с этиленом, а есть ли отличие?
Влияние тройной связи на подвижность водорода в С2Н2.
Электронная плотность концентрируется между С-С связями и в С→H связи электронная плотность смещена к атому водорода. Если в ацетиленовых при тройной связи имеется атом водорода, в отличие от других атомов углеводородов, то они проявляет свойства очень слабых кислот в присутствии солей меди, серебра (AgNO3, Nh4, h3O).
H─C≡C─H → Ag+2[Ag(Nh4 )2]OH→AgC≡CAg↓+4Nh4+2h3O ацетиленид серебра
Серый осадок.
CaC2 ─ продукт замещения атомов водорода в молекуле ацетилена. Ацетилениды щелочных и щелочноземельных металлов называются карбидами.
R-C≡C-H + [Cu(Nh4)2]Cl → R-C≡C-Cu↓ + Nh5Cl +Nh4
Красный осадок.
Реакция полимеризации.
1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl2 и Nh5Cl ацетилен димеризуется, образуя винилацетилен:
Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
Закрепление пройденного материала.
- Перечислите физические свойства ацетилена.
- Перечислите химические свойства ацетилена.
- Назовите отличия химических свойств ацетилена от предельных и этиленовых углеводородов.
- Рассмотрим реакцию присоединения брома к С2Н2, которая идет по ионному механизму аналогично этилену.
Подведение итогов урока.
Литература:
- О.С. Габриелян Химия. 10 кл. Москва. Дрофа.
www.informio.ru