способ получения водорода из воды. Как из воды получить водород
Получение водорода электролизом воды.
Электролиз воды один из наиболее известных и хорошо исследованных методов получения водорода. Он обеспечивает получение чистого продукта (99,6-99,9%h3 ) в одну технологическую ступень. В производственных затратах на получение водорода стоимость электрической энергии составляет примерно 85%.
Электролиз воды один из наиболее известных и хорошо исследованных методов получения водорода [433]. Он обеспечивает получение чистого продукта (99,6—99,9 % Н2) в одну технологическую ступень. Экономика процесса в основном зависит от стоимости электроэнергии. В производственных затратах на получение водорода стоимость электрической энергии составляет примерно 85 % .
Этот метод получил применение в ряде стран, обладающих значительными ресурсами дешевой гидроэнергии. Наиболее крупные электрохимические комплексы находятся в Канаде, Индии, Египте, Норвегии, но созданы и работают тысячи более мелких установок во многих странах мира. Важен этот метод и потому, что он является наиболее универсальным в отношении использования первичных источников энергии. В связи с развитием атомной энергетики возможен новый расцвет электролиза воды на базе дешевой электроэнергии атомных электростанций. Ресурсы современной электроэнергетики недостаточны для получения водорода в качестве продукта для дальнейшего энергетического использования. Если электроэнергию получать за счет наиболее дешевой атомной энергии, то при КПД процесса получения электроэнергии, равном 40 % (в случае быстрых реакторов-размножителей) и КПД процесса получения водорода электролизом даже 80 %, полный КПД электролизного процесса составит 0,8-0,4 = 0,32, или 32 %. Далее, если предположить, что электроэнергия составляет 25 % полного производства энергии, а 40 % электроэнергии расходуется на электролиз, тогда вклад этого источника в общее энергообеспечение составит в лучшем случае 0,25Х X 0,4-0,32 = 0,032, или 3,2%. Следовательно, электролиз воды, как метод получения водорода для энергоснабжения может рассматриваться в строго ограниченных рамках. Однако как метод получения водорода для химической и металлургической индустрии его следует иметь на технологическом вооружении, поскольку при определенных экономических условиях он может быть использован в крупнопромышленном масштабе.
Электролиз с успехом может быть использован на гидростанциях или в тех случаях, когда тепловые и атомные электростанции имеют избыточные мощности, и получение водорода является средством для использования, хранения и накопления энергии. Для этой цели могут быть использованы мощные электролизеры производительностью до 1 млн. м3 водорода в сутки. На крупном заводе электролиза воды мощностью 450 т/сут и выше расход электроэнергии на 1 м3 водорода может быть доведен до 4—4,5 кВт-ч. При таком расходе электроэнергии в ряде энергетических ситуаций электролиз воды даже в современных условиях сможет стать конкурентоспособным методом получения водорода [435].
Электрохимический метод получения водорода из воды обладает следующими положительными качествами: 1) высокая чистота получаемого водорода – до 99,99% и выше; 2) простота технологического процесса, его непрерывность, возможность наиболее полной автоматизации, отсутствие движущихся частей в электролитической ячейке; 3) возможность получения ценнейших побочных продуктов – тяжелой воды и кислорода; 4) общедоступное и неисчерпаемое сырье – вода; 5) гибкость процесса и возможность получения водорода непосредственно под давлением; 6) физическое разделение водорода и кислорода в самом процессе электролиза.
Во всех процессах получения водорода разложением воды в качестве побочного продукта будут получаться значительные количества кислорода. Это даст новые стимулы его применения. Он найдет свое место не только как ускоритель технологических процессов, но и как незаменимый очиститель и оздоровитель водоемов, промышленных стоков. Эта сфера использования кислорода может быть распространена на атмосферу, почву, воду. Сжигание в кислороде растущих количеств бытовых отходов сможет решить проблему твердых отбросов больших городов.
Еще более ценным побочным продуктом электролиза воды является тяжелая вода – хороший замедлитель нейтронов в атомных реакторах. Кроме того, тяжелая вода используется в качестве сырья для получения дейтерия, который в свою очередь является сырьем для термоядерной энергетики.
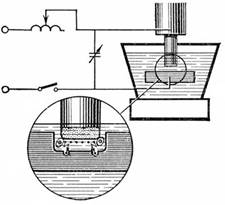
Электролитическое разложение воды.
2 h3O = 2 h3 + O2
Чистая вода практически не проводит тока, поэтому к ней прибавляются электролиты (обычно КОН). При электролизе водород выделяется на катоде. На аноде выделяется эквивалентное количество кислорода, который, следовательно, в этом методе является побочным продуктом.
Получающийся при электролизе водород очень чист, если не считать примеси небольших количеств кислорода, который легко удалить пропусканием газа над подходящими катализаторами, например над слегка нагретым палладированным асбестом. Поэтому его используют как для гидрогенизации жиров, так и для других процессов каталитического гидрирования. Водород, получаемый этим методом довольно дорог.
Похожие статьи:
poznayka.org
Разработан новый метод извлечения водорода из воды, работающий в 30 раз быстрее традиционного электролиза
Ученые из университета Глазго (University of Glasgow, UoG) разработали новый метод расщепления воды на кислород и водород, который представляет собой топливо для источников экологически чистой энергии, таких, как водородные топливные элементы. Но самое интересное заключается в том, что этот новый процесс не только более безопасен, но и способен обеспечить в 30 раз большую производительность по водороду, нежели другие существующие на сегодняшний день методы. И столь привлекательные показатели нового процесса позволяют рассматривать его в качестве решения вопроса хранения и транспортировки энергии, получаемой из возобновляемых источников, которая может храниться в виде водорода сколь угодно длительное время.
В природе вода расщепляется на составные части под воздействием солнечного света в результате процесса фотосинтеза. Выделяющийся при этом водород, вступая в реакцию с углекислым газом из атмосферы, образует цепочки органических соединений, из которых формируются ткани растущего растения. Получающийся при этом кислород является побочным продуктом и выбрасывается в окружающую среду, что дает возможность дышать всему живому на нашей планете. Процесс электрического расщепления воды, используемый для искусственного получения водорода, более энергоемок и опасен, нежели процесс естественного фотосинтеза. При проведении традиционного процесса электролиза (proton exchange membrane electrolyze, PEME) существует высокая вероятность смешивания водорода и кислорода, образующих взрывоопасный гремучий газ, и при этом требуются существенные дополнительные затраты энергии, идущей на разделение газов и очитку водорода от остаточных следов кислорода.
Процесс, разработанный исследовательской группой профессора Ли Кронина (Lee Cronin), лишен большинства вышеописанных недостатков традиционных процессов электролиза. В этом процессе не используются дорогостоящие катализаторы на базе драгоценных или редкоземельных металлов, эту роль выполняет жидкая «губка», так называемый окислительно-восстановительный посредник (redox mediator). Эта губка полностью поглощает выделяющийся свободный водород и образует полностью безопасное водородосодержащее неорганическое соединение. В ходе этого процесса выделяется лишь чистый свободный кислород, который без проблем сбрасывается в атмосферу.

Раствор окислительно-восстановительный посредника, химический состав которого по понятным причинам держится в тайне, изначально имеет синий цвет. При подаче на электроды устройства-электролизера электрического тока посредник начинает поглощать выделяющийся водород и его цвет, по мере насыщения, начинает сдвигаться к желтому цвету. А при полном насыщении посредника водородом он практически теряет каталитические свойства, что приводит к автоматическому прекращению процесса электролиза. Высвобождается связанный посредником водород достаточно просто, для этого требуется лишь поместить в раствор насыщенного посредника специальный катализатор. При этом скорость выделения чистого водорода в 30 раз превышает скорость выделения водорода в процессе традиционного PEME-электролиза.
Следует отметить, что получаемый в результате описанного выше процесса водород можно хранить и транспортировать в абсолютно безопасном виде, в виде концентрированного раствора насыщенного вещества-посредника. Также достаточно просто выделять связанный посредником водород и точно регулировать его количество, опуская в раствор катализатор, имеющий определенную площадь. К сожалению, некоторые характеристики, такие, как долговечность вещества-посредника, самопроизвольное выделение связанного водорода и т.п., вышеописанных процессов еще не до конца установлены и это требует проведения дополнительных исследований.
Профессор Кронин оценивает, что для доведения разработанных его группой технологий до уровня практического использования может потребоваться еще несколько лет исследований. И сейчас эта группа ищет заинтересованные организации, которые готовы вложить свои средства в эту перспективную разработку.
www.nanonewsnet.ru
способ получения водорода из воды - патент РФ 2521632
Изобретение может быть использовано в химической промышленности и при изготовлении стационарных и транспортных источников топлива. Восстанавливают оксид железа путем его термолиза при нагреве инертным газом с получением кислорода при температуре выше 1200°C и давлении выше 0.1 МПа. Затем железо окисляют потоком водяного пара, нагреваемым инертным газом, в емкости, попеременно заполняемой нагретыми инертным газом и водяным паром. Адсорбцией, или мембранным, или электрохимическим разделением выделяют водород как конечный продукт из потока водяного пара, а также кислород из потока инертного газа. Цикл окисления и восстановления оксида железа ведут в параллельных переключаемых секциях, соединенных по инертному газу и водяному пару. 8 з.п. ф-лы, 1 ил.
Рисунки к патенту РФ 2521632
Изобретение относится к способу получения водорода из воды и может быть использовано в химической промышленности, а также в системах аккумулирования и транспорта энергии и как источник топлива в транспортных и стационарных энергоустановках.
С начала 20-го века основная технология производства водорода из воды была основана на т.н. железо-паровом методе, по которому пар при 500-1000°С пропускают над железом: 3Fe+4Н 2О Fe3O4+4Н2+160,67 кДж. Получаемый этим методом водород обычно используют для гидрогенизации жиров и масел. Состав оксида железа зависит от температуры процесса; при <560°С преобладает Fe3O4, выше 560°С возрастает доля FeO. Поскольку восстановление исходного железа из образовавшихся оксидов железа обычно проводили коксом, углем или водяным газом (смесь СО и h3), то небольшую примесь СО в производимом водороде удаляли, пропуская нагретую смесь Н2+СО над катализатором. При этом СО превращается в метан СН4.
Fe3O4+4Н2+160,67 кДж. Получаемый этим методом водород обычно используют для гидрогенизации жиров и масел. Состав оксида железа зависит от температуры процесса; при <560°С преобладает Fe3O4, выше 560°С возрастает доля FeO. Поскольку восстановление исходного железа из образовавшихся оксидов железа обычно проводили коксом, углем или водяным газом (смесь СО и h3), то небольшую примесь СО в производимом водороде удаляли, пропуская нагретую смесь Н2+СО над катализатором. При этом СО превращается в метан СН4.
Известен способ получения водорода, включающий взаимодействие водяного пара с элементарным железом и/или с его низшим окислом в кипящем слое при 500-650°С, давлении 0.1-0.4МПа, регенерацию образующихся окислов железа контактированием их с твердым углеродосодержащим материалом при 800-1100°С с получением газов регенерации и восстановленных окислов железа и возврат последних на стадию взаимодействия, газы регенерации возвращают на стадию регенерации [патент РФ № 1125186, МПК С01В 3/10, опубл. 23.11.1984 г., БИ № 43, «Способ получения водорода», авторы Лебедев В.В. и др.]. Недостатками способа являются сложность процесса, низкая производительность, большие энергозатраты, а также расход твердого углеродосодержащего материала.
Известен также способ получения водорода, заключающийся в конверсии перегретого насыщенного водяного пара в реакторе с электродами, отличающийся тем, что в реактор периодически вводят железную проволоку, которую пропускают между электродами в среде перегретого насыщенного водяного пара, на электроды периодически подают электрический разряд напряжением 45 кВ и периодически производят взрыв проволоки на мельчайшие жидкие частицы металла, которые вступают в реакцию с парами воды, образуя окислы железа и газообразный водород [патент РФ № 2424973, МПК С01В 3/10, опубл. 27.07.2011, Бюл. № 21, «Способ получения водорода», авторы Носырев Д.Я., Плетнев А.И. - прототип]. Недостатками способа также являются сложность процесса, низкая производительность, большие энергозатраты, а также необходимость производства железной проволоки и электроэнергии высокого напряжения.
В патенте RU 2415072, опубл. 27.11.2010, изложен способ получения газообразного водорода из состава, предназначенного для получения газообразного водорода, включает в себя по весу 40-70% окиси кальция (СаО) в виде порошка, 2-20% хлорида кальция (CaCl2), хлорида магния (MgCl 2) или бикарбоната натрия (NaHCO3) в виде порошка, 6.7-30% алюминия или окиси алюминия (Al2O3 ) в виде порошка и 0.001-10% железа или магния в виде порошка, при котором 56 граммов окиси кальция (СаО) и 2 моля, то есть 36 граммов, воды (Н2О) вступают в реакцию для получения 2 граммов газообразного водорода (Н2). Объем 2 граммов газообразного водорода составляет 22,4 литра при температуре 0°С и 1 атмосфере (нормальное состояние), и, следовательно, 35,7 грамма (примерно 400 литров) газообразного водорода будет выработано из 1 кг окиси кальция. Недостатками способа также являются сложность процесса, низкая производительность, большие энергозатраты, а также расход твердого материала - окиси кальция (СаО). Для разложения (восстановления) оксидов металлов (кальций, цинк, марганец, железо, церий) предлагались различные солнечные печи, см., например, Thermodynamic Analysis of Cerium-based Oxides for Solar Thermochemical Fuel Production, Scheffe J., Steinfeld A. Energy & Fuels, Vol.26, pp.1928-1936, 2012, однако недостатком таких печей является крайне низкая объемная производительность, связанная с прохождением реакции разложения, в основном, на освещаемой солнцем поверхности, что ограничивает сферу применения такой технологии. Недостатком также является и необходимость поддержания крайне низкого давления в печи в связи с необходимостью применения кварцевого стекла для пропускания солнечной энергии внутрь печи.
Задача настоящего изобретения состоит в том, чтобы создать новый способ, позволяющий снизить тепловые затраты на процесс разложения воды, а также повысить производительность и экономичность технологии получения водорода.
Поставленная задача решается тем, что:
предложен способ получения водорода из воды, в котором проводят цикл окисления и восстановления оксида железа с получением водорода при окислении железа водяным паром, водород выделяют как конечный продукт из потока водяного пара, при этом восстановление оксида железа ведут путем его термолиза при нагреве инертным газом с получением кислорода, после чего железо окисляют потоком водяного пара, нагреваемым инертным газом, и его окисление водяным паром ведут в емкости, попеременно заполняемой нагретыми инертным газом и водяным паром.
Кроме того:
- нагрев инертного газа ведут в плазменной струе, или электронагревателями, или методом индукционного нагрева, или нагревом солнечной или ядерной энергией, или продуктами сгорания органического топлива,
- восстановление оксида железа ведут при температуре выше 1200°C и давлении выше 0.1 МПа, после чего выделение кислорода из потока инертного газа ведут адсорбцией, или мембранным или электрохимическим разделением,
- давление водяного пара выбирают в диапазоне от 0.1 до 1.0 МПа,
- часть тепла, необходимого для нагрева инертного газа, отводят от восстановленного оксида железа,
- отделение водорода от водяного пара после окисления железа ведут за счет адсорбции, или конденсации водяного пара, или мембранного разделения или электрохимическим процессом,
- путем регенеративного теплообмена изменяют температуры потоков инертного газа и водяного пара на входе и выходе из цикла окисления и восстановления оксида железа,
- цикл окисления и восстановления оксида железа ведут в параллельных переключаемых однородных по конструкции секциях, соединенных по инертному газу и водяному пару,
- в качестве инертного газа выбирают гелий, или аргон, или азот, или криптон или их смеси.
На чертеже дана одна из возможных схем реализации указанного способа, где 1 - нагретый гелий, 2 - термолизер, 3 - гелий-кислородная смесь, 4 - отделитель кислорода, 5 - кислород, 6 - охлажденный гелий, 7 - водяной пар, 8 - смесь водяного пара и водорода, 9 - регенеративный теплообменник нагрева водяного пара, 10 - отделитель водорода, 11 - водород, 12 - регенеративный теплообменник нагрева гелия, 13 - отбор тепла от оксида металла.
Примером реализации изобретения служит способ получения водорода из воды, описанный ниже.
В излагаемом примере осуществления изобретения предлагается, в качестве примера, использовать гелий 1 в качестве инертного газа и процесс термолиза оксидов железа: Fe2O 3 2FeO+1/2O2 (термолиз свыше 1300-1400°C) для получения кислорода 5.
2FeO+1/2O2 (термолиз свыше 1300-1400°C) для получения кислорода 5.
Как известно, для реакций типа FeOx+h3O Fe2O4 (или Fe2O3 )+h3 (технология типа HyGas) окисление Fe (или FeO x) идет по зависимости:
Fe2O4 (или Fe2O3 )+h3 (технология типа HyGas) окисление Fe (или FeO x) идет по зависимости:
w2t -1=2.4·1014 exp(-84300/RT), где
w - приращение веса металла вследствие его окисления (г/м 2).
Такой параболический характер имеют гетерогенные реакции, лимитируемые диффузией в конденсированной фазе. Аналогичный характер имеет и зависимость разложения гематита, что позволяет охарактеризовать особенности реализации изобретения применительно к процессам окисления вюстита до гематита в термолизере 2 с получением смеси водяного пара и водорода 8 из водяного пара 7, подаваемого в термолизер 2.
На первой стадии процесса гелий 1, нагретый до температуры 1500°C, поступает в термолизер 2, заполненный оксидом железа в основном в форме гематита, и, нагревая гематит до температуры 1300-1400°C, разлагает его до вюстита и кислорода, который смешивается с гелием и выводится из термолизера 2 в виде охлажденной до 1000-1100°C гелий-кислородной смеси 3, поступающей, например, в высокотемпературный электрохимический отделитель кислорода 4, в котором за счет кислородной диффузии через керамический электролит производят отделение кислорода 5 от потока гелия 6, поступающего на повторный нагрев (на чертеже не показано). В высокотемпературном электрохимическом отделителе кислорода 4 при подводе электрической энергии осуществляют подачу гелий-кислородной смеси 3 на вход катодного пространства высокотемпературного электрохимического процесса, в то время как кислород выделяют в анодном пространстве, отделенном от катодного электролитическим слоем, выполненном из кислородпроводящей керамики, например, SrFeCo0.5O3.25- , как она описана в Department of Chemistry, University of Houston, Houston, TX 77204-5641, USA, Solid State lonics DOI: 10.1016/S0167-2738(98)00106-4, т.е. такой материал, который имеет высокий уровень ионной проводимости и сравнимый (или больший) уровень электронной проводимости. Акцепторное допирование катионной подрешетки обеспечивает появление вакансий кислорода и, следовательно, обеспечивает высокие значения кислородно-ионной проводимости, а наличие в структуре элемента, способного к легкой смене степени окисления - высокую электронную проводимость. Можно предложить в качестве перспективных материалов также некоторые составы твердых растворов, например CaTi0.8Fe0.2O3-
, как она описана в Department of Chemistry, University of Houston, Houston, TX 77204-5641, USA, Solid State lonics DOI: 10.1016/S0167-2738(98)00106-4, т.е. такой материал, который имеет высокий уровень ионной проводимости и сравнимый (или больший) уровень электронной проводимости. Акцепторное допирование катионной подрешетки обеспечивает появление вакансий кислорода и, следовательно, обеспечивает высокие значения кислородно-ионной проводимости, а наличие в структуре элемента, способного к легкой смене степени окисления - высокую электронную проводимость. Можно предложить в качестве перспективных материалов также некоторые составы твердых растворов, например CaTi0.8Fe0.2O3- . Выделение кислорода 5 из потока гелий-кислородной смеси 3 целесообразно также проводить адсорбцией, мембранным разделением, однако в этих вариантах исполнения температура гелий-кислородной смеси 3 должна быть понижена до 200-300°С, что может достигаться либо регенеративным нагревом гелия 1, поступающего в термолизер 2, либо нагревом водяного пара 7. Регенеративные теплообменники 12 и 9 нагрева входящих потоков гелия 1 и водяного пара 7 соответственно, ведут нагрев за счет выходящих потоков гелий-кислородной смеси 3 и смеси водорода и водяного пара 8 соответственно. Кроме того, частично поток входящего гелия 1 может нагреваться за счет отбора тепла 13 от секции термолизера 2, в которой проведено восстановление оксида металла.
. Выделение кислорода 5 из потока гелий-кислородной смеси 3 целесообразно также проводить адсорбцией, мембранным разделением, однако в этих вариантах исполнения температура гелий-кислородной смеси 3 должна быть понижена до 200-300°С, что может достигаться либо регенеративным нагревом гелия 1, поступающего в термолизер 2, либо нагревом водяного пара 7. Регенеративные теплообменники 12 и 9 нагрева входящих потоков гелия 1 и водяного пара 7 соответственно, ведут нагрев за счет выходящих потоков гелий-кислородной смеси 3 и смеси водорода и водяного пара 8 соответственно. Кроме того, частично поток входящего гелия 1 может нагреваться за счет отбора тепла 13 от секции термолизера 2, в которой проведено восстановление оксида металла.
На второй стадии прекращают подачу гелия 1 в термолизер 2, внутрь которого подают поток водяного пара 7, нагретый до температуры 400-800°С. Водяной пар 7 при взаимодействии с оксидом железа в основном в форме вюстита окисляет последний до гематита с образованием водорода, смешивающегося с потоком водяного пара, выводимого из термолизера 2 в виде смеси водорода с потоком водяного пара 8, поступающей на отделение водорода 11, например, в высокотемпературный электрохимический отделитель водорода 10, в котором при подводе электрической энергии осуществляют подачу смеси водорода с потоком водяного пара 8 на вход анодного пространства высокотемпературного электрохимического процесса, в то время как смеси водорода выделяют в катодном пространстве, отделенном от анодного электролитическим слоем, выполненном из протонпроводящей керамики, например, SrCeO3, обладающей высокотемпературной протонной проводимостью, как доминирующей характеристикой электролита. Для SrCeO3, допированного Y, Sc, In, РЗЭ получены высокие величины протонной проводимости при 600-1000°С [Uchida H., Maeda N., Iwahara H. Relation between proton and hole conduction in SrCeO3 - based solid electrolytes under watercontaining atmospheres at hift temperatures // Solid State lonics. 1983. V.11. N2. P.117-124]. Электролиты были испытаны в ячейках, составляющих основу ряда высокотемпературных электрохимических устройств, и показали хорошие характеристики. Отделение водорода от водяного пара 7 возможно проводить также за счет адсорбции, конденсации водяного пара или мембранного разделения смеси водорода с потоком водяного пара 8 в аппарате выделения водорода 10 с получением продукционного водорода 11.
Нагрев гелия 1 ведут в плазменной струе, либо электронагревателями, либо методом индукционного нагрева, либо нагревом солнечной или ядерной энергией, либо продуктами сгорания органического топлива, на чертеже не показано. Помимо оксидов железа в термолизере 2 в качестве металла можно применять также сплавы на основе металлов, выбранных из группы олово, индий, галлий, марганец, хром, титан, медь, церий, цинк, алюминий, цирконий, свинец, ванадий, рутений, их смеси или соединения. Оксиды железа, гематит (FeO1.5), магнетит (FeO1.33) и вюстит (FeO1.1) имеют особенности плотноупакованной структуры ионов кислорода, могут образовывать шпинели, в частности для вюстита различные Fe/O отношения могут дифференцироваться что, как правило, обозначается Fe1- O (с 0.05<
O (с 0.05< <0.17). Вюстит может содержать 23.1-25.6% масс. кислорода. Гидролиз вюстита (FeO) ограничен из-за образования магнетита Fe3O4, играющего роль диффузионного барьера Такие компоненты, как Mn, Cr, Ti, Cu, Pb, V и Al, могут быть добавлены для повышения производительности, а добавки Al, Cr, Zr, Ga и V оказывают положительное влияние на окислительно-восстановительное поведение оксидов железа, вероятно, потому что водород активируется добавками или повышает диффузию кислорода в железе (оксидах).
<0.17). Вюстит может содержать 23.1-25.6% масс. кислорода. Гидролиз вюстита (FeO) ограничен из-за образования магнетита Fe3O4, играющего роль диффузионного барьера Такие компоненты, как Mn, Cr, Ti, Cu, Pb, V и Al, могут быть добавлены для повышения производительности, а добавки Al, Cr, Zr, Ga и V оказывают положительное влияние на окислительно-восстановительное поведение оксидов железа, вероятно, потому что водород активируется добавками или повышает диффузию кислорода в железе (оксидах).
Нагрев водяного пара 7 с давлением в диапазоне от 0.1 до 1.0 МПа перед подачей на окисление металла в термолизер 2 ведут помимо регенеративного нагрева в теплообменнике 9 также и с помощью, например, нагретого инертного газа 6, выходящего из отделителя 4, до температур 400-800°С с помощью отдельного теплообменника (на чертеже не показан) через герметичные теплообменные поверхности.
Цикл окисления и восстановления оксида металла ведут в параллельных переключаемых однородных по конструкции секциях термолизера 2, соединенных по гелию 1 и водяному пару 7 таким образом, чтобы поток гелия 1 поочередно переключался на подачу в соседние секции термолизера 2, в которых уже завершилось окисление оксида металла, а именно в излагаемом примере исполнения - окисление вюстита до гематита. Помимо гелия 1 в качестве инертного газа выбирают также аргон, азот, криптон или их смеси.
Ниже представлен расчет теплового баланса реализации способа:
1. Q термолиза гематита (до вюстита: Fe2 O3 2FeO+1/2О2): 342.8 кДж/моль Fe2O 3
2FeO+1/2О2): 342.8 кДж/моль Fe2O 3
2. Q нагрева/охлаждения гематита/вюстита (900 1500°С): Ср.гем
1500°С): Ср.гем средн×
средн× Т=1 кДж/кг·К×600 К=0.6 МДж/кг Fe2O 3/
Т=1 кДж/кг·К×600 К=0.6 МДж/кг Fe2O 3/
Ср.вюст средн×
средн× Т=0.73 кДж/кг·К×600 К=0.44 МДж/кг FeO
Т=0.73 кДж/кг·К×600 К=0.44 МДж/кг FeO
3. Q на испарение и нагрев водяного пара (1 МПа) до 1100°С: 2.26+2.17×(1100-180)=4.26 МДж/кг h3O
4. Принимая расходную массу гематита и водяного пара на 1 кг производимого водорода, равными:
mFe2 O3=100 кг, что, соответственно, в 1.25 раза больше стехиометрического расхода (степень конверсии при термолизе-80%), масса вюстита: mFeO=72 кг и смеси вюстит/гематит (после термолиза): mFexOy=92 кг, mh3O=13.5 кг, что, в свою очередь, в 1.5 раза больше стехиометрического расхода, в соответствии с ожидаемой степенью конверсии пара (60-70% по данным Production of Synthesis Gas and hydrogen by the Steam-Iron Process: Pilot Plant Study of Fluidized and Free-Falling Beds, Gasior, S.J., Fomey, A.J., Field, J.H., Bienstock, Daniel, Benson, H.E.,U.S. DoI, Bureau of Mines, R.I. 5911,1961), получим общие затраты тепла (в приведении к 1 кг водорода):
- на проведение реакции термолиза: 171.2 МДж,
- на нагрев гематита: 0.6×100=60 МДж,
- на получение и нагрев водяного пара: 4.26×13.5=57.5 МДж.
Из них затраты на производство и нагрев водяного пара покрываются за счет охлаждения вюстита от температуры термолиза гематита (1500°С) до рабочей температуры генерации водорода (1100°С), что дает 0.76×600×92=41.7 МДж, а также за счет охлаждения потока водяного пара (4.5 кг) и водорода (1 кг) от 1100°С до 180°С, что дает 2×4.5+14.55×0.92=21.88 МДж и охлаждения потока кислорода (8 кг) от температуры термолиза (1500°С) до 180°С (в варианте термолизера с передачей тепла через стенку), что дает 1520×1×8=12.16 МДж, из которых 4.8 МДж может быть использовано для нагрева гематита перед термолизом, с соответствующим уменьшением затрат тепла, покрываемых нагретым гелием.
Таким образом, от энергоисточника с помощью гелиевого теплоносителя расход тепла составит 171.2+(60-4.8)=226.4 МДж.
Соответствующая общая эффективность процесса получения водорода из воды составит: 143/226.4=63%.
Такой показатель эффективности получения водорода из воды превышает все известные термохимические технологии.
При достигнутой объемной скорости водяного пара в реакционном объеме 300 1/ч и в расчете на мощность 1 МВт объем реактора-термолизера займет при плотности водяного пара 0.5 кг/м3:
1 МВт/226.4 МДж×3600×9/0.5/300=0.95 м3.
Суммарный процесс разложения воды в предложенном изобретении описывается реакцией (h3 O 1/2O2+Н2), в которой удается получить из воды водород и кислород высокой чистоты с необходимым для дальнейшего использования давлением. Таким образом, в предложенном изобретении удалось снизить тепловые затраты на процесс разложения воды, а также повысить производительность и экономичность технологии получения водорода, эффективно использовать энергетический потенциал высокотемпературных энергоисточников, в том числе ядерных, что позволяет рассчитывать на высокую экономическую эффективность. Полученные продукты разложения воды - газообразные водород и кислород могут затем использовать в химической промышленности и металлургии для переработки углеводородов, а также в системах аккумулирования и транспорта энергии и как топливо в транспортных и стационарных энергоустановках.
1/2O2+Н2), в которой удается получить из воды водород и кислород высокой чистоты с необходимым для дальнейшего использования давлением. Таким образом, в предложенном изобретении удалось снизить тепловые затраты на процесс разложения воды, а также повысить производительность и экономичность технологии получения водорода, эффективно использовать энергетический потенциал высокотемпературных энергоисточников, в том числе ядерных, что позволяет рассчитывать на высокую экономическую эффективность. Полученные продукты разложения воды - газообразные водород и кислород могут затем использовать в химической промышленности и металлургии для переработки углеводородов, а также в системах аккумулирования и транспорта энергии и как топливо в транспортных и стационарных энергоустановках.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Способ получения водорода из воды, в котором проводят цикл окисления и восстановления оксида железа с получением водорода при окислении железа водяным паром, водород выделяют как конечный продукт из потока водяного пара, отличающийся тем, что восстановление оксида железа ведут путем его термолиза при нагреве инертным газом с получением кислорода, после чего железо окисляют потоком водяного пара, нагреваемым инертным газом, и его окисление водяным паром ведут в емкости, попеременно заполняемой нагретыми инертным газом и водяным паром.
2. Способ по п.1, отличающийся тем, что нагрев инертного газа ведут в плазменной струе, или электронагревателями, или методом индукционного нагрева, или нагревом солнечной или ядерной энергией, или продуктами сгорания органического топлива.
3. Способ по п.1, отличающийся тем, что восстановление оксида железа ведут при температуре выше 1200°C и давлении выше 0.1 МПа, после чего выделение кислорода из потока инертного газа ведут адсорбцией, или мембранным или электрохимическим разделением.
4. Способ по п.1, отличающийся тем, что давление водяного пара выбирают в диапазоне от 0.1 до 1.0 МПа.
5. Способ по п.1, отличающийся тем, что часть тепла, необходимого для нагрева инертного газа, отводят от восстановленного оксида железа.
6. Способ по п.1, отличающийся тем, что отделение водорода от водяного пара после окисления железа ведут за счет адсорбции, или конденсации водяного пара, или мембранного разделения или электрохимическим процессом.
7. Способ по п.1, отличающийся тем, что путем регенеративного теплообмена изменяют температуры потоков инертного газа и водяного пара на входе и выходе из цикла окисления и восстановления оксида железа.
8. Способ по п.1, отличающийся тем, что цикл окисления и восстановления оксида железа ведут в параллельных переключаемых однородных по конструкции секциях, соединенных по инертному газу и водяному пару.
9. Способ по п.1, отличающийся тем, что в качестве инертного газа выбирают гелий, или аргон, или азот, или криптон или их смеси.
www.freepatent.ru