CUPRUM METALLICUM (КУПРУМ МЕТАЛЛИКУМ). Металл купрум
описание химического элемента, свойства и сферы применения
Металлическая медь издавна используется человечеством в самых разных областях жизни. Двадцать девятый элемент из периодической таблицы Д. И. Менделеева , находящийся между никелем и цинком, обладает интересными характеристиками и свойствами. Этот элемент обозначается символом Cu. Это один из немногих металлов с характерной окраской, отличной от серебристого и серого цветов.
История появления меди
О том, какое великое значение имел этот химический элемент в истории человечества и планеты, можно догадаться уже по названиям исторических эпох. После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
Медь является одним из семи металлов, которые стали известны человечеству еще в древности. Если верить историческим данным, знакомство древних людей с этим металлом произошло примерно девять тысяч лет назад.
Древнейшие изделия из этого материала были обнаружены на территории современной Турции. Археологические раскопки, проведенные на месте крупного поселения времен неолита под названием Чаталхеюк, позволили отыскать небольшие медные шарики-бусины, а также медные пластины, которыми древние люди украшали свой наряд.
Найденные вещицы были датированы стыком восьмого и седьмого тысячелетий до нашей эры. Помимо самих изделий, на месте раскопок был обнаружен шлак, что говорит о производившихся выплавках металла из руды.
Получение меди из руды было относительно доступно. Поэтому несмотря на свою высокую температуру плавления, этот металл в числе первых был быстро и широко освоен человечеством.
Способы добычи
В природных условиях этот химический элемент существует в двух формах:
- соединения;
- самородки.
Любопытным фактом является следующее: медные самородки в природе попадаются гораздо более часто, чем золотые, серебряные и железные.
Природные соединения меди — это:
- оксиды;
- углекислые и сернистые комплексы;
- гидрокарбонаты;
- сульфидные руды.
Рудами, имеющими наибольшее распространение, являются медный блеск и медный колчедан. Меди в этих рудах содержится всего один-два процента. Первичная медь добывается двумя основными способами:
- гидрометаллургическим;
- пирометаллургическим.
Доля первого способа составляет десять процентов. Оставшиеся девяносто относятся ко второму методу.
Пирометаллический способ включает в себя комплекс процессов. Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Процесс получения меди гидрометаллургическим способом делится на два этапа.
- Вначале сырье выщелачивается при помощи слабого раствора серной кислоты.
- На заключительном этапе металл выделяется непосредственно из упомянутого в первом пункте раствора.
Данный метод используется при переработке только бедных руд, так как, в отличие от предыдущего способа, при его проведении невозможно попутно извлечь драгоценные металлы. Именно поэтому приходящийся на этот способ процент так невелик по сравнению с другим методом.
Немного о названии
Химический элемент Cuprum, обозначаемый символом Cu, получил свое название в честь небезызвестного острова Кипр. Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Физические свойства металла
Пожалуй, невозможно понять, что такое металлическая медь, не разобравшись в ее свойствах, основных характеристиках и особенностях.
При контакте с воздухом этот металл становится желтовато-розового цвета. Этот неповторимый золотисто-розовый оттенок обусловливается возникновением на поверхности металла оксидной пленки. Если эту пленку удалить, медь приобретет выразительный розовый цвет с характерным ярким металлическим блеском.
Удивительный факт: тончайшие медные пластинки на просвет имеют вовсе не розовый, а зеленовато-голубой или, иначе говоря, морской цвет.
В форме простого вещества медь обладает следующими характеристиками:
- удивительной пластичностью;
- достаточной мягкостью;
- тягучестью.
Чистая медь без наличия каких-либо примесей превосходно поддается обработке — ее с легкостью можно прокатить в пруток или лист либо вытянуть в проволоку, толщина которой будет доведена до тысячных долей миллиметра. Добавление примесей в этот металл повышает его твердость.
Помимо упомянутых физических характеристик, этот химический элемент обладает высокой электропроводностью. Эта особенность главным образом определила применение металлической меди.
Среди основных свойств этого металла стоит отметить его высокую теплопроводность. По показателям электропроводности и теплопроводности медь является одним из лидеров среди металлов. Более высокими показателями по этим параметрам обладает только один металл — серебро.
Нельзя не принимать во внимание тот факт, что показатели электро- и теплопроводности меди относятся к разряду базовых свойств. Они сохраняются на высоком уровне лишь пока металл находится в чистом виде. Уменьшить эти показатели возможно добавлением примесей:
- мышьяка;
- железа;
- олова;
- фосфора;
- сурьмы.
Каждая из этих примесей в сочетании с медью оказывает на нее определенное влияние, в результате которого значения тепло- и электропроводности заметно понижаются.
Помимо всего прочего, металлическая медь характеризуется невероятной прочностью, высокой температурой плавления, а также высокой температурой кипения. Данные действительно впечатляют. Температура плавления меди превышает одну тысячу градусов Цельсия! А температура кипения составляет 2570 градусов Цельсия.
Этот металл относится к группе металлов-диамагнетиков. Это значит, что его намагничивание, как и у ряда других металлов, происходит не по направлению внешнего магнитного поля, а против него.
Еще одной немаловажной характеристикой можно назвать отличную устойчивость этого металла к коррозии. В условиях высокой влажности окисление железа, например, происходит в несколько раз быстрее, чем окисление меди.
Химические свойства элемента
Данный элемент является малоактивным. При контакте с сухим воздухом в обычных условиях медь не начинает окисляться. Влажный воздух, напротив, запускает окислительный процесс, при котором образуется медный карбонат (II), являющийся верхним слоем патины. Практически моментально этот элемент реагирует с такими веществами, как:
- сера;
- селен;
- галогены.
Кислоты, не обладающие окислительными свойствами, не способны оказывать на медь влияние. Кроме того, она никак не реагирует при контакте с такими химическими элементами, как:
- азот;
- углерод;
- водород.
Кроме уже отмеченных химических свойств, для меди характерна амфотерность. Это значит, что в земной коре она способна образовать катионы и анионы. Соединения этого металла могут проявлять как кислотные свойства, так и основные — это напрямую зависит от конкретных условий.
Области и особенности применения
В древние времена металлическая медь использовалась для изготовления самых разных вещей. Умелое применение этого материала позволило древним людям обзавестись:
- дорогой посудой;
- украшениями;
- инструментами, имеющими тонкое лезвие.
Сплавы меди
Говоря о применении меди, нельзя не упомянуть о ее значении в получении различных сплавов, в основу которых ложится именно этот металл. К таким сплавам относятся:
- бронза;
- латунь.
Две эти разновидности явяются основными видами медных сплавов. Первый бронзовый сплав был создан на Востоке еще за три тысячелетия до нашей эры. Бронза по праву может считаться одним из величайших достижений металлургов древности. По сути, бронза — это соединение меди с прочими элементами. В большинстве случаев в роли второго компонента выступает олово. Но вне зависимости от того, какие элементы входят в сплав, основным компонентом всегда является медь. Формула латуни содержит главным образом медь и цинк, но возможны и дополнения к ним в виде других химических элементов.
Помимо бронзы и латуни, этот химический элемент участвует в создании сплавов с другими металлами, среди которых алюминий, золото, никель, олово, серебро, титан, цинк. Медные сплавы с неметаллами, такими как кислород, сера и фосфор, используются гораздо реже.
Отрасли промышленности
Ценные свойства медных сплавов и чистого вещества способствовали их использованию в таких отраслях, как:
- электротехника;
- электромашиностроение;
- приборостроение;
- радиоэлектроника.
Но, разумеется, это еще не все области применения этого металла. Он является высокоэкологичным материалом. Именно поэтому он используется при строительстве домов. Например, кровельное покрытие, выполненное из металлической меди, благодаря своей высочайшей коррозийной устойчивости обладает сроком службы более сотни лет, не требуя при этом особого ухода и покраски.
Еще одна область использования этого металла — ювелирная отрасль. В основном он применяется в форме сплавов с золотом. Изделия из медно-золотого сплава характеризуются повышенной прочностью, высокой стойкостью. Такие изделия на протяжении долгого времени не деформируются и не истираются.
Соединения металлической меди выделяются высокой биологической активностью. В мире флоры этот металл имеет важное значение, так как он участвует в синтезе хлорофилла. Участие данного элемента в этом процессе позволяет обнаружить его в числе компонентов минеральных удобрений для растений.
Роль в организме человека
Нехватка этого элемента в человеческом организме может оказать негативное влияние на состав крови, а именно ухудшить его. Восполнить дефицит этого вещества можно при помощи специально подобранного питания. Медь содержится во многих продуктах питания, поэтому составить полезный рацион по душе не составит труда. Для примера, одним из продуктов, в составе которых имеется этот элемент, является обычное молоко.
Но составляя насыщенное этим элементом меню, не следует забывать о том, что переизбыток его соединений может привести к отравлению организма. Поэтому, насыщая организм этим полезным веществом, очень важно не переусердствовать. И касается это не только количества потребляемых продуктов.
К примеру, пищевое отравление может вызвать использование медной посуды. Приготовление пищи в такой посуде крайне не рекомендуется и даже воспрещается. Связано это с тем, что в процессе кипячения в пищу поступает значительное количество этого элемента, что может привести к отравлению.
В запрете на медную посуду есть одна оговорка. Использование такой посуды не представляет опасности в том случае, если ее внутренняя поверхность имеет оловянное покрытие. Только при выполнении этого условия использование медных кастрюлек не несет угрозы пищевого отравления.
Помимо всех перечисленных отраслей применения, распространение этого элемента не обошло стороной и медицину. В сфере лечения и поддержания здоровья он применяется в качестве вяжущего вещества и антисептика. Этот химический элемент входит в состав капель для глаз, которые используются при лечении такого заболевания, как конъюнктивит. Кроме того, медь является немаловажным компонентом различных растворов от ожогов.
tokar.guru
Медь. Описание, свойства, происхождение и применение металла

Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
СТРУКТУРА

Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура — кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками «медной зелени» (малахит), «медной сини» (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА

Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ

Медь
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.Наиболее известные месторождения самородной меди — Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
ПРИМЕНЕНИЕ

Изделия из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Медь (англ. Copper) — Cu
| Молекулярный вес | 63.55 г/моль |
| Происхождение названия | От греческого «Kyprium», то есть «кипрский металл», по названию острова Кипр |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.1
| Strunz (8-ое издание) | 1/A.01-10 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.1.3 |
| Dana (8-ое издание) | 1.1.1.3 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | медно-красный, тускнеющий в черный или зеленый на воздухе |
| Цвет черты | медно-красный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2,5-3 |
| Прочность | ковкий |
| Излом | зазубренный |
| Плотность (измеренная) | 8.94 — 8.95 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | диамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Цвет в отраженном свете | розовато-белый |
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — гексоктаэдрический |
| Пространственная группа | Fm3m (F4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 3.615Å |
| Морфология | кубы, додекаэдры и тетрагексаэдры; редко октаэдры и сложные комбинации; нитевидные, древовидные |
| Двойникование | Двойники по {111} по шпинелевому закону |
Интересные статьи:
mineralpro.ru 28.07.2016mineralpro.ru
Гомеопатический препарат Купрум металликум (Cuprum metallicum): показания к применению
Купрум металликум — это металлическая медь. В гомеопатии используется не только чистая металлическая медь, но и ее некоторые соли. Для лекарственных целей сернокислую медь очищают путем различных физических и химических манипуляций. Три первые разведения — это растирания.
В гомеопатию препарат был введен Ганеманом. Патогенез купрум металликум можно найти в труде «Хронические болезни».
Как купрум металликум действует на организм больного
Влияние меди на организм человека выражается в первую очередь в расстройстве желудка. Затем начинается рвота, иногда с кровью. Больные отмечают медный привкус во рту и обильное слюноотделение. Также поступают жалобы на острую боль во рту, пищеводе и животе. Типичный симптом — понос.
В ряде случаев наблюдаются судороги. Часто отмечается желтуха, правда она наступает не сразу, а лишь на второй или третий день. Причина данного явления — разрушение медью красных кровяных телец.
Яркий признак отравления медью — гастрит. Кроме того, наблюдается гипертрофия и набухание стенок кишечника, гиперемия и язвы.
Хроническое отравление медью у рабочих проявляется менее ярко, чем, например, при мышьяке. Выражается оно в расстройствах пищеварительной системы, потерей сил и веса. Также появляется кашель и обнажаются зубы.
Показания к применению купрум металликума
На необходимость применения купрум металликума указывают спазмы и судороги. Поэтому можно выделить основные заболевания, при которых назначается это гомеопатическое средство. В том числе можно отметить такие недуги, как коклюш, холера, хорея, астма, эпилепсия, судорожные состояния и менингит.
Кроме того, показаниями к применению купрум металликум являются мозговые последствия прорезывания зубов у детей. Если они яркие и очень болезненные, то рекомендована белладонна, а если менее сильные, то эффективна будет медь.
Показано гомеопатическое лекарство в случае недостатка реакции, в особенности вызванного совокупностью физического и умственного напряжения. Помогает при коликах и сильной рвоте. Назначается в случае зеленого поноса у детей.
Наконец, купрум металликум будет полезен при хроническом аортите, сопровождающемся одышкой и бессонницей.
Кому предназначен купрум металликум
К типу купрум металликум можно отнести истощенных больных, страдающих расстройствами желудка и прочими недугами пищеварительной системы. Также препарат назначается при характерных симптомах заболеваний, описанных выше.
Дозы применения купрум металликум
В гомеопатии металлическая медь обычно применяется в высоких разведениях, от двенадцатого до тридцатого. Соли же, напротив, более эффективны в низких разведениях.
Об авторе
 Лайма Янсонс
Лайма Янсонс
www.gomeo-patiya.ru
CUPRUM METALLICUM (КУПРУМ МЕТАЛЛИКУМ) — Гомеопатия — Справочники — Udoktora.net
описание
Металлическая медь. Гомеопаты употребляют не только металлическую медь, но и многие ее соли — уксусно-кислую нейтральную, мышьяковистокислую и углекислую. Для гомеопатических целей химически чистая мещь получается посредством многократной кристаллизации сернокислой меди и погружения в раствор куска железа. Медь выпадает, выпавшую медь помещают в соляную кислоту, чтобы отделить железо, затем промывают и сплавляют с небольшим количеством буры и окиси меди. Три первые разведения приготовляются в растираниях. Патогенез меди находится в “Хронических болезнях” Ганемана.
Характеристика 1. Спазмы и судороги. Спазмы начинаются с пальцев рук и ног и, распространяясь по телу, становятся общими. 2. Периодичность симптомов. 3. Сильная утомляемость и слабость во всем теле. 4. Ощущение вылитой на голову холодной воды, своеобразный симптом, который часто позволяет индивидулизировать лекарство. 5. Болезни начинаются с левой стороны. 6. Улучшение при питье холодной воды. 7. Тошнота, по словам Берике, выражена сильнее, чем при каком-либо другом лекарстве. 8. Сильное чувство давления в желудке, с приступами судорожных болей. 9. Согнутый большой палец, в сжатом кулаке. 10. Быстрое вращение глазных яблок, во все стороны. Боли. Спазматические сжимания, которые появляются в виде судорог во всем теле. Они очень болезненны, внезапно появляются и исчезают. Стул. Запор с тенезмами; стул твердый. Понос очень жидкий, непереваренной пищей. Стул очень вонючий, иногда непроизвольный во сне с тенезмами, сильная слабость и сердцебиения. Менструации. Преждевременные или запоздалые, но всегда обильные. Перед и во время менструаций грудные железы увеличиваются и делаются твердыми и болезненными. Прекращение менструаций от простуды, от погружения рук в холодную воду. Бели густые, молочного цвета, разъедающие, с коликами.
Резюме Спазмы и судороги — две главные характеристики купрум, которые являются для нее показанием при всех заболеваниях с преобладанием судорожных или спазматических симптомов: холера, коклюш и др. Не нужно забывать своеобразной характеристики: ощущение вылитой на голову холодной воды.
показания к применению
Главные показания Всякие заболевания, при которых наблюдаются СПАЗМЫ И СУДОРОГИ (коклюш, астма, холера, эпилепсия, хорея, судороги, менингит и др.). Главное гомеопатическое применение купрум — облегчение судорог и спазмов. Судороги могут быть тонические или клонические, местные или общие, иногда они выражаются спазматическим кашлем или затруднением дыхания. КОКЛЮШ — (6 или 30). Преобладают судорожные симптомы. Ребенок краснеет, глаза слезятся, купрум обязательно показан при резко выраженной спазматической форме и если ожидают появления судорог, или они уже есть; спазматические сокращения; сжимание кисти с большим пальцем под другими пальцами. В случае если купрум металликум не дает результата, рекомендуется купрум ацетикум. АСТМА. Особенно, если приступы внезапно прерываются непроизвольной рвотой. ЭПИЛЕПСИЯ. Хорея. Сильные приступы с криком, похожим на кваканье лягушек, следствие сжимания глотки и гортани. Ночные прступы. Аура начинается с ног и поднимается к животу. Пронзительный крик, предшествующий моментальной слепоте. СУДОРОГИ. Купрум действует лучше всего, когда судороги являлись последствием испуга матери или ребенка. Сильно согнутый большой палец судорожно сжатой руки указывает на начало приступа. КАШЕЛЬ. Продолжительные и непрерывные приступы — истинная характеристика кашля купрум. ХОЛЕРА. Судороги мускулатуры. При камфоре сильнее всего выражен коллапс; при вератрум вириде — понос и рвота; при купрум — судороги. МОЗГОВЫЕ СИМПТОМЫ, трудного прорезывания зубов у ребенка, когда состояние не настолько тяжелое, чтобы была показана белладонна. НЕДОСТАТОК РЕАКЦИИ. Наклонность к рецидивам всех симптомов, особенно у субъектов, совершенно истощенных одновременно физическим и психическим напряжением умственной работой с бессонницей ( нукс вомика, коккулюс). КОЛИКИ. Представляют соединение нервных и воспалительных симптомов. Живот крепкий, как камень, в начале наблюдается упорный запор, за которым иногда следует водянистый, кровянистый, зеленоватый понос. Страшная рвота спазмотического характера. ЗЕЛЕНЫЙ ПОНОС У ДЕТЕЙ. Предпочтительно купрум арсеникозум. Одышка и бессонница при хроническом АОРТИТЕ.
действие на организм
Физиологическое действие После приема медной соли прежде всего появляется очень сильное расстройство желудка. Рвота начинается немедленно; рвотные массы имеют характерную окраску, зеленую или голубую, в зависимости от проглоченной соли, и иногда полоски крови. Больной жалуется на очень неприятный медный вкус во рту, который держится в течение нескольких дней и сопровождается очень обильным слюнотечением. Наблюдаются очень острые боли во рту, в пищеводе и в животе, колики сопровождаются поносом, иногда слизистым, но резко кровянистым. Бывают и нервные симптомы, в частности, судороги в нижних конечностях. При отравлении в течение нескольких дней может развиться токсический нефрит; моча выделяется в незначительном количестве, содержит белок и эпителиальные цилиндры; крови или красящего вещества крови не бывает, даже когда моча темного цвета. Довольно часто, на второй или третий день наблюдается желтуха. Медь разрушает красные кровяные тельца, результатом чего, без сомнения, и является желтуха. Впрочем, в некоторых случаях в моче обнаруживают присутствие гематина и гомоглобина. В случае благополучного исхода отравления, выздоровление идет медленно, иногда очень долго наблюдается диспепсия с поносами, сменяющимися запорами. По Тардье в некоторых случаях во время выздоровления констатируются параличи и дрожания, которые иногда тянутся по несколько лет. При вскрытиях в желудке обнаруживаются явления более или менее сильного гастрита. Во всех кишках гиперемия и язвы, особенно в толстой и даже в прямой кишке; равным образом отмечают гипертрофию и набухание Пейеровых бляшек. М. Виберт обращает внимание на строго ограниченные участки атрофии стенок кишок, которые зависят скорее от выделения яда через слизистую кишок, чем от прохождения его по пищеварительному тракту. Профессиональное отравление не так резко выражено, как при мышьяке или свинце. Бушара правильно говорит: “с точки зрения гигиены свинец больше вредит, чем пугает, а медь больше пугает, чем вредит”. Однако, рабочие, вдыхающие в течение многих лет пыль медных солей, заболевают приступами “медной колики”, затем они уже всегда страдают расстройствами пищеварения и гастралгиями; они теряют силы и заметно худеют, они кашляют, страдают ночными потами и производят впечатление туберкулезных, хотя при выслушивании легкие оказываются здоровыми; зубы обнажаются и на них появляется полоска иногда серая, а чаще всего пурпурно-красная.
дозировка
Металлическая медь назначается обычно в высоких разведениях от 12 до 30, а соли — в низких разведениях.
udoktora.net
Медь - металл Венеры - Магические и целебные свойства металлов - Все материалы

Медь – переходный металл красивого золотисто-розового цвета. В природе в самородном виде он встречается намного чаще, чем серебро или золото. В латинском языке медь обозначается, как «Cuprum», возникновение которого связывают с названием острова Кипр. Там еще в 3 тысячелетии древние греки добывали медь из рудников и первыми научились ее обрабатывать.
Медь – легко добываемый металл. Его не трудно выделять из руды путем электролиза, гидрометаллургии или пирометаллургии. Металл обладает высокой тепло- и электропроводностью. Имея большое удельное сопротивление, медь широко применяется в электротехнике, в производстве труб, в ювелирной промышленности и др.
Медь относится к планете Венера, и обозначается как круг с крестиком в нижней части.
Легенды о меди
Еще в древние времена было замечено, что медь оказывает благотворное влияние на организм человека. Существует немало легенд о чудесном выздоровлении с помощью этого красного металла. Например, шумерский царь никогда не болел и не старел. Все жители утверждали, что их предводителю была известна тайна вечной молодости. На самом деле он увлекался медициной, проводил различные эксперименты, в ходе которых выяснил, что медь обладает целебными свойствами. Он приказал кузнецу сделать ему медную вазу. Вода в медной вазе становилась лекарством от всех болезней, а вино превращалось в настоящий эликсир молодости.
По другой легенде царицы Клеопатра, Нефертити и царица Савская пользовались косметикой с добавлением медного порошка. Как известно, они славились своей удивительной красотой и привлекательностью.
Широко распространена еще одна легенда, с которой связывают чудесное исцеление медью. Греческий предводитель Фан славился своим бесстрашием, силой, ловкостью. Во время очередного сражения его коня ранили, а сам он упал на землю и сильно повредил колено. Врач Фана приложил к ноге красную пластину. Фан быстро почувствовал облегчение, невыносимая боль утихла, а сам он мгновенно уснул. Проснувшись, воин сразу же отправился на битву, так как его колено чудесным образом исцелилось. А красной пластиной, как выяснилось, была теперь всем известная медь.

Магические свойства меди
Издавна замечено, что медь обладает магическими свойствами. Это очень сильный металл, который является мощной защитой от нечистой силы, поэтому его применяют в создании различных амулетов и оберегов.
Чтобы не мучили ночные кошмары, маги советуют перед сном под подушку класть медные пяточки в виде креста. Если человек боится или не решается куда-то пойти или завести с кем-то серьезный разговор, то есть человеку не хватает решительности, ему нужно носить медное кольцо или браслет. Медь развивает в человеке уверенность, стойкость, решительность, уравновешивает психическое состояние. В душе человека наступает гармония и умиротворение.
Медь часто используется в любовной магии, для привлечения симпатии понравившегося человека. Для этого нужно купить 2 одинаковых медных кольца. Одно носить самому, а другое подарить объекту вожделения. Судьбы этих людей обязательно переплетутся.

Целебные свойства меди
Из-за целебных свойств, которые были обнаружены в еще древние времена, медь широко используют в медицине и косметологии. Этот красный металл снимает боль, лечит артриты, артрозы, устраняет остеопороз.
При недостатке меди в организме, человек может чувствовать постоянную усталость, он наблюдает выпадение волос в больших количествах, хрупкость ногтей, ухудшается состояние кожи. У человека с дефицитом меди развивается анемия и слабоумие. Суточная норма меди составляет от 1 до 2 г. Медь содержится в крупах (гречка, овсянка), хлебе, макаронах и в шоколаде. Медь обязательно входит в состав комплексных витаминов.
В косметологии медь используется при приготовлении кремов, масок. Эти косметические средства успешно борются с морщинами, преждевременным старением кожи, подтягивает контур лица, повышает регенерацию кожных покровов.

Связь меди с астрологическими знаками зодиака
В первую очередь медь подходит таким знакам зодиакального круга, как Рыбы, Рак, Близнецы, Весы, Телец и Дева. Этот металл будет способствовать восполнению энергии у этих знаков, улучшению общего состояния, нормализации внутренней гармонии.
Остальным представителям знаков зодиака медь носить можно, периодически ее снимая. Если, например, Скорпион, будет долго носить медные украшения, его энергия будет накапливаться, но не расходоваться, что не свойственно этому знаку воды.
zonatigra.ru
Купрум - это... Что такое Купрум?
| Атомный номер | 29 |
| Внешний вид простого вещества | пластичный металл золотисто-розового цвета |
| Атомная масса(молярная масса) | 63,546 а. е. м. (г/моль) |
| Радиус атома | 128 пм |
| Энергия ионизации(первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 72 (+1e) 96 пм |
| Электроотрицательность(по Полингу) | 1,90 |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 2, 1 |
| Плотность | 8,96 г/см³ |
| Удельная теплоёмкость | 24,465 Дж/(K·моль) |
| Теплопроводность | 401 Вт/(м·K) |
| Температура плавления | 1356,6 K |
| Теплота плавления | 13,01 кДж/моль |
| Температура кипения | 2840 K |
| Теплота испарения | 304,6 кДж/моль |
| Молярный объём | 7,1 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Период решётки | 3,615 Å |
| Отношение c/a | n/a |
| Температура Дебая | 315,00 K |
Медь — химический элемент с атомным номером 29 в периодической системе, обозначается символом Cu (лат. Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
История и происхождение названия
Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, Меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два различных варианта распада с различными продуктами.
Плотность — 8,94*10³ кг/м³
Удельная теплоёмкость при 20 °С — 390 Дж/кг*К
Удельное электрическое сопротивление при 20-100 °С — 1,78·10-8 Ом·м
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
Хорошо проводит тепло. На воздухе покрывается оксидной плёнкой.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11h21)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5h3O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu20 имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]- устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl-(водн.) → [CuCl]- (водн.)
Хлорид меди(I) - белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение - комплексный дихлорокупрат(I)-ион [CuCl2]-. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(Nh4)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления. В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широкораспространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь самый широкоупотребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди применять для транспортировки ацетилена можно только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в кровельном деле. Кровли из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4]
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учереждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[1]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) [6] официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [7]. Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. [2][3]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [2], на долю России приходилось 3.2 % общих и 3.1 % подтверждённых мировых запасов [2]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 1,009 тыс. тонн, потребление — 714 тыс. тонн[4]. Основными производителями меди в России являются:
Как добывают медь Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Нашли однажды самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н.э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Большая часть добываемой меди используется в электротехнике, потому что медь обладает высокой электропроводностью, уступая в этом только серебру, которое, конечно, намного дороже. Миллионы километров проводов опутали земной шар, и большинство из них медные. Медь нужна для производства двигателей, телевизоров, телефонных аппаратов, различных электроприборов, автомобилей, электровозов, холодильников и даже музыкальных инструментов. Ее используют в химической промышленности для борьбы с вредителями садов и огородов, для подкормки растений и животных. Всюду нужна медь. По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Ссылки
Примечания
- ↑ [1]
- ↑ 1 2 3 http://www.ecsocman.edu.ru/db/msg/142462.html
- ↑ http://www.metalinfo.ru/ru/news/12150
- ↑ Минпромэнерго РФ, «Стратегия развития металлургической промышленности Российской Федерации на период до 2015 года» [2]
Wikimedia Foundation. 2010.
dic.academic.ru
Полезное о металлах: медь – Ярмарка Мастеров
В ходе многолетней практики создания украшений часто приходится сталкиваться с необходимостью рассказать покупателю или человеку, пришедшему на мастер-класс, о свойствах металлов и их славов.
Понятия — серебро, золото, железо — в целом являются общеизвестными и пояснений не требуют, а вот такие загадочные обозначения как "бижутерный сплав", томпак, бронза, нейзильбер и другие могут вызывать некоторые затруднения.
В связи с этим, возникла потребность написания цикла обзорных статей, которыми я бы хотела поделиться.
Первая статья цикла посвящена меди — первому освоенному человеком металлу.
Медь — элемент одиннадцатой группы IV периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum).
В чистом виде медь — это пластичный, вязкий и легко прокатываемый в тонкие листы металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки), обладающий высокой тепло- и электропроводностью.Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь встречается в природе в самородном виде чаще, чем золото, серебро и железо.

Поэтому из-за сравнительной доступности для получения из руды и малой температуры плавления медь входит в семёрку металлов, известных человеку с очень древних времён и один из первых металлов, широко освоенных человеком . Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк, относящегося к периоду медного века. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком и предшествует бронзовому. Медь как художественный материал использовался для изготовления украшений, скульптур, утвари и посуды.


В наши дни медь широко используется в промышленности разного рода из-за:
- высокой теплопроводимости;
- высокой электропроводимости;
- ковкости;
- хороших литейных качеств;
- большого сопротивления на разрыв;
- химической стойкости.


Около 40% меди идёт на изготовление различных электрических проводов и кабелей.
Кроме того, медь обладает высокой декоративной возможностью, что активно используется при изготовлении предметов декоративно-прикладного искусства и даже дизайне интерьеров.
На равне с прекрасной деформируемостью и устойчивостью к условиям окружающей среды, высокая декоративность меди обусловлена потрясающей цветовой палитрой патины, образующейся на ее поверхности.
Патина — пленка, образующаяся на поверхности металла в ходе окисления под влиянием окружающей среды.
Химический состав и цвет патины слегка отличается в зависимости от окружающей среды и формирует химически стабильный и прочный защитный слой, изолирующий металл от внешней среды. Патина предохраняет металл от дальнейшего разрушения. В случае механических повреждений эта поверхность восстанавливается сама.
Для соединений, образующихся на поверхности металлической меди характерны цвета: Cu2O — красный (в природе в виде минерала куприт), CuO — черный (в природе в виде минерала тенорит), CuCl2+h3O — голубой. Во влажном воздухе на поверхности меди образуются меднозакисные соли: в присутствии углекислого газа образуется зеленоватая пленка карбонатов состава Cu(OH)2·CuCO3; так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения, в виде основного сульфата (II) — (CuOH)2 SO4.

В естественных условиях цвет меди изменяется несколько раз, начиная с момента рождения и до полного формирования патины на ее поверхности. Непосредственно после изготовления металла он покрывается оксидом Cu2O и поверхность меди становится нежно-розовая и блестящая. Под действием кислорода воздуха пленка из оксида меди Cu2O становится более толстой и цвет густеет; медь становится ярко-красной.

Затем на ней начинает образовываться оксид меди CuO черного цвета. Поэтому, по мере наращивания слоя CuO поверхность меди становится тусклой и матовой. Затем цвет темнеет и постепенно меняется на коричневый. Становясь все более непрозрачным, слой CuO меняет цвет меди с темно-коричневого в итоге на антрацитово-черный.

Затем эта поверхность развивается далее, под воздействием находящихся в воздухе углерода, серы, хлоридов и влаги на ней образуются различные меднозакисные соли, обладающие зеленым цветом, иногда с синеватыми или голубоватыми оттенками. С течением времени наступает последняя стадия процесса окисления и на поверхности образуется ярко-зеленый, иногда зеленый с голубовато-синим оттенком слой патины. В основной своей массе природная патина — это соединения родственные зеленоватому минералу меди — малахиту.


Многообразие и красоту этого металла можно отразить, приведя примеры предметов декоративно-прикладного искуссства, бижутерии и фотографий итерьеров, для создания которых использовалась медь.










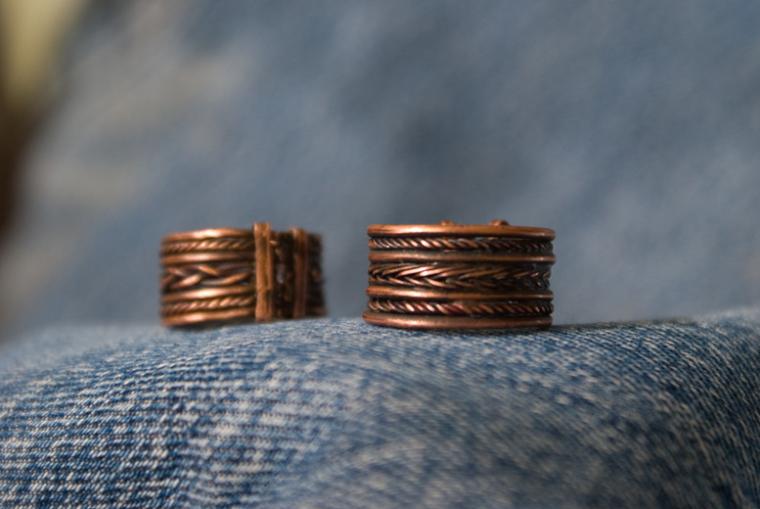









Широкое применение в ювелирной, инструментальной и машиностроительной промышленности и электротехнике нашли различные сплавы меди с другими веществами. Наиболее важными из них являются латуни, медноникеливые сплавы и бронзы. Также необходимо отметить, что медь является важнейшим компонентом лигатур для изготовления драгоценных сплавов различных проб на основе серебра и золота.
Более подробно о сплавах меди, их свойствах и применении будет рассказано в следующих частях обзора :)
В завершении этой части приведу несколько советов по чистке медных украшений:

1. Для легкой чистки и удаления жирного налета медные украшения можно промыть в мыльной воде и/ или протереть бумагой или ветошью.
2. Для удаления пятен на медной поверхности и некрасивой патины:
- можно взять 9% уксус и мелкую пищевую соль. Из этих двух компонентов делают пасту, которой натирают медь, после чего пасту смывают, и ваше украшение блестит, как новое;
ВНИМАНИЕ: при этом методе счищается ВСЯ патина, т.е. если вы хотите сохранить состаренный вид изделия, данный метод не применять.
- ярко-зеленый налет на медном изделии можно удалить с помощью 10%-ного раствора лимонной кислоты — опустить изделие в нагретый раствор или протереть половинкой лимона. и промыть водой;
ВНИМАНИЕ: при этом методе счищается ВСЯ патина обработанная поверхность приобретает красновато-розовый оттенок, т.е. если вы хотите сохранить состаренный вид изделия, данный метод не применять.
3. Для удаления царапин и крохотных вмятин поверхность изделия можно потереть наждачной бумагой — нулевкой. Выбирать наждачку нужно внимательно, так как слишком грубая оставит полосы и может испортить внешний вид изделия. Самая подходящая — имеющая зернистость 2500 и выше.
ВНИМАНИЕ: не применять, если изделие имеет декоративную патину и вставки — камни, стекло, эмаль (есть риск их поцарапать даже нулевкой).
Хранить медные украшения надо подальше от прямого солнечного света, парфюмерии и воды.
Большое спасибо за внимание! :)
www.livemaster.ru











