Образовательный блог — всё для учебы. Строение и свойства металлов
Строение и свойства металлов
Характерными свойствами металлов являются наличие металлического блеска и пластичности, высокая электро- и теплопроводность. Характерные свойства металлов обусловлены их строением.
Атомы металлов не однородны. Атом состоит из положительно заряженного тяжелого ядра, и окружающих ядро отрицательно заряженных электронов. Число электронов равно порядковому номеру элемента в таблице Д.И. Менделеева. В ядре атома находятся положительно заряженные элементарные частицы, называемые протонами. Количество протонов равно количеству окружающих ядро электронов. Кроме протонов, в ядре находятся тяжелые электрически нейтральные частицы – нейтроны. Масса электрона в 1840 раз меньше массы протона или нейтрона. Таким образом, вся масса атома сосредоточена в его ядре.
Электроны быстро вращаются вокруг ядра. Внешние, так называемые валентные, электроны у всех металлов относительно слабо связаны с ядром. Слабой связью внешних валентных электронов с ядром и объясняются характерные металлические свойства.
ЗамечаниеМежду понятием «металл» как химический элемент и как вещество есть некоторая разница. Химия делит все элементы на металлы и неметаллы по их поведению в химических реакциях. Теория металлического состояния рассматривает крупные скопления атомов металлов, в котором они обладают характерными металлическими свойствами: пластичностью, высокой тепло- и электропроводностью, металлическим блеском. Эти свойства характерны для больших групп атомов. У отдельных атомов таких свойств нет.
Атомы в металле находятся в ионизированном состоянии. Атомы металлов, отдавая часть внешних валентных электронов, превращаются в положительно заряженные ионы. Свободные электроны непрерывно перемещаются между ними, образуя подвижный электронный газ.
При комнатной температуре все металлы, кроме ртути, представляют собой твердые тела, имеющие кристаллическое строение. Для кристаллов характерно строго определенное расположение в пространстве ионов, образующих кристаллическую решетку.
Металлы имеют кристаллические решетки различных типов. Каждая кристаллическая решетка может быть охарактеризована элементарной кристаллической ячейкой.
Элементарная кристаллическая ячейка – наименьший комплекс атомов, повторяя который многократно, можно построить весь кристалл.
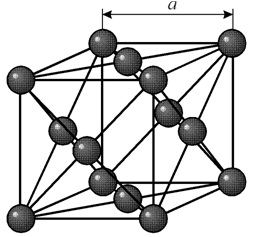
У металлов чаще всего встречаются три типа элементарных кристаллических ячеек:В кубической объемноцентрированной (ОЦК) решетке восемь ионов располагаются по вершинам и один в центре куба, на пересечении диагоналей. Объемноцентрированную кубическую решетку имеют кристаллы железа при комнатной температуре, хрома, вольфрама, молибдена, ванадия и др. Эта решетка характеризуется всего одним параметром решетки – расстоянием между центрами двух ионов, расположенных по одному ребру, обозначенным на рисунке а.
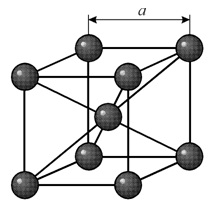 Многие металлы, используемые в технике, имеют гранецентрированную кубическую решетку. В элементарной решетке гранецентрированного куба ионы расположены по вершинам куба и в центре каждой грани (на пересечении ее диагоналей). Центр куба остается свободным. Такую кристаллическую решетку имеют кристаллы меди, никеля, алюминия, свинца, серебра и др. гранецентрированная решетка также характеризуется одним параметром – длиной ребра куба а.
Многие металлы, используемые в технике, имеют гранецентрированную кубическую решетку. В элементарной решетке гранецентрированного куба ионы расположены по вершинам куба и в центре каждой грани (на пересечении ее диагоналей). Центр куба остается свободным. Такую кристаллическую решетку имеют кристаллы меди, никеля, алюминия, свинца, серебра и др. гранецентрированная решетка также характеризуется одним параметром – длиной ребра куба а.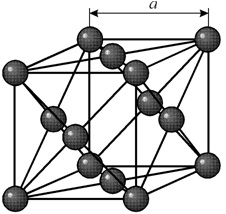
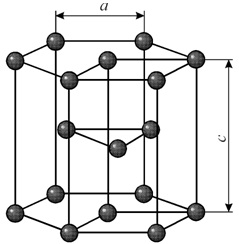 Гексагональная решетка характеризуется двумя параметрами: а и с. Наибольшая плотность упаковки достигается при соотношении параметров с/а = 1.633. Гранецентрированная решетка с таким соотношением параметров называется гранецентрированной плотноупакованной. Такую решетку имеют титан, цирконий, кобальт, цинк, магний и др.
Гексагональная решетка характеризуется двумя параметрами: а и с. Наибольшая плотность упаковки достигается при соотношении параметров с/а = 1.633. Гранецентрированная решетка с таким соотношением параметров называется гранецентрированной плотноупакованной. Такую решетку имеют титан, цирконий, кобальт, цинк, магний и др. Строение металлических сплавов
Под металлическим сплавом понимают вещество, получаемое сплавлением двух или более элементов, обладающее характерными металлическими свойствами.
Металлические сплавы получают сплавлением элементов – металлов или металлов с неметаллами при преимущественном содержании металлов. Строение сплавов сложнее, чем чистых металлов.
При кристаллизации жидкого сплава могут получаться твердые металлические сплавы с различным строением.
Механическая смесь двух чистых металлов А и В получается в том случае, когда в процессе кристаллизации сплава из жидкого состояния разнородные атомы не входят в общую кристаллическую решетку. В механической смеси каждый металл образует самостоятельные кристаллы. Кристаллы каждого их металлов, находящиеся в этом сплаве, обладают теми же строением и свойствами, которыми они обладают в куске чистого металла.
Твердый раствор – сплав, у которого атомы растворимого элемента размещены в кристаллической решетке растворителя. На микрошлифе твердого раствора кристаллы после травления выглядят одинаково. В кристаллах твердого раствора существует только один тип кристаллической решетки. Растворителем является тот элемент, кристаллическую решетку которого имеет твердый раствор. Растворимый элемент может либо замещать элемент-растворитель в узлах кристаллической решетки, либо располагаться в междоузлиях. По типу расположения атомов растворимого элемента в кристаллической решетке твердые растворы делят на две группы: замещения и внедрения.
Твердые растворы внедрения образуют металлы с неметаллами. Атомы неметаллов меньше атомов металлов. Поэтому атомы неметаллов могут располагаться в междоузлиях кристаллической решетки металлов. Внедрившийся атом вызывает искажение решетки металла-растворителя. Все твердые растворы внедрения – растворы с ограниченной растворимостью.
Химические соединения металлы образуют как с металлами так и с неметаллами. Химическое соединение характеризуется определенной температурой плавления, скачкообразным изменением свойств при изменении состава. Химические соединения металлов с неметаллами образуются при строго определенных соотношениях входящих в них элементов, соответствующих нормальным валентностям. Химические соединения обладают повышенной твердостью и пониженной пластичностью. Кристаллическая решетка химического соединения имеет сложное строение.
Диаграмма состояния
Диаграмма состояния представляет собой графическое изображение состояния сплава. Если изменится состав сплава, его температура, давление, то состояние сплава изменится, и это находит отражение в диаграмме состояния.
Диаграмма состояния показывает устойчивые состояния, которые при данных условиях обладают минимальным уровнем свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, поскольку показывает, какие при данных условиях существуют равновесные фазы. Следовательно, и изменения в состоянии, которые отображены на диаграмме, относятся к равновесным условиям, т.е. при отсутствии перенагрева или переохлаждения. Так как превращения в отсутствии перенагрева или переохлаждения в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай.
Общие закономерности сосуществования устойчивых фаз, отвечающих теоретическим условиям равновесия, описываются правилом фаз или законом Гиббса.
Закон Гиббса дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов.Фазой называется однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачком.
Однородная жидкость – однофазная система.Смесь двух видов кристаллов – двухфазная система.Компонентами называются вещества, образующие систему.Чистый металл – однокомпонентная система.Сплав двух металлов – двухкомпонентная система.
Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма состояния системы железо-углерод. Это объясняется наиболее широким применением в технике железоуглеродистых сплавов.
Диаграмма железо-углерод относится к диаграммам состояния для сплавов с ограниченной растворимостью. Диаграмма железо-углерод, как ясно из названия, должна распространяться от железа до углерода. Железо образует с углеродом ряд химических соединений, но надежно установлено лишь одно Fe3C – карбид железа или цементит. Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму изучать по частям.
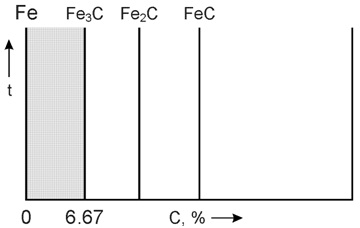
Следовательно, рассматривая диаграмму железо-углерод на участке от железа до цементита, мы можем компонентами системы считать железо и цементит.
Рассмотрим свойства отдельных компонентов.Железо. Температура плавления 1539 °С. Железо аллотропическое вещество. Атомы элемента могут образовывать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
В ряде случаев (и для железа в том числе) при изменении температуры или давления может оказаться, что для одного и того же металла более устойчивой будет другая решетка, чем та, которая была при другой температуре или давлении.
Так для железа характерны две кристаллические решетки:• объемноцентрированный куб;• гранецентрированный куб.
Существование одного металла в нескольких кристаллических формах носит название полиморфизма или аллотропии. Различные кристаллические формы одного и того же вещества называются полиморфными или аллотропическими модификациями. Аллотропические формы обозначаются греческими буквами α, β, γ и т.д., которые в виде индексов добавляются к символу, обозначающему элемент. Аллотропическая форма, существующая при самой низкой температуре, обозначается через α, следующая через β и т.д. Превращение одной аллотропической формы в другую при нагреве чистого металла сопровождается поглощением тепла и происходит при постоянной температуре. На термической кривой превращение отмечается горизонтальным участком. При охлаждении происходит выделение тепла теоретически при той же температуре, что и при нагреве, но практически при более низкой вследствие переохлаждения.
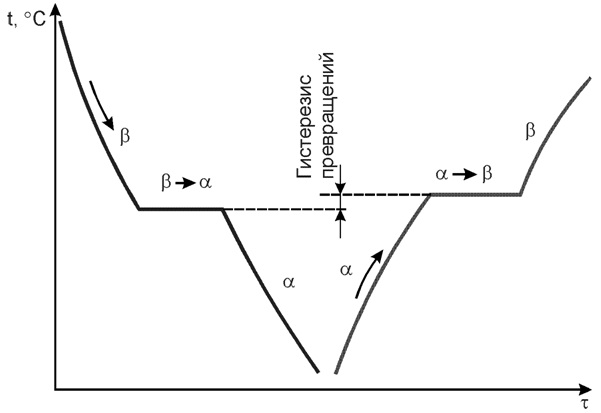 Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии.
Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии.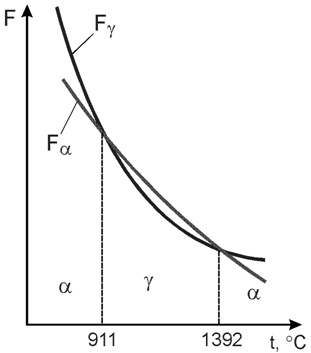 Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация α, а в другом модификация γ.
Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация α, а в другом модификация γ.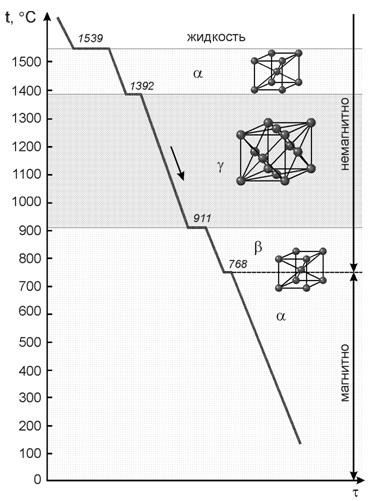 Железо имеет две температуры полиморфного превращения: 911 и 1392 °С.
Железо имеет две температуры полиморфного превращения: 911 и 1392 °С. Особо следует рассмотреть образование растворов углерода в железе. Растворимость С в Fe существенно зависит от того, в какой кристаллической форме существует железо.
Диаметр атома углерода (в свободном состоянии) равен 1.54 A. В объемноцентрированной решетке имеется 12 свободных мест в середине ребер. Диаметр такого свободного места 0.62 A. Такой объем явно недостаточен для помещения в нем атома углерода.
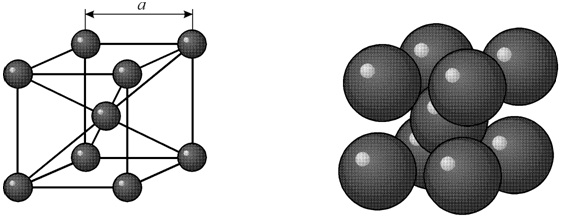
В гранецентрированной кристаллической решетке в центре имеется пора диаметром 1.02 A. В этой поре атом углерода может поместиться, вызывая естественно некоторое увеличение размера решетки γ-железа.
Таким образом, геометрические соображения подсказывают, что α-железо не растворяет, а γ-железо растворяет углерод. В действительности α-железо растворяет углерод, но в очень небольшом количестве ≈ 0.02%.
 Твердый раствор углерода в α-железе называется ферритом, а в γ-железе аустенитом.
Твердый раствор углерода в α-железе называется ферритом, а в γ-железе аустенитом. Цементит. Цементит – это химическое соединение углерода с железом (карбид железа Fe3C).
Так как растворимость углерода в α-железе мала, то при нормальных температурах в подавляющем большинстве случаев в структуру стали входят высокоуглеродистые фазы в виде цементита.
Кристаллическая структура цементита очень сложна.
 Температура плавления цементита 1600 °С. Аллотропических превращений не испытывает. Цементит имеет высокую прочность ~ 800 НВ и практически нулевую пластичность.
Температура плавления цементита 1600 °С. Аллотропических превращений не испытывает. Цементит имеет высокую прочность ~ 800 НВ и практически нулевую пластичность. all4study.ru
Строение металлов и их свойства
Все металлы имеют кристаллическую структуру. В расплавленном состоянии атомы металлов находятся в беспорядочном движении, а при переходе в твердое состояние они ориентируются определенным образом в пространстве, образуя кристаллическую решетку. Строение решетки и расположение в ней атомов зависит от вида металла. Наиболее распространенными типами кристаллической решетки являются кубическая – у железа и гексагональная – у алюминия.
Рассмотренные виды кристаллических решеток характерны для идеальных кристаллов. Для реальных металлов и сплавов характерно наличие различных дефектов. Дефекты бывают точечные, линейные, и поверхностные. К самым простым точечным дефектам относятся вакансии и межузельные атомы.
Вакансией называется пустой узел кристаллической решетки. Межузельным атомом называется атом, перемещенный из узла в позицию между атомами. Вакансии и межузельные атомы имеются в кристаллах при любой температуре выше абсолютного нуля из-за тепловых колебаний атомов.
К линейным дефектам относятся дислокации. Дислокации образуются за счет нарушения правильного чередования атомных плоскостей при кристаллизация, а также в результате большого числа вакансий.
Поверхностные дефекты образуются в более крупных структурах металла, например, на границе зерен, т.е. групп кристаллов, которые могут быть сориентированы в пространстве различным образом.
Все физико-механические свойства металлов и их особенности являются следствием кристаллической решетки. Высокая прочность металлов объясняется наличием сил, удерживающих атомы в определенных местах кристаллической решетки. В основе упругих деформаций лежит обратимое смещение атомов кристаллической решетки от положения равновесия. В основе пластического деформирования металлов лежит перемещение дислокаций практически при любых температурах и нагрузках.
Основные свойства металлов:
Наличие плоскостей скольжения.
Плоскость скольжения обычно возникает в кристалле в месте наибольшей концентрации атомов.
Наклеп.
Наклеп – это упрочнение металла в процессе его пластической деформации.
Сущность наклепа состоит в том, что при перемещении одних частей кристаллов относительно других по плоскостям скольжения, искажается их форма, они поворачиваются, часть кристаллов может претерпеть излом, что приводит к образованию структуры типа мозаичной. Это приводит к увеличению сопротивления металла деформациям, а следовательно, к повышению его прочности.
Полиморфность.
Свойство металла иметь несколько модификаций. Многие металлы, например железо, могут переходить из одной модификации в другую, т.е. могут иметь различные типы кристаллической решетки.
Применение металлов в строительстве
По применению, стали подразделяются на конструкционные и инструментальные. Конструкционные стали используются для изготовления различных строительных конструкций и деталей машин, а инструментальные – для изготовления инструмента (применяются высокоуглеродистые стали).
Строительные стали, являются малоуглеродистыми. Среднеуглеродистые стали, в основном применяют в машиностроении.
Строительные и машиностроительные стали относят к группе конструкционных сталей.
По механическим характеристикам конструкционные стали делят на семь марок: СтО, Ст1, Ст2, СТЗ, Ст4, Ст5, Ст6. Основными строительными сталями являются СтЗ и Ст5, из которых изготавливают несущие металлические конструкции и арматуру для железобетона. Из сталей Ст4 и Ст5 изготавливают также болты, шурупы и т.д.
Углеродистые стали обыкновенного качества в зависимости от гарантируемых свойств объединяют в группы А, Б и В. В маркировке эту букву добавляют спереди, а в конце маркировки - способ раскисления: спокойный - сп, полуспокойный - пс, кипящий - кп, например: АСтЗпс, ВСт4пс. По группе А стали поставляют с гарантированными механическими свойствами, по группе Б - химическому составу, по группе В - по механическим свойствам и химическому составу.
По требованиям ударной вязкости в зависимости от температурных условий эксплуатации и назначения конструкций углеродистые стали разделяют на 6 категорий (номер категории указывают в конце маркировки после обозначения способа раскисления), например, ВСтЗкп2.
Легированные конструкционные, в том числе и строительные стали маркируют следующим образом. Первые две цифры показывают содержание углерода в сотых долях процента. Затем следуют условные обозначения легирующих элементов. Цифра, стоящая за условным обозначением, показывает приблизительное содержание элемента в процентах. Например, сталь 18Гсп в среднем содержит 0,18% углерода и приблизительно 1% марганца. Буквы «сп» обозначают, что сталь спокойная (по способу раскисления). Сталь 20ХГ2С в среднем содержит 0,2% углерода, приблизительно 1% хрома, приблизительно 2% марганца и приблизительно 1% кремния. Если количество легирующих добавок менее 0,3%, то обозначение легирующего элемента не проставляется. Буква А в конце марки означает, что сталь высококачественная. В строительстве применяют низколегированные стали (по экономическим соображениям): 18Г, 09Г2; 10Г2С1;20ХГ2С и др.
Большое влияние на механические характеристики сталей оказывает содержание углерода. С повышением содержания углерода твердость стали увеличивается, а пластичность уменьшается. Упругость сталей изменяется мало. Модуль упругости изменяется в пределах 2*105 - 2,06-105 Мпа. Предел прочности увеличивается до содержания углерода 0,8-1,0%, а затем снижается.
В строительстве сталь применяют в виде прокатных изделий, имеющих различную форму поперечного сечения – профиль. Используют сталь в строительстве для изготовления несущих конструкций: колонн, балок, ферм. Из низколегированных сталей изготавливают различные виды арматуры периодического профиля (для железобетона). Также сталь используется для изготовления оконных и дверных переплетов.
Основным способом получения стальных изделий являются горячая прокатка. Этим способом получают различные профили, листы, стержни, трубы. Изделия в этом случае называют горячекатанными.
Важной особенностью сталей является способность улучшать свои физико-механические свойства и, в частности, прочность в результате термической и механической обработки.
К термическим видам обработки, применяемым для строительной стали, относят закалку и отпуск. Закалка стали заключается в нагреве ее до высоких температур с последующим охлаждением в воде, масле, расплавленном свинце. Структура и свойства закаленных сталей зависят от скорости охлаждения. Стали, прошедшие закалку, имеют повышенную прочность и твердость, однако при этом имеют склонность к хрупкому разрушению.
Отпуск стали производят с целью уменьшения внутренних напряжений, возникающих при закалке, а также для снижения хрупкости и твердости закаленной стали. Стали при этом нагревают до температуры не выше 600°С и после изотермической выдержки постепенно охлаждают.
Проволоку изготовляют путем вытяжки (волочения). Некоторые виды арматуры периодического профиля изготовляют путем холодного сплющивания. И в том и в другом случае сталь упрочняется за счет наклепа. Арматуру при этом называют холоднотянутой.
Арматуру классифицируют по четырем признакам:
в зависимости от технологии изготовления различают стержневую и проволочную арматуру. Под стержневой в данной классификации подразумевают арматуру любого диаметра в пределах d=6...40 мм;
в зависимости от способа последующего упрочнения горячекатаная арматура может быть термически упрочненной, т.е. подвергнутой термической обработке, или упрочненной в холодном состоянии — вытяжкой, волочением
по форме поверхности арматура бывает периодического профиля и гладкой. Выступы в виде ребер на поверхности стержневой арматуры периодического профиля, рифы или вмятины на поверхности проволочной арматуры значительно улучшают сцепление с бетоном;
по способу применения при армировании железобетонных элементов различают напрягаемую арматуру, т.е. подвергаемую предварительному натяжению, и ненапрягаемую.
Стержневая горячекатаная арматура в зависимости от ее основных механических характеристик подразделяется на шесть классов с условным обозначением: А-I, А-II, А-III, А-IV, А-V, А-VI. Термическому упрочнению подвергают стержневую арматуру четырех классов; упрочнение в ее обозначении отмечается дополнительным индексом «т»: Ат-III, Ат-IV, Ат-V, Ат-VI. Дополнительной буквой С указывается на возможность стыкования сваркой, буквой К — на повышенную коррозионную стойкость. Подвергнутая вытяжке в холодном состоянии стержневая арматура класса А-III, отмечается дополнительным индексом В.
Каждому классу арматуры соответствуют определенные марки арматурной стали с одинаковыми механическими характеристиками, но различным химическим составом. В обозначении марки стали отражается содержание углерода и легирующих добавок.
Стержневая арматура всех классов имеет периодический профиль за исключением круглой (гладкой) арматуры класса А-I.
Арматурную проволоку диаметром 3...8 мм подразделяют на два класса: Вр-I — обыкновенная арматурная проволока (холоднотянутая, низкоуглеродистая), предназначенная главным образом для изготовления сварных сеток; В-II, Вр-II—высокопрочная арматурная проволока (многократно волоченная, углеродистая), применяемая в качестве напрягаемой арматуры предварительно напряженных элементов. Периодический профиль обозначается дополнительным индексом «р»: Вр-I, Вр-II.
Применение в строительстве алюминиевых сплавов:
Чистый алюминий применяют для устройства кровли здания.
Из лент алюминия, переплетенных друг с другом, делают бесчердачные покрытия большого пролета. Остается лишь положить теплую кровлю.
Из прокатных профилей изготавливают оконные и дверные переплеты.
Из проката изготовляют фермы и арки для перекрытия больших пролетов. Выигрыш малый вес.
Сборно-разборочные сооружения различного типа.
Несущие конструкции верхних этажей зданий в сейсмических районах, а также в зданиях с агрессивными средами.
Листы из алюминиевых сплавов применяют для облицовки внутренних и наружных стен.
studfiles.net
2. Структура и свойства металлов
2.1 Общая характеристика и классификация металлов
В технике под металлами понимают материалы, обладающие целым комплексом специфических физических, химических, технологических, эксплуатационных и механических свойств.
Физические свойстваотражают поведение материалов в различных тепловых, электромагнитных и гравитационных полях. К наиболее характерным физическим свойствам металлов следует отнести металлический блеск, высокую электро- и теплопроводность, способность испускать электроны при нагреве, а также сравнительно высокую плотность большинства металлов.
Химические свойстваотражают способность материалов взаимодействовать с другими веществами. С точки зрения химических свойств металлы это химические элементы, расположенные в левой части таблицы Менделеева. Атомы этих элементов содержат на внешней электронной оболочке небольшое число электронов, слабо связанных с ядром. Вступая в химические взаимодействия с неметаллами, атомы металлов легко отдают им свои внешние валентные электроны и становятся положительно заряженными ионами.
Технологические свойстваотражают способность материалов подвергаться тому или иному виду обработки. К наиболее характерным технологическим свойствам металлов следует отнести их относительно хорошую деформируемость (в частности, штампуемость и ковкость), а также хорошую свариваемость и возможность получать изделия методом литья.
Эксплуатационные свойства характеризуют поведение материалов в реальных условиях эксплуатации. Среди эксплуатационных свойств металлов можно выделить их неплохую износостойкость.
Механические свойстваотражают способность материалов сопротивляться деформации и разрушению под воздействием различного рода нагрузок. К наиболее характерным механическим свойствам металлов относят их достаточно высокую пластичность и вязкость, а также твёрдость и прочность.
Физические и химические свойства металлов наиболее подробно изучаются в рамках дисциплин «Физика» и «Химия». Материаловедение большее внимание уделяет механическим и технологическим свойствам материалов.
Все металлы делят на две большие группы: на чёрные металлы и цветные металлы.
Чёрные металлы отличаются специфическим темно-серым цветом, высокой температурой плавления и относительно высокой твёрдостью. Цветные металлы имеют характерную белую, желтую или красную окраску, и отличаются от чёрных металлов большей пластичностью, меньшей твёрдостью и невысокой температурой плавления.
Чёрные металлы, в свою очередь, подразделяют на 5 групп:
1. Металлы группы железа – Fe, Cо, Ni и Mn.
Fe составляет основу самых распространённых в промышленности сплавов – сталей и чугунов. Остальные металлы этой группы применяются либо в качестве добавок к железоуглеродистым сплавам, либо в качестве основы для соответствующих сплавов (кобальтовых, никелевых и т.п.).
2. Тугоплавкие металлы – Ti, V, Cr, Mo, W и др.
Металлы этой группы имеют температуру плавления выше, чем у железа, т.е. более 1539°С. Их обычно используют в качестве добавок к легированным сталям, либо в качестве основы для специальных сплавов (например, титановых или хромовых). Вольфрам в чистом виде используют для изготовления нитей накала электроламп.
3. Урановые металлы или актиноиды – Ac, Th и т.д. Применяются, как правило, для изготовления сплавов, используемых в атомной энергетике.
4. Редкоземельные металлы или лантаноиды – La, Ce и т.д. Эти металлы обычно встречаются в смешанном виде и имеют близкие свойства. Их используют для изготовления специальных сплавов, обладающих особыми физическими и иными свойствами.
5. Щелочные металлы – Li, Na, K и т.д. Отличаются высокой химической активностью и поэтому в свободном виде не используются.
Цветные металлы подразделяют на 3 группы:
1. Легкие металлы – Al, Mg, Be. Обладают сравнительно низкой плотностью. Al из-за своей высокой электропроводности широко применяется для изготовления электропроводов. Кроме того, Al используют для получения алюминиевых сплавов, широко применяемых в машиностроении.
2. Благородные металлы – Ag, Au, Pt и т.д. в том числе Cu. Данные металлы отличаются высокой пластичностью, электропроводностью и коррозионной стойкостью. Благодаря этим свойствам они широко применяются в микроэлектронике и ювелирном деле. Медь используют также для получения бронз и латуней. Слитки благородных металлов, размещённые в банках, играют роль фактических денег.
3. Легкоплавкие металлы – Sn, Pb, Zn, Hg и т.д. Имеют сравнительно низкую температуру плавления. Температура плавления ртути (Hg) ниже комнатной и поэтому данный металл в обычных условиях является жидким. Sn и Pb используют для изготовления припоев, те сплавов, служащих для соединения деталей методом пайки.
Наиболее распространенным металлом на земном шаре является алюминий (8,8%). На втором месте находится железо (4,65%), которое к тому же является одним из наиболее дешёвых металлов.
studfiles.net
Строение и свойства металлов. | Kursak.NET
Металлы – это твердые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, высокой тепло- и электропроводностью.
Твердые вещества по взаимному расположению атомов делятся на аморфные и кристаллические (Рис.1.).
Аморфными называют твердые вещества, атомы которых располагаются в пространстве хаотично. К таким веществам относят стекло, смолу, канифоль и др.
Кристаллическими называют твердые вещества, в которых атомы расположены в пространстве в строго определенном порядке.

Рис. 1. Строение кристаллического (1) и аморфного (2) вещества.
Типы связей в металлах и неметаллах.
Внутренняя связность вещества – это результат сил взаимодействия между составляющими его частицами, которые могут взаимно притягиваться или отталкиваться.
Возникновение и величина сил взаимодействия между частицами, образующими вещество, зависят от типа их связей.
Различают четыре основных типа связи: 1) ионная, 2) ковалентная, 3) металлическая, 4) межмолекулярная.
Ионная связь возникает между такими атомами, у одного из которых на внешней оболочке содержится мало электронов, а у другого она почти заполнена.
Ковалентная связь возникает, когда соседние атомы, стремясь заполнить свои внешние оболочки, объединяют требуемые для этого электроны.
Если на внешней оболочке меньше четырех электронов – что типично для металлов,- то все внешние электроны атомов внутри структурной единицы вещества образуют так называемый электронный газ, при этом каждый электрон свободно движется между атомными остовами и не принадлежит ни отдельному атому, ни какой либо малой группе их. Такая связь, называемая металлической, обусловлена взаимодействием между отрицательно заряженным электронным газом и положительно заряженными ионами – остовами атомов. Наличие металлической связи объясняет характерные свойства металлов. Благодаря свободным электронам при пластической деформации связь между ионами не нарушается и разрушения не происходит, что объясняет высокую пластичность металлов. Наличие свободных электронов обуславливает высокую электро- и теплопроводность металлов. С понижением температуры ослабляются тепловые колебания ионов, что повышает электропроводность и в ряде случаев приводит к явлению сверхпроводимости при температурах, близких к абсолютному нулю. Характерный металлический блеск объясняется взаимодействием световых волн со свободными электронами.
Межмолекулярная связь обусловлена силами, которые называют силами Ван-дер-Ваальса. Их природа пока недостаточно ясна.
Основные типы кристаллических решеток.
Атомы различных металлов различны, поэтому каждый металл имеет свои определенные свойства. Эти свойства зависят от расположения атомов между собой, характера их связей, от величины расстояния между ними. Металлы различаются не только порядком расположения атомов, но и кристаллической решеткой (Рис. 2.). Кристаллическая решетка представляет собой воображаемую пространственную сетку, состоящую из элементарных ячеек, в узлах которой находятся атомы. Различают следующие кристаллические решетки металлов с плотной упаковкой атомов: кубическую объемно-центрированную, кубическую гранецентрированную и гексагональную (Рис. 3.).
Атомы в кристаллической решетке находятся на определенных расстояниях друг от друга. Расстояние между центрами атомов, находящихся в двух в двух соседних узлах решетки называются параметрами или периодами решетки. Параметры решетки очень малы и измеряются в нанометрах
|
|
|
|
|
|
(1 нм = 10-9м).
Рис. 2. Типы кристаллических решеток металлов в виде шаровых упаковок: 1 – медь, 2 – магний, 3 – железо.

Рис. 3.
а) схематическое изображение простейшей кристаллической решетки кристалла и ее элементарной ячейки.
б) кубическая объемно-центрированная элементарная ячейка
(  -железо, хром, вольфрам, молибден, натрий и др.)
-железо, хром, вольфрам, молибден, натрий и др.)
9 атомов.
в) кубическая гранецентрированная элементарная ячейка (медь, свинец, золото, алюминий и др.) 14 атомов.
г) гексагональная элементарная ячейка (цинк, кадмий) 17 атомов.
Дефекты кристаллической решетки
Реальный металлический кристалл всегда имеет большое количество дефектов кристаллического строения, которые нарушают периодичность расположения атомов в кристаллической решетке. Дефекты оказывают значительное влияние на свойства металла. По геометрическим признакам они подразделяются на точечные, линейные, поверхностные.
Точечные дефекты малы во всех трех измерениях. К точечным дефектам относятся вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы, а также замещенные атомы примеси и внедренные атомы (Рис.4.).

а) б) в)
Рис.4. Схемы точечных дефектов в кристаллах
а) вакансия
б) замещенный атом
в) внедренный атом
Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем. Эти дефекты называют дислокациями.
Краевая дислокация (Рис.5.) представляет собой искажение кристаллической решетки, вызванное наличием «лишней» атомной полуплоскости (экстраплоскости).

Рис.5.Схема краевой дислокации
Винтовая дислокация (Рис.6.) является разновидностью линейных дефектов кристаллической решетки. Она формируется и перемещается при сдвиге одной части кристалла относительно другой по какой-нибудь плоскости под действием внешних сдвиговых (касательных) сил Р (перемещение дислокации АВ…А/В/).

Рис.6. Схема винтовой дислокации
Свойства тел кристаллического строения.
1. Благодаря правильному расположению атомов, кристаллические тела могут приобретать правильную форму, соответствующую той или иной геометрической фигуре.
Правильная внешняя форма, получаемая при определенном взаимном расположении атомов, называется полным кристаллом, или монокристаллом. Обычно кристаллы имеют неправильную внешнюю форму, и тогда их называют кристаллитами, или зернами.
2. Упорядоченное расположение атомов в кристаллической решетки позволяет четко выделить отдельные кристаллографические направления и плоскости.
Кристаллографическими направлениями являются прямые или лучи, выходящие из какой либо точки отсчета, вдоль которых на определенном расстоянии друг от друга располагаются атомы. Точками отсчета могут служить вершины куба, при этом кристаллографическими направлениями, являются его ребра и диагонали граней.
Кристаллографическими плоскостями являются плоскости, на которых лежат атомы, например, грани куба или его диагональные плоскости (Рис.7.).

Рис.7. Основные кристаллографические плоскости: а – плоскость додэкаэдра, б – плоскость октаэдра, в – плоскость куба.
Если рассмотреть расположение атомов в различных плоскостях кристаллической решетки, то обнаружится, что насыщенность атомов в различных плоскостях кристаллической решетки неодинакова; неодинаковы также междуатомные расстояния. Этим объясняется различие свойств металлов в разных плоскостях кристаллической решетки, называемое анизотропией (анизотропностью) кристаллов. Аморфные тела имеют беспорядочную насыщенность атомов в различных плоскостях решетки. Поэтому их свойства одинаковы во всех направлениях плоскостей кристалла – они изотропны.
Кристаллы в металле могут ориентироваться правильно, либо неправильно. При правильной ориентировки одинаковые кристаллографические плоскости совпадают, при неправильной – не совпадают. Чаще всего ориентировка кристаллов бывает неправильная. Поэтому свойства металлов получаются в среднем одинаковые во всех направлениях плоскостей тела. Такие тела называются квазизотропными.
3. Некоторые металлы, например железо, титан, олово и другие, способны по достижению определенных температур изменять свое кристаллическое строение, перестраивая тип элементарной ячейки (Рис.8.). Данное явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными. Сущность аллотропии состоит в том, что при определенных температурах в твердом металле возникают новые центры кристаллизации, в процессе роста которых образуется новая решетка. Формирование новой решетки происходит с поглощением тепла при нагревании и с выделением тепла при охлаждении. Поэтому в период перестройки решетки температура остается неизменной. Различные формы кристаллической решетки для данного металла называются модификациями. Эти модификации обозначают буквами α, β, γ, δ.

Рис.8. Кривая охлаждения чистого железа и его аллотропические изменения.
kursak.net
2 .Физические свойства металлов.
Строение металлов
Исследование структуры металла проводят путем изучения макроструктуры с увеличением до 10 раз и без увеличения; микроструктуры с увеличением от 10 до 2000 раз на оптических микроскопах и до 100 000 раз на электронных микроскопах, атомной структуры – рентгенографическим анализом. Металлы представляют собой кристаллические тела с закономерным расположением атомов в узлах пространственной решетки. Решетки состоят из ряда кристаллических плоскостей, расположенных друг от друга на расстоянии нескольких нанометров (1 нм = 10-9 м). Для железа эти расстояния 28,4 нм (α=Fe) и 36,3 нм (γ = Fe). Большинство металлов имеет пространственные решетки в виде простых геометрических фигур. Отдельные участки кристаллической решетки прочно связаны между собой в комплексы – зерна. Взаимное расположение зерен отдельных элементов и сплавов определяет структуру металлов и их свойства. Атомы металлов характеризуются малым количеством электронов (1...2) на наружной оболочке, легко отдают их, что подтверждается высокой электропроводностью. Черные металлы имеют простые кубические ячейки решеток двух видов: а) центрированный или объемно-центрированный куб (9 атомов в ячейке), объем шаров занимает 68 %; б) гранецентрированный или куб с центрированными гранями (14 атомов), объем шаров занимает 74 %. Некоторые цветные металлы и их сплавы имеют гексагональную (шестигранную) решетку. Железо, олово, титан и другие металлы обладают свойствами аллотропии, т.е. способностью одного и того же химического элемента при различной температуре иметь разную кристаллическую структуру. Аллотропические превращения сопровождаются выделением или поглощением теплоты. Железо имеет четыре аллотропические формы: α-Fe; β-Fe, γ-Fe, δ-Fe. Практическое значение имеют α -Fe и γ -Fe, так как p-Fe и б-Fe отличаются от a-Fe только величиной межатомного расстояния, а для β-Fe характерно отсутствие магнитных свойств. Температура, при которой происходит переход металла из одного аллотропического вида в другой, называется критической. Величины этих температур видны на диаграмме охлаждения и нагревания чистого железа в виде участков, свидетельствующих о том, что фазовые превращения происходят с выделением теплоты при нагревании.
Все металлы находятся в твердом состоянии до определенной температуры. При нагреве металла амплитуда колебания атомов достигает некоторой критической величины, при которой происходят разрушение кристаллической решетки и переход металлов из твердого в жидкое состояние. Процесс кристаллизации заключается в росте кристаллов путем отложения новых кристаллических групп вокруг возникших зародышей. Рост кристаллических образований происходит в определенных направлениях. Вначале образуются главные оси кристалла путем роста в трех взаимно перпендикулярных направлениях, а затем от каждой из этих осей образуются новые и возникает не полностью завершенный кристалл, называемый дендритом. В дальнейшем все промежутки между осями дендрита заполняются упорядоченно расположенными атомами. В условиях несвободной кристаллизации образующиеся кристаллы получают неправильные очертания и форму и называются кристаллитами или зернами. Величина зерен оказывает существенное влияние на механические свойства металлов: чем мельче зерна, тем прочнее металл. Технические металлы и сплавы представляют собой поликристаллические тела, состоящие из большого числа различно ориентированных кристаллических зерен (поперечные размеры зерен – 0,001...0,1 мм). Поэтому в целом металлы и сплавы можно считать условно изотропными телами.
Группы металлов.
В настоящее время известно 105 химических элементов, большинство из
них - металлы. Последние весьма распространены в природе и встречаются в
виде различных соединений в недрах земли, водах рек, озер, морей, океанов,
составе тел животных, растений и даже в атмосфере.
По своим свойствам металлы резко отличаются от неметаллов. Впервые
это различие металлов и неметаллов определил М. В. Ломоносов. «Металлы, -
писал он, - тела твердые, ковкие блестящие».
Причисляя тот или иной элемент к разряду металлов, мы имеем в виду
наличие у него определенного комплекса свойств:
1. Плотная кристаллическая структура.
2. Характерный металлический блеск.
3. Высокая теплопроводность и электрическая проводимость.
4. Уменьшение электрической проводимости с ростом температуры.
5. Низкие значения потенциала ионизации, т.е. способность легко
отдавать электроны.
6. Ковкость и тягучесть.
7. Способность к образованию сплавов.
Все металлы и сплавы, применяемые в настоящее время в технике, можно
разделить на две основные группы. К первой из них относят черные металлы -
железо и все его сплавы, в которых оно составляет основную часть. Этими
сплавами являются чугуны и стали. В технике часто используют так называемые
легированные стали. К ним относятся стали, содержащие хром, никель,
вольфрам, молибден, ванадий, кобальт, титан и другие металлы. Иногда в
легированные стали входят 5-6 различных металлов. Методом легирования
получают различные ценные стали, обладающие в одних случаях повышенной
прочностью, в других - высокой сопротивляемостью к истиранию, в третьих -
коррозионной устойчивостью, т.е. способностью не разрушаться под действием
внешней среды.
Ко второй группе относят цветные металлы и их сплавы. Они получили
такое название потому, что имеют различную окраску. Например, медь светло-
красная, никель, олово, серебро - белые, свинец - голубовато-белый, золото
-желтое. Из сплавов в практике нашли большое применение: бронза - сплав
меди с оловом и другими металлами, латунь - сплав меди с цинком, баббит -
сплав олова с сурьмой и медью и др.
Это деление на черные
С внешней стороны металлы, как известно, характеризуются прежде всего
особым «металлическим» блеском, который обусловливается их способностью
сильно отражать лучи света. Однако этот блеск наблюдается обыкновенно
только в том случае, когда металл образует сплошную компактную массу.
Правда, магний и алюминий сохраняют свой блеск, даже будучи превращенными в
порошок, но большинство металлов в мелкораздробленном виде имеет черный
или темно-серый цвет. Затем типичные металлы обладают высокой тепло- и
электропроводностью, причем по способности проводить тепло и ток
располагаются в одном и том же порядке: лучшие проводники - серебро и медь,
худшие - свинец и ртуть. С повышением температуры электропроводность
падает, при понижении температуры, наоборот, увеличивается.
Очень важным свойством металлов является их сравнительно легкая
механическая деформируемость. Металлы пластичны, они хорошо куются,
вытягиваются в проволоку, прокатываются в листы и т.п.
Характерные физические свойства металлов находятся в связи с
особенностями их внутренней структуры. Согласно современным воззрениям,
кристаллы металлов состоят из положительно заряженных ионов и свободных
электронов, отщепившихся от соответствующих атомов. Весь кристалл можно
себе представить в виде пространственной решетки, узлы которой заняты
ионами, а в промежутках между ионами находятся легкоподвижные электроны.
Эти электроны постоянно переходят от одних атомов к другим и вращаются
вокруг ядра то одного, то другого атома. Так как электроны не связаны с
определенными ионами, то уже под влиянием небольшой разности потенциалов
они начинают перемещаться в определенном направлении, т.е. возникает
электрический ток.
Наличием свободных электронов обусловливается и высокая
теплопроводность металлов. Находясь в непрерывном движении, электроны
постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому
колебания ионов, усилившиеся в данной части металла вследствие нагревания,
сейчас же передаются соседним ионам, от них - следующим и т.д., и тепловое
состояние металла быстро выравнивается; вся масса металла принимает
одинаковую температуру.
По плотности металлы условно подразделяются на две большие группы:
легкие металлы, плотность которых не больше 5 г/см3, и тяжелые металлы -
все остальные. Плотность, а также температуры плавления некоторых металлов
приведены в таблице №1.
Таблица №1
Плотность и температура плавления некоторых металлов.
|Название |Атомный вес |Плотность, |Температура |
| | |г/см3 |плавления, C | и8.
|Легкие металлы.| | | |
|Литий |6,939 |0,534 |179 |
|Калий |39,102 |0,86 |63,6 |
|Натрий |22,9898 |0,97 |97,8 |
|Кальций |40,08 |1,55 |850 |
|Магний |24,305 |1,74 |651 |
|Цезий |132,905 |1,90 |28,5 |
|Алюминий |26,9815 |2,702 |660,1 |
|Барий |137,34 |3,5 |710 |
|Тяжелые металлы| | | |
|Цинк |65,37 |7,14 |419 |
|Хром |51,996 |7,16 |1875 |
|Марганец |54,9380 |7,44 |1244 |
|Олово |118,69 |7,28 |231,9 |
|Железо |55,847 |7,86 |1539 |
|Кадмий |112,40 |8,65 |321 |
|Никель |58,71 |8,90 |1453 |
|Медь |63,546 |8,92 |1083 |
|Висмут |208,980 |9,80 |271,3 |
|Серебро |107,868 |10,5 |960,8 |
|Свинец |207,19 |11,344 |327,3 |
|Ртуть |200,59 |13,546 |-38,87 |
|Вольфрам |183,85 |19,3 |3380 |
|Золото |196,967 |19,3 |1063 |
|Платина |195,09 |21,45 |1769 |
|Осмий |190,2 |22,5 |2700 |
Частицы металлов, находящихся в твердом и жидком состоянии, связаны
особым типом химической связи - так называемой металлической связью. Она
определяется одновременным наличием обычных ковалентных связей между
нейтральными атомами и кулоновским притяжением между ионами и свободными
электронами. Таким образом, металлическая связь является свойством не
отдельных частиц, а их агрегатов.
Химические свойства металлов.
Основным химическим свойством металлов является способность их атомов
легко отдавать свои валентные электроны и переходить в положительно
заряженные ионы. Типичные металлы никогда не присоединяют электронов; их
ионы всегда заряжены положительно.
Легко отдавая при химических реакциях свои валентные электроны,
типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов
далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем
он активнее, тем энергичнее вступает во взаимодействие с другими
веществами.
Опустим кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк
начинает растворяться, а из раствора выделяется свинец. Реакция выражается
уравнением:
Zn + Pb(NO3)2 = Pb + Zn(NO3)2
Из уравнения следует, что эта реакция является типичной реакцией
окисления-восстановления. Сущность ее сводится к тому, что атомы цинка
отдают свои валентные электроны ионам двухвалентного свинца, тем самым
превращаясь в ионы цинка, а ионы свинца восстанавливаются и выделяются в
виде металлического свинца. Если поступить наоборот, то есть погрузить
кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет.
Это показывает, что цинк более активен, чем свинец, что его атомы легче
отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Вытеснение одних металлов из их соединений другими металлами впервые
было подробно изучено русским ученым Бекетовым, расположившим металлы по их
убывающей химической активности в так называемый «вытеснительный ряд». В
настоящее время вытеснительный ряд Бекетова носит название ряда напряжений.
В таблице №2 представлены значения стандартных электродных
потенциалов некоторых металлов. Символом Me+/Me обозначен металл Me,
погруженный в раствор его соли. Стандартные потенциалы электродов,
выступающих как восстановители по отношению к водороду, имеют знак «-», а
знаком «+» отмечены стандартные потенциалы электродов, являющихся
окислителями.
Таблица №2
Стандартные электродные потенциалы металлов.
|Электрод |Е0,В |Электрод |Е0,В |
|Li+/Li |-3,02 |Co2+/Co |-0,28 |
|Rb+/Rb |-2,99 |Ni2+/Ni |-0,25 |
|K+/K |-2,92 |Sn2+/Sn |-0,14 |
|Ba2+/Ba |-2,90 |Pb2+/Pb |-0,13 |
|Sr2+ /Sr |-2,89 |H+/1/2h3 |0,00 |
|Ca2+/Ca |-2,87 |Sb3+/Sb |+0,20 |
|Na+/Na |-2,71 |Bi3+/Bi |+0,23 |
|La3+/La |-2,37 |Cu2+/Cu |+0,34 |
|Mg2+/Mg |-2,34 |Cu+/Cu |+0,52 |
|Al3+/Al |-1,67 |Ag+/Ag |+0,80 |
|Mn2+/Mn |-1,05 |Pd2+/Pd |+0,83 |
|Zn2+/Zn |-0,76 |Hg2+/Hg |+0,86 |
|Cr3+/Cr |-0,71 |Pt2+/Pt |+1,20 |
|Fe2+/Fe |-0,44 |Au3+/Au |+1,42 |
|Cd2+/Cd |-0,40 | | |
Металлы, расположенные в порядке возрастания их стандартных
электродных потенциалов, и образуют электрохимический ряд напряжений
металлов: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni,
Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньше электродный потенциал металла, тем больше его
восстановительная способность.
2. Каждый металл способен вытеснять(восстанавливать) из растворов солей
те металлы, которые стоят в ряду напряжений после него.
3. Все металлы, имеющие отрицательный стандартный электродный
потенциал, то есть находящиеся в ряду напряжений левее водорода,
способны вытеснять его из растворов кислот.
Необходимо отметить, что представленный ряд характеризует поведение
металлов и их солей только в водных растворах и при комнатной температуре.
Кроме того, нужно иметь ввиду, что высокая электрохимическая активность
металлов не всегда означает его высокую химическую активность. Например,
ряд напряжений начинается литием, тогда как более активные в химическом
отношении рубидий и калий находятся правее лития. Это связано с
исключительно высокой энергией процесса гидратации ионов лития по сравнению
с ионами других щелочных металлов.
studfiles.net
Строение и свойства металлов — МегаЛекции
Красноярский институт железнодорожного транспорта
МАТЕРИАЛОВЕДЕНИЕ
КОНСПЕКТ ЛЕКЦИЙ
Составитель В.С.Чекушин
Красноярск 2010
Содержание
1 Общие вопросы материаловедения 3
1.1. Материалы производственного назначения, используемые в изделиях. 3
1.2. Качество материалов и его оценка. 5
1.3. Физические, химические и эксплуатационные свойства материалов. 9
2 Строение и свойства металлов 11
2.1. Дефекты в кристаллах. 14
2.2. Кристаллизация. 16
2.3. Строение металлического слитка. 19
2.4. Аллотропия металлов. 20
2.5. Металлические сплавы.. 21
2.6. Диаграммы состояния сплавов. 27
3 Железо и сплавы на его основе 38
3.1. Система железо — цементит. 39
3.2. Практическое применение диаграммы Fe – Fe3C.. 44
4 Стали 46
5 Чугуны 57
6 Основы теории термической обработки 64
6.1. Четыре основные превращения в сталях. 64
6.2. Закалка и отпуск. 73
6.3. Отжиг и нормализация. 76
6.4. Термическая обработка колес подвижного состава, рельсов, пружин, рессор, подшипников. 81
7 Термомеханическая обработка стали 90
8 Химико-термическая обработка и поверхностное упрочнение стали 91
9 Материал, термообработка, поверхностное упрочнениие, шлифовка и допускаемые напряжения тяговых зубчатых передач 97
Способы поверхностного упрочнения зубьев и шлифовка зубьев. 101
10 Алюминий и сплавы на его основе 106
11 Антифрикционные (подшипниковые) сплавы на оловянной, свинцовой и цинковой основах 110
12 Медь и ее сплавы 113
11.1. Общая характеристика и классификация медных сплавов. 114
11.2. Медно-никелевые сплавы.. 120
13 Порошковые металлические материалы 121
14 Защита металлов от коррозии 131
15 Металлические стекла 133
16 Титан и сплавы на его основе 136
17 Материалы из органических веществ 141
1 Общие вопросы материаловедения
Материаловедение – древнейшая область знаний, обусловленная жизнедеятельностью людей в сферах производства и быта с использованием элементов материального мира неорганической и органической природы с дальнейшими их превращениями и формированием материалов с требуемыми свойствами.
Особенностью цивилизации, в которой мы оказались, являются постоянно растущие потребности в новых типах материалов при постоянно увеличивающихся объемах использования последних.
Материаловед обеспечивает создание технологии получения материалов с заданными свойствами. При этом в современной жизнедеятельности людей, номенклатура необходимых материалов огромна и она постоянно расширяется.
Существенное различие в природе материалов не позволяет обеспечить единообразие в изучении свойств материалов и способах создания материалов с заданными свойствами.
1.1. Материалы производственного назначения, используемые в изделиях
Машиностроительные материалы предназначены для изготовления деталей машин, механизмов и приборов, инструмента, инженерных сооружений и изделий, которые при работе испытывают механические нагрузки, а в некоторых случаях, могут работать под воздействием агрессивной окружающей среды, температуры, трения и других негативных факторов.
| Рис. 1.1. Классификация металлических материалов |
| Рис. 1.2. Классификация неметаллических материалов |
| Рис. 1.3. Классификация композиционных материалов |
1.2. Качество материалов и его оценка
Качеством материала называется совокупность его свойств, удовлетворяющих определенные потребности в соответствии с назначением.
Уровень качества определяется показателями, представляющими собой количественную характеристику одного или нескольких свойств материалов, которые определяют их качество применительно к конкретным условиям использования. Показатели качества: единичные и комплексные
Единичный показатель качества характеризуется только одним свойством (например, твердость стали).
Комплексный показатель характеризуется несколькими свойствами материалов (например, стали – химический состав, механические свойства, микро- и макроструктуры). Комплексные показатели качества устанавливаются государственными стандартами.
Качество материала определяется свойствами, химическим составом, структурой. Химический состав может определяться химическим или спектральным анализом. Структура материала определяется макроанализом, микроанализом, рентгеновским анализом, магнитной, ультразвуковой и капиллярной дефектоскопией
Механические свойства материалов
Механические свойства характеризуют способность материалов сопротивляться действию внешних сил.
К основным механическим свойствам относятся прочность, твердость, ударная вязкость, упругость, пластичность, хрупкость и др.
Прочность — способность материала сопротивляться разрушающему воздействию внешних сил.
Твердость — способность материала сопротивляться внедрению в него другого, более твердого тела под действием нагрузки.
Вязкость – свойство материала сопротивляться разрушению под действием динамических нагрузок.
Упругость — свойство материала восстанавливать свои размеры и форму после прекращения действия нагрузки.
| Рис. 1.4. К определению прочности, пластичности и хрупкости материала |
Пластичностью называется способность материала изменять свои размеры и форму под действием внешних сил, не разрушаясь при этом.
Хрупкость — свойство материала разрушаться под действием внешних сил без остаточных деформаций.
Величины, характеризующие прочность, пластичность и упругость материала, определяют при статических испытаниях на растяжение. Образец длиной l0 и диаметром d0 растягивают под действием приложенной силы Р, до разрушения (рис. 1.4). Внешняя нагрузка вызывает в образце напряжение и деформацию.
Напряжение Ϭ это отношение силы Р к площади поперечного сечения F, МПа:
(1.1)
Деформация характеризует изменение размеров образца под действием нагрузки, %:
, (1.2)
где: l – длина растянутого образца.
При испытаниях строится диаграмма растяжения, представляющая собой зависимость напряжения от деформации. На рис.1.5 приведена такая диаграмма для низкоуглеродистой стали.
| Рис. 1.5. Диаграмма растяжения |
Предел упругости Ϭу — максимальное напряжение при котором в образце не возникают пластические деформации.
Предел текучести ϬТ — напряжение, соответствующее площадке текучести на диаграмме растяжения. Если на диаграмме нет площадки текучести (что наблюдается для хрупких материалов), то определяют условный предел текучести Ϭ0,2 — напряжение, вызывающее пластическую деформацию, равную 0,2 %.
Предел прочности (или временное сопротивление) Ϭв — напряжение, отвечающее максимальной нагрузке, которую выдерживает образец при испытании.
Относительное удлинение после разрыва δ – отношение приращения длины образца при растяжении к начальной длине l0, %:
(1.3)
где lk — длина образца после разрыва.
Относительным сужением после разрыва ѱ называется уменьшение площади поперечного сечения образца, отнесенное к начальному сечению образца, %:
, (1.4)
где Fk — площадь поперечного сечения образца в месте разрыва.
Относительное удлинение и относительное сужение характеризуют пластичность материала. Твердость металлов измеряется путем вдавливания в испытуемый образец твердого наконечника различной формы.
Метод Бринелля основан на вдавливании в поверхность металла стального закаленного шарика под действием определенной нагрузки. После снятия нагрузки в образце остается отпечаток. Число твердости по Бринеллю НВ определяется отношением нагрузки, действующей на шарик, к площади поверхности полученного отпечатка.
Метод Роквелла основан на вдавливании в испытуемый образец закаленного стального шарика диаметром 1,588 мм (шкала В) или алмазного конуса с углом при вершине 120° (шкалы А и С). Вдавливание производится под действием двух нагрузок — предварительной, равной 100 Н и окончательной, равной 600, 1000. 1500 Н для шкал А, В и С соответственно. Число твердости по Роквеллу HRA, HRB и HRC определяется по разности глубин вдавливания.
В методе Виккерса применяют вдавливание алмазной четырехгранной пирамиды с углом при вершине 136°. Число твердости по Виккерсу HV определяется отношением приложенной нагрузки к плошади поверхности отпечатка.
Ударная вязкость определяется работой А, затраченной на разрушение образца, отнесенной к площади его поперечного сечения F; Дж/м2:
(1.5)
Испытания проводятся ударом специального маятникового копра. Для испытания применяется стандартный надрезанный образец, устанавливаемый на опорах копра. Маятник определенной массы наносит удар по стороне противоположной надрезу.
1.3. Физические, химические и эксплуатационные свойства материалов
К физическим свойствам материалов относится плотность, температура плавления, электропроводность, теплопроводность, магнитные свойства, коэффициент температурного расширения и др.
Плотностью называется отношение массы однородного материала к единице его объема. Это свойство важно при использовании материалов в авиационной и ракетной технике, где создаваемые конструкции должны быть легкими и прочными.
Температура плавления — это такая температура, при которой металл переходит из твердого состояния в жидкое. Чем ниже, температура плавления металла, тем легче протекают процессы его плавления, сварки и тем они дешевле.
Электропроводностью называется способность материала хорошо и без потерь на выделение тепла проводить электрический ток. Хорошей электропроводностью обладают металлы и их сплавы, особенно медь и алюминий. Большинство неметаллических материалов не способны проводить электрический ток, что также является важным свойством, используемом в электроизоляционных материалах.
Теплопроводность — это способность материала переносить теплоту от более нагретых частей тел к менее нагретым. Хорошей теплопроводностью характеризуются металлические материалы.
Магнитными свойствами, т.е. способностью хорошо намагничиваться обладают только железо, никель, кобальт и их сплавы.
Химические свойства характеризуют склонность материалов к взаимодействию с различными веществами и связаны со способностью материалов противостоять вредному действию этих веществ.
Способность металлов и сплавов сопротивляться действию различных агрессивных сред называется коррозионной стойкостью, а аналогичная способность неметаллических материалов — химической стойкостью.
К эксплуатационным (служебным) свойствам относятся жаростойкость, жаропрочность, износостойкость, радиационная стойкость, коррозионная и химическая стойкость и др.
Жаростойкость характеризует способность металлического материала сопротивляться окислению в газовой среде при высокой температуре.
Жаропрочность характеризует способность материала сохранять механические свойства при высокой температуре.
Износостойкость — это способность материала сопротивляться разрушению его поверхностных слоев при трении.
Радиационная стойкость характеризует способность материала сопротивляться действию ядерного облучения.
Вопросы для самоконтроля
1. Материаловедение – это наука или искусство?
2. Как условно подразделяются материалы?
3. Классификация металлических материалов.
4. Классификация неметаллических материалов.
5. Классификация композиционных материалов.
6. Показатели качества материалов.
7. Основные механические свойства материалов и их определение.
8. Сущность статических испытаний материалов на растяжение.
9. Что такое напряжение?
10. Что такое деформация?
11. Что такое предел упругости, предел текучести и предел прочности?
12. Что характеризует относительное удлинение и относительное сужение образца?
13. Методика определения твердости материалов (методы Бринеля, Роквелла, Виккерса). Единицы измерения твердости.
14. Определение ударной вязкости материалов.
Строение и свойства металлов
Металлические материалы делятся на две большие группы: железо и сплавы железа (сталь и чугун) называют черными металлами, а остальные металлы и их сплавы — цветными.
Свойства металлов разнообразны:
· кристаллическое строение в твердом состоянии;
· пластичность и твердость;
· тепло- и электропроводность;
· термоэлектронная эмиссия, т. е. способность к испусканию электронов при нагреве;
· хорошая отражательная способность (металлы практически непрозрачны и имеют характерный металлический блеск).
В элементарном состоянии атомы металлов обладают совокупностью общих и специфических физико-химических свойств, в том числе способностью к взаимодействию с себе подобными атомами металлической природы, а также атомами металлоидной природы.
Металлы, присутствующие в виде расплавленной конденсированной фазы способны выступать в качестве растворителей других металлов и неметаллов (углерода, кислорода, серы и проч.).
Общим свойством металлов в твердом состоянии является формирование совершенных кристаллических структур – кристаллических решеток, в узлах которых расположены атомы, характеризующиеся дефицитом валентных электронов, формирующих электронный газ. В общем виде суммарный положительный заряд ионного остова кристаллического образца нейтрализуется суммарным зарядом электронного газа, концентрация которого зависит от природы атома металла.
Кристаллические тела при нагреве остаются твердыми до определенной температуры (температуры плавления), при которой они переходят в жидкое состояние. Аморфные тела при нагреве размягчаются в большом температурном интервале; сначала они становятся вязкими и лишь, затем переходят в жидкое состояние. Все металлы и их сплавы – тела кристаллические.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Наиболее часто встречаются решетки (рис. 2.1): объемно-центрированная кубическая (OЦK) ‑ α-Fe, Сr, W, гранецентрированная кубическая (ГЦК) ‑ γ-Fe, Al, Сu, гексагональная плотноупакованная (ГПУ)‑ Mg, Zn
| Рис. 2.1. Кристаллические решетки железа: а – ОЦК, б – ГЦК, в – ГП; а, b, с – периоды |
В ОЦК решетке центральный атом находится на равноудаленном расстоянии от восьми атомов в вершинах куба. То есть координационное число (К) равно восьми. В ГЦК решетке атом, находящийся в центре грани равноудален от 4 атомов в вершинах куба, от 4 атомов, расположенных на гранях куба и от 4 атомов, принадлежащих контактирующей кристаллической решетке. Таким образом, координационное число равно 12
Степень заполненности объема кристаллической решетки атомами является важной характеристикой структуры. Она определяется такими показателями, как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки (рис. 2.2). Измеряется в нанометрах – нм. 1нм = 10-9 = 10 А. Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а. Для характеристики гексогональной решетки принимаю два параметра – сторону шестигранника – а и высоту призмы – с.
| Рис. 2.2. Параметры кристаллической решетки металлов: а, b, с – периоды; α, β, γ – углы |
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексогональной решеткой а находится в пределах 0,228–0,398 нм, а с в пределах 0,357–0,652 нм. Параметры решеток определяются рентгеноструктурным анализом.
2.1. Дефекты в кристаллах
В кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки. Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные
Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией значительно большей средней энергии и перемешаются из одного места в другое. Наиболее легко перемешаются атомы поверхностного слоя. Место, где находился такой атом, называется вакансией. На это место через некоторое время перемешается один из атомов соседнего слоя и т. д. Таким образом вакансия перемешается в глубь кристалла. К точечным дефектам (рис. 2.3.) относят атом, внедренный в междоузлие кристаллической решетки, и замешенный атом, когда место атома одного металла замешается в кристаллической решетке другим. Точечные дефекты вызывают местное искажение кристаллической решетки.
| Рис. 2.3. Схемы точечных дефектов: а – вакансия; б – атом внедрения; в – примесный атом внедрения |
Линейные дефекты (рис. 2.4.) возникают, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой, число рядов атомов в верхней части решетки на один больше, чем в нижней, то есть, появляется как бы лишняя атомная плоскость (экстраплоскость).
Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой или линейной дислокацией. Длина дислокации может достигать многих тысяч межатомных расстояний. Ширина дислокации мала и составляет несколько атомных расстояний. Линейные дефекты, краевые и винтовые дислокации – сильно искажают кристаллическую решетку, создавая напряжения. Перемещаясь под влиянием внешних сил, дислокации скапливаются, достигая критической плотности (1012 на см2). При этом пластичность становится близкой к нулю, происходит трещинообразование и хрупкое разрушение. Дислокации возникают при кристаллизации и могут размножаться под нагрузкой.
| Рис. 2.4. Схемы краевой (а) и винтовой (б) дислокаций: АВ – краевая дислокация; ABCD – плоскость скольжения; ВС – винтовая дислокация |
Поверхностные дефекты (рис. 2.5.) представляют собой границы раздела между отдельными кристаллами. На границе раздела атомы расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше нарушает порядок расположения атомов.
| Рис. 2.5. Схема поверхностного дефекта – граница зерен (пунктир): А – атом принадлежит обеим решеткам; В – атом не принадлежит ни одной из них; С – атом принадлежит одной из двух решеток |
Прочность металла может либо увеличиваться вследствие искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов.
Неодинаковость физических свойств среды в разных направлениях называют анизотропией. Анизотропия кристаллов обусловлена различием плотности упаковки атомов в решетке в различных направлениях. Все кристаллы анизотропны.
2.2. Кристаллизация
Переход из жидкого состояния в твердое (кристаллическое) называют кристаллизацией. Процессы кристаллизации зависят от температуры и протекают во времени Кривые охлаждения строятся в координатах температура ‑ время.
Теоретический процесс кристаллизации металла без переохлаждения протекает при температуре TS (рис. 2.6.). При достижении идеальной температуры затвердевания TS падение температуры прекращается. Это объясняется тем, что перегруппировка атомов при формировании кристаллической решетки идет с выделением тепла (выделяется скрытая теплота кристаллизации).
| Рис. 2.6. Расположение кривых охлаждения в зависимости от скорости охлаждения V < V1 < V2 |
Каждый чистый металл (не сплав) кристаллизуется при строго индивидуальной постоянной температуре. По окончании затвердевания металла температура его снова понижается. Практически кристаллизация протекает при более низкой температуре, т.е. при переохлаждении металла до температур ТП, ТП1, ТП2, (например, кривые 1, 2).
Степень переохлаждения ΔT = TS – ТП зависит от природы и чистоты металла и скорости охлаждения. Чем чище жидкий металл, тем он более склонен к переохлаждению. При увеличении скорости охлаждения степень переохлаждения возрастает, а зерна металла становятся мельче, что улучшает его качество. Для большинства металлов степень переохлаждения при кристаллизации в производственных условиях составляет от 10 до 30 °С. При больших скоростях охлаждения она может достигать сотен градусов.
Процесс кристаллизации состоит из двух стадий: зарождения кристаллов (зародышей или центров кристаллизации) и роста кристаллов из этих центров. При переохлаждении сплава ниже ТП на многих участках жидкого металла образуются способные к росту кристаллические зародыши.
Сначала образовавшиеся кристаллы растут свободно и имеют более или менее правильную геометрическую форму.
Затем при соприкосновении растущих кристаллов их правильная форма нарушается, так как в этих участках рост граней прекращается.
Рост кристалла продолжается только в тех направлениях, где есть свободный доступ жидкого металла. В результате кристаллы, имевшие сначала геометрически правильную форму, после затвердевания получают неправильную форму, их называют кристаллитами или зернами.
Величина зерен зависит от числа центров кристаллизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем мельче зерно металла. На образование центров кристаллизации влияет и скорость охлаждения. Чем выше скорость охлаждения, тем больше возникает центров кристаллизации и, следовательно, мельче зерно металла.
Чтобы получить мелкое зерно, создают искусственные центры кристаллизации. Для этого в расплавленный металл (расплав) вводят специальные вещества, называемые модификаторами.
2.3. Строение металлического слитка
Форма растущих кристаллов определяется не только условиями их касания друг с другом, но и составом сплава, наличием примесей и режимом охлаждения. Обычно механизм образования кристаллов носит дендритный (древовидный) характер, когда рост зародышей происходит с неравномерной скоростью (рис. 2.7.).
| Рис. 2.7. Направления осей роста кристалла | |
После образования зародышей их развитие идет в тех плоскостях и направлениях решетки, которые имеют наибольшую плотность упаковки атомов и минимальное расстояние между ними. В этих направлениях образуются длинные ветви будущего кристалла ‑ так называемые оси (1) первого порядка. В дальнейшем от осей первого порядка начинают расти новые оси (2) - оси второго порядка, от осей второго порядка - оси (3) - третьего порядка и т. д.
Например, стальные слитки получают охлаждением в металлических формах (изложницах) или на установках непрерывной разливки. В изложнице сталь не может затвердеть одновременно во всем объеме из-за невозможности создания равномерной скорости отвода тепла. Поэтому процесс кристаллизации стали начинается у холодных стенок и дна изложницы, а затем распространяется внутрь жидкого металла (рис. 2.8.).
| Рис. 2.8. Схема строения стального слитка: а) расположение дендритов в наружных частях слитка; б) строение слитка 1 – стенки изложницы; 2 – мелкие равноосные кристаллы; 3 – древовидные кристаллы; 4 – равноосные неориентированные кристаллы больших размеров; 5 – усадочная рыхлость; 6 – усадочная раковина |
В верхней части слитка, которая затвердевает в последнюю очередь, образуется усадочная раковина 6 вследствие уменьшения объема металла при охлаждении. Под усадочной раковиной металл в зоне 5 получается рыхлым из-за большого количества усадочных пор. Для получения изделий используют только часть слитка, удаляя усадочную раковину и рыхлый металл слитка для последующего переплава.
2.4. Аллотропия металлов
Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки.
Например, железо в интервале температур 911 – 1392 °С имеет гранецентрированную кубическую решетку (ГКЦ) γ-Fe. В интервалах до 911 ºС и от 1392 до 1539°С железо имеет объемно-центрированную кубическую решетку (ОЦК) ‑ α-Fe.
2.5. Металлические сплавы
Металлические сплавы— макроскопически однородные системы, состоящие из двух или более сортов атомов металлов (или неметаллов), в которых доминирующими являются атомы металла и которые обладают металлическими свойствами. Свойства металлических сплавов могут быть изменены легированием, механической, термической, термомеханической, радиационной и другими видами обработки.
Легирование— введение в состав металлических сплавов так называемых легирующих элементов (например, в сталь — Cr, Ni, Mo, W, V и др.) для придания сплавам определенных физических, химических или механических свойств.
Классификация сплавов
· по химическому составу
· по числу компонентов
· по числу фаз
· по способу получения
Для изучения процессов, происходящих в сплавах при их превращениях, а также для описания строения сплавов в металловедении используют понятия: компонент, фаза, система.
Компонентами называют вещества, образующие систему. Чистый металл представляет собой однокомпонентную систему, сплав двух металлов - двухкомпонентную систему и т.д. Компонентами могут быть металлы и неметаллы, а также устойчивые, т.е. не диссоциирующие на составные части в рассматриваемых интервалах температур вещества – химические соединения.
Фазой называют однородную часть системы, имеющую одинаковый состав, одно и то же агрегатное состояние и отделенную от остальных частей системы поверхностью раздела, при переходе через которую химический состав или структура вещества изменяются скачкообразно.
Совокупность фаз, находящихся в равновесии при определенных внешних условиях (давлении, температуре), называют системой. Сплав называют однородным (гомогенным), если его структура однофазна, и разнородным (гетерогенным), если его структура состоит из нескольких фаз. Под структурой сплав понимают видимое в микроскоп взаимное расположение фаз, их форму и размеры. Компоненты, входящие в состав сплава, могут образовывать следующие фазы:
· жидкие растворы;
· твердые растворы;
· химические соединения
· механические смеси.
Металлические жидкие растворы (расплавы)представляют собой жидкое негомогенное состояние металлов и их сплавов, которое по большинству характеристик (например, по электропроводности и теплопроводности) ближе к твердому состоянию.
Однородные жидкие растворы характерны почти для всех металлов, растворяющихся друг в друге в жидком состоянии в любых соотношениях.
В однородном жидком растворе атомы растворимого металла (компонента) равномерно распределены среди атомов металла–растворителя.
Лишь немногие металлы растворяются в жидком состоянии ограниченно. И только очень немногие металлы из-за большой разницы в размерах своих атомов не растворяются друг в друге в жидком состоянии. В процессе кристаллизации и затвердевания сплавов взаимодействие компонентов может быть различным. Твердые растворы образуются в результате перехода в твердое состояние однородных жидких растворов.
В твердом растворе одно из веществ, входящих в состав сплава, сохраняет присущую ему кристаллическую решетку, а другое в виде отдельных атомов распределяется в кристаллической решетке первого вещества.
Металлические твердые растворы образуются в результате проникновения в кристаллическую решетку основного металла атомов другого металла или неметалла. Различают твердые растворы замещения (а)и твердые растворы внедрения (б) (рис. 2.9).
| Рис. 2.9. Схемы строения решеток твердых растворов замещения (а) и внедрения (б) |
Так как электронное строение и размеры атомов основного металла (растворителя) и растворенного компонента различны, то при образовании металлического твердого раствора кристаллическая решетка всегда искажается, и периоды ее изменяются. При образовании раствора внедрения период решетки растворителя всегда возрастает, а при образовании твердого раствора замещения — может увеличиться или уменьшиться в зависимости от соотношения атомных радиусов растворителя и растворенного компонента.
Большинство металлов в той или иной степени взаимно растворяются друг в друге в твердом состоянии. Например, без изменения типа кристаллической решетки в алюминии может растворяться до 5,5 % Сu, а в меди — 39 % Zn.
Если компоненты могут замещать друг друга в любых количественных соотношениях, то они образуют непрерывный ряд твердых растворов, имеющих одну и ту же кристаллическую решетку. Образование твердых растворов всегда сопровождается увеличением электрического сопротивления и уменьшением его температурного коэффициента. Твердые растворы обычно менее пластичны (исключение составляют твердые растворы на основе меди) и всегда более тверды и прочны, чем чистые металлы.
При этом в значительной мере свойства изменяются в твердых растворах внедрения, так как искажения решетки при их образовании больше.
Полностью упорядоченные твердые растворы (сверхструктуры) образуются, когда отношение компонентов в сплаве равно целому числу: 1:1; 1:2; 1:3 и др. (рис. 3.10.). В этом случае сплаву с упорядоченным строением можно приписать формулу химического соединения, например, CuAu или Сu3Аu. Таким образом, упорядоченные твердые растворы можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями.
| Рис. 2.10. Кристаллические решетки упорядоченных твердых растворов: а) CuZn; б) CuAu; в) Cu3Au |
В металловедении принято обозначать: чистые компоненты большими буквами латинского алфавита — А, В, С и др.; твердые растворы — малыми буквами греческого алфавита — α, β, γ и др., a упорядоченные твердые растворы теми же буквами со штрихом — α’, β’, γ’ и др.
Понятие «химическое соединение» определяет химически индивидуальное вещество, в котором атомы одного (например, N2 и O2) или различных (CuZn, Mо2C) элементов соединены между собой тем или иным видом химической связи. Известно свыше 3 млн. химических соединений. В металлических сплавах это понятие охватывает только химические соединения, образованные из различных компонентов сплава.
Химические соединения, образующиеся в металлических сплавах из различных компонентов, отличаются от типичных химических соединений тем, что не подчиняются законам валентности и не имеют постоянного состава, а от упорядоченных твердых растворов — тем, что сохраняют свою кристаллическую решетку до температуры плавления.
Химические соединения по электронному строению и свойствам разделяют на классы: электронные соединения, интерметаллиды, фазы внедренияи др.
Электронные соединения(электронные фазы) чаще всего образуются между одновалентными (Сu, Ag, Li, Na и др.) металлами или переходными металлами (Fe, Mn, Со и др.) и металлами с валентностью от 2 до 5 (Be, Mg, Zn, Al и др.).
Интерметаллиды (интерметаллические соединения) — химические соединения металлов с металлами и неметаллами (нитриды, карбиды, гидриды и др.), обладающие металлической связью. Интерметаллические соединения образуют переходные металлы (Fe, Mn, Cr, Mo и др.) с углеродом, азотом, бором и водородом, то есть с элементами, имеющими малый атомный радиус. Кристаллическое строение фаз внедрения определяется соотношением атомных радиусов неметалла (Rx) и металла (Rm).
Атомы металла расположены по типу одной из простых решеток (кубической или гексагональной), в определенные пустоты (поры) которой внедрены атомы неметалла. Механическая смесь двух компонентов А и В образуется тогда, когда при кристаллизации компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Механическая смесь может состоять из зерен двух насыщенных твердых растворов или зерен твердого раствора и химического соединения. В этом случае сплав состоит из кристаллов А и В, которые, если они достаточно крупны, отчетливо выявляются на микроструктуре. Рентгенограмма сплава отчетливо показывает наличие двух решеток компонентов А и В.
2.6. Диаграммы состояния сплавов
Сплавы в подавляющем числе случаев находятся в состоянии, когда они обладают ограниченной устойчивостью. Истинное равновесие в практических условиях достигается редко. Состояние сплава зависит от внешних условий (например, температуры, давления) и характеризуется числом и концентрацией образовавшихся фаз. Для описания фазового состава сплавов в условиях, достаточно близких к равновесному состоянию, применяют диаграмму состояния.
Диаграмма состояния (фазового равновесия) сплава— графическое изображение соотношения между параметрами состояния (температурой, давлением, составом) термодинамически равновесной системы, в зависимости от концентрации компонентов (в процентах по массе или, реже, в атомных процентах) и температуры.
Диаграмма состояния показывает строение сплава в зависимости от соотношения компонентов и от температуры. Обычно применяют проекции диаграммы состояния на одну из координатных плоскостей при постоянном значении остальных параметров, например, на плоскость температура — состав при постоянном давлении.
Диаграммы состояния спл
megalektsii.ru
Лекция 1. Введение. Строение и свойства металлов. Аллотропия (полиморфизм). Анизотропия. Кристаллизация. Дендрит, зерно. Строение стального слитка. Ликвация.
Строение и свойства металлов.
Все вещества в зависимости от температуры и давления могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
В чистых металлах при повышении температуры происходит изменение агрегатного состояния: при превышении температуры плавления твердое состояние сменяется жидким, при превышении температуры кипения жидкое состояние переходит в газообразное. Эти температуры перехода зависят от давления.
Температура плавления – особенно важная константа свойств металла – колеблется для различных металлов в весьма широких пределах: от минус 38,9 для ртути, самого легкоплавкого металла, находящегося при комнатной температуре в жидком состоянии, до 3390 - для самого тугоплавкого металла – вольфрама.
В газообразном состоянии частицы вещества не связаны между собой молекулярными силами притяжения и хаотически движутся, заполняя весь возможный объем. При обычных давлениях и температурах среднее расстояние между молекулами в газах примерно в 10 раз больше, чем в твердых телах и жидкостях. Поэтому газы имеют значительно меньшие плотности, чем твердые тела и жидкости. При обычных температурах газы – хорошие диэлектрики, так как их атомы и молекулы электрически нейтральны.
При нагреве газа до высоких температур происходит его ионизация: концентрация заряженных частиц увеличивается, причем объемные плотности положительных и отрицательных электрических зарядов заряженных частиц становятся практически одинаковыми. Термически ионизированный газ отличается от обычного газа рядом особенностей, позволяющих считать его четвертым (после твердого, жидкого и газообразного) состоянием вещества – плазмой. В технике широкое применение получила «холодная» или низкотемпературная плазма (103-104 К).
Жидкости представляют собой вещества в конденсированном агрегатном состоянии, промежуточном между твердым и газообразном. Жидкости подобно твердым телам обладают малой сжимаемостью и большой плотностью, но в то же время подобно газам не обладают упругостью формы и легко текут. В жидкостях среднее расстояние между молекулами сравнимо с размерами самих молекул (10 Нм = 10-10 м) и силы межмолекулярного взаимодействия весьма значительны. Подобно частицам твердого тела молекулы жидкости совершают тепловые колебания около некоторых положений равновесия. Однако, если в твердых телах эти положения равновесия неизменны (т.е. имеет место дальний порядок), то в жидкостях они время от времени изменяются: по истечении некоторого времени молекула жидкости перескакивает в новое положение равновесия, перемещаясь на расстояние, сравнимое с расстоянием между молекулами. Эти перемещения молекул жидкости обусловливают ее текучесть. Таким образом, несмотря на то, что в жидкостях не соблюдается дальний порядок, как у твердых тел, для них имеет место «ближний порядок»: в среднем для каждой молекулы жидкости число ближайших соседей и их взаимное расположение одинаковы.
В твердом состоянии физические тела характеризуются стабильностью формы. При изменении формы в твердых телах возникают упругие силы, препятствующие этому изменению. В твердых телах элементарные частицы (атомы, молекулы или ионы) совершают малые тепловые колебания около некоторых фиксированных положений равновесия, т.е. имеет место «дальний порядок», вследствие которого элементарные частицы твердого тела могут располагаться по узлам кристаллических решеток.
Правильное регулярное расположение атомов в твердом теле, характеризующееся периодической повторяемостью в трех измерениях, образует кристаллическую решетку, а тела, имеющие кристаллическую решетку, называют твердыми телами. Металлы являются телами кристаллическими.
Наиболее простой кристаллической решеткой у металлов является кубическая, имеющая две разновидности: кубическую объемно-центрированную (ОЦК) и кубическую гранецентрированную (ГЦК). У обоих типов этих решеток основу ячеек составляют восемь атомов, образующих куб и находящихся в его вершинах. Остальные атомы находятся или в центре объема куба (1 атом на пересечении диагоналей в решетке ОЦК), или в центре каждой из его граней (6 атомов в решетке ГЦК). Кристаллические решетки ОЦК имеют альфа-железо, хром, ванадий, вольфрам и другие металлы. Решетку ГЦК имеют гамма-железо, алюминий, медь, никель и др. металлы. Другой разновидностью кристаллических решеток у металлов является гексагональная плотноупакованная решетка (ГПУ). Ячейка этой решетки представляет собой шестигранную призму с центрированными основаниями, между которыми на некотором расстоянии от центров трех граней расположены еще три атома. ГПУ решетку имеют магний, цинк, бериллий и другие металлы (рис. 1).
Плоскости, параллельные координатным плоскостям, находящиеся на расстоянии а, в, с, разбивают кристалл на множество параллелепипедов, равных и параллельно ориентированных. Наименьший параллелепипед называют элементарной ячейкой. Вершины параллелепипеда называют узлами пространственной решетки. Размер элементарной ячейки оценивают отрезками а, в, с. Их называют периодами решетки. Дополнительными характеристиками кристаллической решетки являются координационное число и коэффициент компактности.
Рис. 1. Кристаллические решетки: а) кубическая объемно-центрированная (ОЦК), б) кубическая гранецентрированная (ГЦК), в) гексагональная плотноупакованная (ГПУ)
Координационное число К – число ближайших равноудаленных частиц (атомов) от любого атома в кристаллической решетке (для ОЦК – К8, для ГЦК – К12). Коэффициент компактности – отношение объема всех частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки (для ОЦК – 0,68, для ГЦК – 0,74).
Упорядоченность расположения атомов в кристаллической решетке позволяет четко выделить кристаллографические направления и плоскости (рис. 2). Кристаллографические направления – лучи, выходящие из какой-нибудь точки отсчета, вдоль которых на определенном расстоянии друг от друга располагаются атомы.
Рис. 2. Основные кристаллографические направления и плоскости
Точками отсчета могут служить вершины куба, при этом кристаллографическими направлениями являются его ребра и диагонали грани.
Кристаллографические плоскости – плоскости, на которых лежат атомы, например, грани куба или его диагональной плоскости. Кристаллографические направления и плоскости принято обозначать индексами Миллера. Для определения индекса какого-либо направления следует найти координаты ближайшего к точке отсчета атома, лежащего на этом направлении, выраженные через параметр решетки.
Анизотропия.
Анизотропия – это зависимость свойств кристалла от направления, возникающая в результате упорядоченного расположения атомов в пространстве. Анизотропия механических и других свойств наблюдается при испытании образцов, вырезанных вдоль различных кристаллографических направлений. Не всем свойствам кристаллических тел присуще явление анизотропии, такое свойство, как теплоемкость, от направления не зависит. Анизотропия проявляется только в пределах одного кристаллического зерна. Реальные металлы являются телами поликристаллическими, состоящими из огромного числа зерен, произвольно ориентированных друг к другу своими кристаллографическими направлениями и плоскостями.
В связи с этим, недостаток какого-либо свойства по одному из направлений приложения силы в одних зернах компенсируется избытком этого свойства по этому же направлению в других зернах. Поэтому реальные металлы являются изотропными телами, т.е. телами с примерно одинаковыми свойствами по всем направлениям.
studfiles.net
















