Справочник химика 21. Ацетилен химические свойства
Ацетилен - это... Что такое Ацетилен?
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2h3 обнаружен на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 2621 °C)Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
Применение
 Ацетиленовая лампа
Ацетиленовая лампа Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком)[2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Примечания
Ссылки
brokgauz.academic.ru
Химические свойства ацетилена
1) ацетилен данного ряда углеводородов имеет большое практическое значение;
2) в отличие от метана и этилена, ацетилен горит ярким пламенем.
Примеры горения ацетилена: сварочные работы на стройках, в мастерских, на заводах.
Во всех этих случаях не видно образования копоти.
В данном случае: а) частички углерода сильно раскаляются в средней части пламени; б) придают ему яркость; в) в конечном итоге сгорают полностью.
При сварочных работах вместо воздуха используется кислород. При этом достигается полное сгорание ацетилена, возрастает температура пламени до 3000 °C. Смеси ацетилена с воздухом и кислородом взрывоопасны;
3) π-связь уступает по прочности основной δ-связи;
4) по месту π-связей могут проходить реакции присоединения и окисления.
Если в цилиндр, заполненный ацетиленом, налить раствор перманганата калия, раствор быстро обесцветится;
5) ацетилен, как и этилен, легко окисляется;
6) из реакций присоединения для ацетилена характерно взаимодействие с бромом.
Две стадии реакции присоединения при взаимодействии ацетилена с бромом:
1) сначала бром присоединяется по месту одной π-связи и образуется 1,2-дибромэтен: СН = СН + Вr2 → ВrСН=СНВr;
2) затем присоединяется вторая молекула брома по второй π-связи, продуктом реакции является 1,1,2,2-тетрабромэтан: ВrСН=СНВr + Вг2 → Вr2СН– СНВr2;
3) в присутствии катализатора (платины, никеля) к ацетилену может присоединяться водород.
При этом ацетилен сперва превращается в этилен, а затем в этан:

4) при присоединении хлороводорода по одной из π-связей образуется газообразное вещество хлорэтен (хлорвинил). Катализатором данной реакции является хлорид ртути:
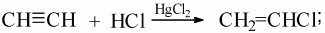
5) присоединение воды (гидратация) происходит в присутствии катализатора Hg2+ в кислой среде (реакция М.Г. Кучерова). При этом ацетилен образует ацетальдегид, а его гомологи – соответствующие кетоны:
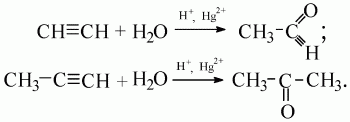
eksdan.ru
Ацетилен химические свойства его - Справочник химика 21
Ацетилен можно получать в приборе для получения этилена. В пробирку наливают 3—5 мл воды и бросают несколько кусочков карбида кальция. Выделяющийся ацетилен используют для изучения его химических свойств. [c.53]
Химические свойства углеводородов, не имеющих кратных (двойной или тройной) связей, в общем приблизительно повторяют свойства метана. Введение в молекулу кратной связи обычно сообщает ей склонность к реакциям присоединения. Это отмечают, говоря о ненасыщенном (непредельном) характере вещества, содержащего в своем составе кратные связи. Например, простейшие непредельные углеводороды—этилен (Н2С=СНг) и ацетилен (Н—С С—Н) — легко присоединяют галоиды. Реакция присоединения связана с переходом кратных связей между атомами углерода в простые. Сравнительная легкость такого перехода и обусловливает ненасыщенный характер соединений. в-з4 [c.538]По химическим свойствам ацетилен во многом аналогичен этилену. Но так как в его молекуле содержится тройная связь, то он является еще более ненасыщенным соединением, а потому обладает большей реакционной способностью, чем этилен. Для него характерны реакции присоединения, окисления и полимеризации. [c.350]
По химическим свойствам карбазол весьма напоминает дифениламин, является очень слабым основанием и слабой КН-кисло-той. При взаимодействии с ацетиленом в присутствии щелочного катализатора карбазол превращается в Ы-винилкарбазол [c.671]
При химических применениях изложенных представлений важно отдавать себе полный отчет в существе дела. Поскольку непосредственно доступен для измерения лишь полный дипольный момент молекулы, разделение полного момента на моменты отдельных связей производится лишь для удобства анализа (например, для введения правила аддитивности) или с целью более летального описания химических свойств молекулы (например, при рассмотрении изменения дипольного момента при повороте одной из связей относительно остальной части молекулы). Следовательно, отдельные атомные диполи не являются объективными реальностями. Высказывалось мнение [137], что их поэтому не следует принимать во внимание при определении моментов связей. Однако если атомные диполи не учитывать при рассмотрении связей С—Н, то полярность всегда будет С"Н+. Выше утверждалось следующее если представлять связь одной наилучшей возможной схемой спаривания, то два спаренных таким образом электрона будут иметь совокупное облако заряда, для которого вероятное направление дипольного момента соответствует +H в метане и С Н+ в ацетилене. Этот момент не обязательно совпадает с тем, который наблюдается при повороте связи С—Н относительно остальной части молекулы (см. раздел 8.13). [c.236]
Рассказать об ацетилене а) состав и строение, б) получение, в) физические свойства, г) химические свойства, д) применение. [c.206]
Наряду с реакциями присоединения, общими как для ацетилена, так и для этиленовых углеводородов, ацетилен проявляет и некоторые особенные химические свойства. [c.56]
После изучения физических свойств ацетилена преподаватель останавливается на его химических свойствах. Необходимо подчеркнуть, что ацетилен, так же как этиленовые соединения, имеет ненасыщенный характер. Один объем ацетилена и один объем молекулярного водорода в присутствии палладия дают этилен [c.57]
Химические свойства. 1. Ацетилен горит сильно коптящим пламенем, так как содержит 92% углерода. При введении в пламя ацетилена достаточного количества воздуха пламя перестает быть коптящим и светится ярким белым светом температура пламени при этом поднимается до 1900°С. [c.42]
Химические свойства. При рассмотрении химических свойств ацетиленовых углеводородов следует учитывать особенности ацетиленовой связи по сравнению с алкенами алкины несколько менее активны в реакциях электрофильного присоединения и более активны в реакциях с нуклеофилами (амины, алкоголяты, меркаптиды). Эти особенности ацетиленовой группировки объясняются ее квантовохимическим строением. Оба углеродных атома в ацетилене находятся в 5р-гибридном состоянии (стр. 33). Между тем чем больше доля 5-ор-битали Б гибридном состоянии, тем ближе электроны находятся к ядру (вспомним, что радиусы 5- и р-орбиталей относятся друг к другу-как 1 У З) и, следовательно, тем труднее эти электроны вовлекаются в химические превращения с участием электрофилов. С другой стороны, ядра углерода в ацетилене гораздо более доступны для нуклеофильных реагентов благодаря его линейному строению [c.93]
И действительно, бензол как физическими, так и химическими свойствами основательно отличается от ацетилена. Бензол — бесцветная, летучая жидкость с своеобразным запахом, легковоспламеняющаяся и горящая ярким, коптящим пламенем, а ацетилен — газ. [c.134]
При работе с ацетиленом необходимо помнить, что особенно опасным химическим свойством его является способность образовывать при контакте с некоторыми цветными металлами (медь, серебро, золото) или сплавами (бронза, латунь и др.) взрывчатые соединения — ацетилениды. [c.118]
В сухую колбу поместить несколько кусочков карбида кальция. Закрыть ее пробкой, в которую вставлена изогнутая газоотводная трубка и капельная воронка (рис. 29). Вместо капельной воронки можно взять прямую, соединенную резиновой трубкой с маленькой воронкой. Для изучения химических свойств ацетилена подготовить в отдельных пробирках бромную воду, аммиачный раствор однохлористой меди. Когда все подготовлено, закрыть воронку при помощи зажима и налить в нее немного воды. Осторожно открывая зажим, по каплям приливать воду в пробирку с карбидом кальция. Выделяющийся ацетилен последовательно пропускать через бромную воду и аммиачный раствор однохлористой меди. Осадок ацетиленида меди отфильтровать, а затем вместе с фильтром подсушить между листами фильтровальной бумаги. Взяв щипцами фильтр с осадком, внести его в пламя горелки. После испарения влаги на фильтре происходит безопасный взрыв. [c.203]
Физические и химические свойства. При взаимодействии с водой в присутствии РЬОг образует ацетилен. Легко полимеризуется. См. также приложение. [c.599]
По химическим свойствам индол очень похож на пиррол. Наиболее просто индол можно получать по способу А. Е. Чичи-бабина путем взаимодействия анилина с ацетиленом [c.297]
Химические свойства. Ацетилен и его гомологи проявляют свойства непредельных соединений вступая в реакции присоединения за счет тройной связи. Многие из реакций алкинов— это реакции электрофильного присоединения, протекающие аналогично соответствующим реакциям олефинов, но в две последовательные стадии. Сначала идет присоединение по тройной связи [c.83]
Наибольшее значение имеет ацетилен, поэтому химические свойства гомологического ряда рассматриваются на его примере. [c.324]
В середине XIX в. на основе исследований этилена и родственных ему соединений сложилось представление о существовании группы ненасыщенных органических веществ, способных к прямому присоединению. В 1860-е годы к ним были причислены также ацетилен и его гомологи. Первые представления о ненасыщенном характере ацетилена принадлежат Бертло, который уже в 1860 г., исходя из первых своих опытов с ацетиленом, заключил По химическим свойствам ацетилен подобен этилену, отличаясь от последнего двумя эквивалентами водорода [112, стр. 118]. [c.37]
Вопреки существующему мнению, Э. Дэви не только впервые в 1836 г. получил ацетилен, но и провел обстоятельное для своего времени изучение его физических и химических свойств, указал область практического использования нового углеводорода и широко информировал химический мир о своем открытии. Работы Э. Дэви не остались без последствий в 1862 г. Ф. Велер, используя принципы, открытые Дэви, впервые совершенно осознанно приготовил карбид кальция, а из него — ацетилен, что знаменовало начало разработки промышленного метода получения ацетилена. Причина, по которой систематические исследования ацетилена задержались на два десятилетия поел его открытия, заключалась, во-первых, в отсутствии общего теоретического интереса к ацетилену и, во-вторых, в неспособности ацетилена в 1840-е годы конкурировать со светильным газом. [c.99]
В наши дни известны более рациональные методы получения уксусной кислоты, которая в больших количествах используется в промышленности. К ацетилену в присутствии катализатора присоединяется вода, получается ацетальдегид, легко окисляющийся в уксусную кислоту. Поскольку ацетилен получают из карбида кальция, в этом случае говорят о карбидном уксусе. По своим химическим свойствам он не отличается от уксуса, полученного из естественного сырья. [c.53]
Физические и химические свойства. Ацетилен — бесцветный газ, имеющий в чистом состоянии слабый эфирный запах. Технический ацетилен имеет неприятный запах, обусловленный примесями фосфористого водорода НзР, сероводорода НаЗ, аммиака ЫНз. [c.166]
Сравните длину углерод—углеродной связи в этилене и ацетилене. Объясните имеющееся различие. Как это сказывается на химических свойствах ацетилена [c.25]
Обычно ацетилен из баллонов пспользуется в качестве горючего газа, и количество содержащихся в нем паров ацетона не влияет на характеристику пламени. Однако иногда требуется ацетилен для лабораторных определений физических II химических свойств, и тогда присутствие в нем ацетона нежелательно. При помощи специального оборудования на станциях сжатого газа можно наполнить ацетиленовые баллоны, не содержащие растворителя, но в связи с ограничением давления в этом случае (согласно техническим условиям) д [c.315]
Ацетилен как представитель класса а-пкипов, его строение, получение, химические свойства, пр1шенеиие. [c.99]
Судя по суммарной формуле бензола СвНв, можно предположить, что бензол является сильно ненасыщенным соединением, аналогичным, например, ацетилену С2Н2. Однако химические свойства бензола не подтверждают такого пре тюложения. Так, при обычных условиях бензол не дает реакций, характерных для непредельных углеводородов не вступает в реакции присоединения (например, с галоидами), не обесцвечивает раствор марганцевокислого калия. Некоторые из этих реакций с бензолом могут протекать только при очень жестких условиях. В то же время бензол аналогично предельным углеводородам вступает в реакции замещения [c.245]
Такое положение легко проиллюстрировать самыми элементарными примерами. В частности, достаточно, как это уже отчасти делалось выше, сопоставить между собой такие сравнительно простые вещества, как бензол и ацетилен, элементарные составы которых полностью совпадают, несмотря на крайние различия в их ф йзико-химических свойствах [c.30]
Внутренний стандарт и определяемый элемент должны иметь близкие физико-химические свойства. Это требование распространяется также на соединения, в форме которых находятся внутренний стандарт и определяемый элемент в пробе перед анализом и которые образуются в процессе анализа. В конечном итоге нужно, чтобы определяемый элемент и внутренний стандарт испарялись и атомизировались с одинаковой скоростью. Необходимо подчеркнуть, что в данном случае недостаточно знать температуру кипения соединений определяемого элемента и внутреннего стандарта, так как в кратере электрода и атомизаторе они претерпевают сложные изменения, а на скорость испарения и диссоциации соединений влияет множество факторов. Поэтому, например, о поступлении элементов в аналитический промежуток можно судить лишь по экспериментальным данным — по кривым испарения, полученным путем фотографирования спектров на движущейся пластинке. Внутренний стандарт и определяемые элементы должны иметь близкие атомные массы, а следовательно, и коэффициенты диффузии. Общее правило элемент, для которого нужно высокотемпературное пламя ацетилен — оксид диазота, не может быть внутренним стандартом для элемента, который хорошо атомизируется в ацетилено-воздушном пламени. Внутренний стандарт и определяемый элемент должны быть идентичными по активности и прочности связей. [c.150]
Реакцией тиолактамов с ацетиленом получены N-винил- и 8-вивилтиолактамы. При винили-ровании тиопирролидона образуется только S-винильное производное. Синтез N-винилтиопир-ролидона осуществлен реакцией N-винилпирролидона с пятисернистым фосфором. Получены также алкил- и пропаргилтиолактамы. Изучены химические. свойства указанных соединений, в том числе полимеризация винильных и аллильных производных. [c.412]
К уменьшению частоты v N, а введение акцепторов электронов повышает частоту. Значения относительной интенсивности также меняются в обратном порядке, так что п-нитронроизводное соединение теперь характеризуется наименьшей интенсивностью полосы, тогда как интенсивность полосы п-метоксипроизводного оказывается выше. Эта инверсия в поведении частот и интенсивностей полос служит надежным доказательством того, что при условии обсуждения только замещения углеродными заместителями, для которых эффекты, обусловленные изменениями силовых постоянных, остаются практически неизменными, возможно рассматривать изменения частот и интенсивностей полос нитрилов и изонитрилов с точки зрения химических свойств соединений. Поскольку связь N изонитрилов характеризуется значительной степенью полярности, то эти соединения проявляют донорно-акцепторные свойства, которые были исследованы Коттоном [66]. Очень интересной особенностью проявления полярности этой связи служит способность бензилизоцианида образовывать водородную связь с фенил-ацетиленом [67]. Это единственный известный пример водородной связи СН. .. С. [c.85]
Карбазол — кристаллическое вещество с т. пл. 238° С. По химическим свойствам он скорее напоминает дифениламин, чем пиррол. С ацетиленом образует винилкарбазол, способный к полимеризации (карбазоловые смолы). [c.475]
Простейшими органическими соединениями являются углесо-дороды. Кроме простых связей С—Н и С—С, в их молекулах могут содержаться также двойная связь С = С и тройная связь С=С. Химические свойства углеводородов, не имеющих кратных (двойной или тройной) связей, в общем приблизительно повторяют свойства метана. Введение в молекулу кратной связи обычно сообщает ей склонность к реакциям присоединения. Это отмечают, говоря о ненасыщенном (непредельном) характере вещества, содержащего в своем составе кратные связи. Например, простейшие непредельные углеводороды — этилен (Н2С = СН9) и ацетилен (НС=СН)—легко присоединяют галоиды. Реакция присоединения связана с переходом кратных связей между атомами углерода в простые. Сравнительная легкость такого перехода и обусловливает ненасыщенный характер соединений. [c.289]
Объясните, почему окраска подкисленного раствора КМПО4 меняется, если пропускать через него ацетилен, но остается неизменной, если пропускать метан. Опишите физические и химические свойства метана и ацетилена. Приведите примеры использования этих веществ в технике, а также объясните, как их можно получить в лаборатории. [c.16]
Карборан представляет собой термически очень устойчивое соединение претерпевающее изомеризацию в пеокарборан только при 450—500°. Карборан весьма устойчив к действию сильных кислот, ряда окислителей и оснований. Химические свойства соединений карборана с заместителями при атомах углерода указывают на электроноакцепторный характер карборанового ядра. Отрицательный индуктивный эффект карборанового ядра объясняется значительным х-характером внешних орбит углерода, направленных к атомам водорода в карборане или каким-либо другим атомам в его С-производных. Из данных по геометрии ди-(бромметил)карборана [8] (если принять наименьшее значение для СССсн = 117°) вытекает, что 5-характер этих орбит почти равен 0,5, т. е. такой же, как у атомов углерода в ацетилене. Вследствие этого атомы водорода в связях С—Н у карборана имеют кислый характер и легко замещаются на металл при действии литийалкилов. [c.446]
В 1866 г., как известно, при продолжительном нагревании ацетилена в фарфоровом сосуде при температуре 550° С Бертло удалось получить бензол в качестве основного продукта полимеризации [86]. Из этих фактов следует,— писал Бертло,— что бензол — это триацетилен (С2Н2)з, он получен прямой конденсацией ацетилена... Ацетилен, таким образом, дает начало бензолу, т. е. основному ядру ароматического ряда он также дает начало этилену, т. е. одному из основных веществ жирного ряда таким образом становится понятным все многообразие его химических свойств [89, стр. 744]. [c.35]
По химическим свойствам диацетилен во многом сходен с ацетиленом. Он также склонен вступать в реакции замещения одного или двух атомов водорода в молекуле и в реакции присоединения. При гидрировании диацетилена образуется бутадиен, затем н-бутан. Многие реакции присоединения приводят к образованию замещенных диацетиленовых углеводородов. Так, например, с ацетоном получается дииндиол [c.39]
Предлагаемая вниманию читателей книга Миллера является первым томом его двухтомной монографии, посвященной ацетилену. В первом томе рассмотрены физико-химические свойства, производство и очистка С2Н2, а также пснользование ацетилена для сварки, пламенной обработки, резки металлов и т. д. Второй, значительно более краткий том содержит в основном описание промышленных синтезов на основе ацетилена. [c.13]
В течение тех же двадцати шести лет были изучены основные химические свойства ацетилена. Бертло [28] окислял ацетилен в различных условиях с образованием муравьиной, уксусной и щавелевой кислот. Воздействуя на ацетилен электрическим разрядом в присутствии азота [29], он получил цианистоводородную кислоту. В дальнейшем он изучил горение, гидрирование, галогенирование и гидрогалогенирование ацетилена. Бертло исследовал ацетнлениды меди, серебра, ртути, щелочных и других металлов [33, 34], действие тихого электрического разряда [35] на ацетилен и определил его растворимость [36] в одиннадцати растворителях. Кучеров [37] впервые наблюдал превращение ацетилена в ацетальдегид (а гомологов ацетилена в кетоны) под действием нейтральных растворов солей ртути [c.17]
chem21.info