Кислород — самый нужный газ на Земле. Газ это кислород
КИСЛОРОД - это... Что такое КИСЛОРОД?
КИСЛОРОД — ( Охуgenum ). Бесцветный газ без запаха и вкуса. Мало растворим в воде (приблизительно 1:43). Ингаляциями кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией: при заболеваниях органов дыхания (пневмония, отек легких … Словарь медицинских препаратов
КИСЛОРОД — (Oxygenium), О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994; газ, tкип 182,962шC. Кислород наиболее распространенный элемент, в атмосфере 23,10% по массе свободного кислорода, в гидросфере и… … Современная энциклопедия
КИСЛОРОД — (лат. Oxygenium) О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994. В свободном виде встречается в виде двух модификаций О2 ( обычный кислород) и О3 (озон). О2 газ без цвета и запаха, плотность 1,42897… … Большой Энциклопедический словарь
КИСЛОРОД — КИСЛОРОД, самый легкий элемент VI группы периодической системы Менделеева, симв. О, порядковый номер 8. К. газ без цвета, запаха и вкуса. Изотопов не имеет. Ат. в. 16,000, мол. в. 32,000. Уд. в. К. по отношению к воздуху 1,10535; при 0° и 760 … Большая медицинская энциклопедия
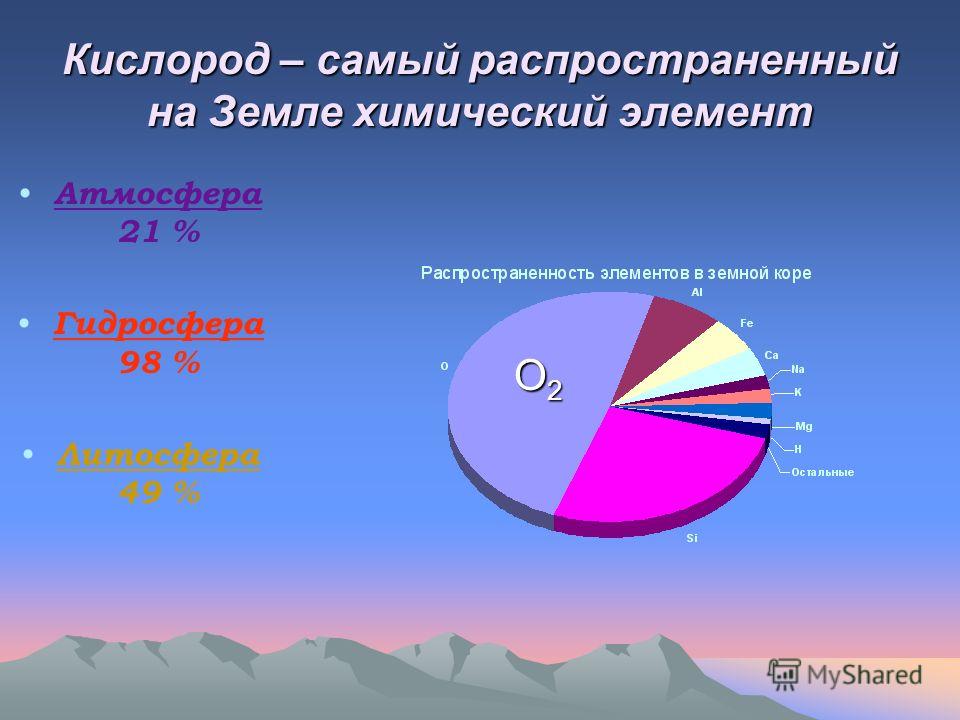
Кислород — самый распространенный элемент земной коры. Содер. его составляет 49,13 по весу и 91,8% по объему. В литосфере содер. 47% К. по весу, в гидросфере 85,89% и в атмосфере 23,01%. Подавляющая часть атомов К. (около 99,99%) имеет высокую хим.… … Геологическая энциклопедия
КИСЛОРОД — (Oxygenium), O, хим. элемент VI группы периодич. системы элементов, ат. номер 8, ат. масса 15,9994 а. е. м. Природный К. состоит из трёх стабильных изотопов: 16 О(99,762%),17 О (0,038%) и 18O (0,200%). Ядра атомов 16 О содержат 8 протонов и 8… … Физическая энциклопедия
кислород — халькоген, органоген, озон, оксиген Словарь русских синонимов. кислород сущ., кол во синонимов: 8 • газ (55) • неметалл … Словарь синонимов
КИСЛОРОД — КИСЛОРОД, кислорода, мн. нет, муж. Газ, химический элемент, входящий в состав воздуха и необходимый для дыхания. В тесной комнате чувствуется недостаток кислорода. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
КИСЛОРОД — КИСЛОРОД, а ( у), муж. Химический элемент, бесцветный газ, входящий в состав воздуха, необходимый для дыхания и горения. | прил. кислородный, ая, ое. Кислородное голодание, кислородная недостаточность (пониженное содержание кислорода в организме; … Толковый словарь Ожегова
КИСЛОРОД — самый распространенный в природе элемент, представляющий собой газ без цвета, запаха и вкуса. Встречается в соединении с водородом (вода), с разными металлами и металлоидами, в минералах и горных породах и в свободном состоянии в воздухе. Для… … Технический железнодорожный словарь
dic.academic.ru
газообразный кислород - это... Что такое газообразный кислород?
газообразный кислород — [А.С.Гольдберг. Англо-русский энергетический словарь. 2006 г.]
Тематики
- энергетика в целом
Справочник технического переводчика. – Интент. 2009-2013.
- газообразный загрязнитель воздуха
- газообразный нефтепродукт
Смотреть что такое "газообразный кислород" в других словарях:
КИСЛОРОД — O (oxygenium), химический элемент VIA подгруппы периодической системы элементов: O, S, Se, Te, Po член семейства халькогенов. Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об.), в земной коре в… … Энциклопедия Кольера
кислород — а; м. Химический элемент (O), газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду. ◊ Перекрыть кислород кому л. Создать невыносимые условия жизни, работы. ◁ Кислородный,… … Энциклопедический словарь
Кислород — самый распространенный элемент земной коры. Содер. его составляет 49,13 по весу и 91,8% по объему. В литосфере содер. 47% К. по весу, в гидросфере 85,89% и в атмосфере 23,01%. Подавляющая часть атомов К. (около 99,99%) имеет высокую хим.… … Геологическая энциклопедия
КИСЛОРОД — (символ О), обычно газообразный химический элемент, необходимый для ДЫХАНИЯ растений и животных и для горения. Был открыт в 1774 г. Джозефом ПРИСТЛИ и независимо от него Карлом ШЕЕЛЕ (около 1772 г.). Газ без вкуса и запаха, являющийся самым… … Научно-технический энциклопедический словарь
КИСЛОРОД — (лат Oxygenium, от греч. oxys кислый и gennao рождаю) О, хим. элемент VI гр. периодич. системы, ат. н. 8, ат. м. 15,9994. Прир. К. состоит из трех стабильных изотопов: 16 О (99,759%), 17 О (0,037%) и 18 О (0,204%]. Конфигурация внеш. электронной… … Химическая энциклопедия
Кислород — 8. Кислород По ГОСТ 5583 и ГОСТ 6331 Источник: ГОСТ 21957 76: Техника криогенная. Термины и определения … Словарь-справочник терминов нормативно-технической документации
Кислород — (латинское Oxygenium) О, химический элемент VI группы периодической системы Менделеева; атомный номер 8, атомная масса 15,9994. При нормальных условиях К. газ без цвета, запаха и вкуса. Трудно назвать другой элемент, который играл бы на… … Большая советская энциклопедия
Кислородный коктейль — Кислородный коктейль насыщенный кислородом напиток. Для формирования структуры коктейля используются пищевые пенообразователи экстракт корня солодки или спум смеси. Санатории, дома отдыха и прочие заведения оздоровительного… … Википедия
Электрохимия* — Содержание: Введение. Историческая справка. Обозначения, принятые в Э. Основные законы и принципы. Перенос ионов. Электропроводность растворов. Электровозбудительная сила. Переход химической энергии в электрическую. Классификация гальванических… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Электрохимия — Содержание: Введение. Историческая справка. Обозначения, принятые в Э. Основные законы и принципы. Перенос ионов. Электропроводность растворов. Электровозбудительная сила. Переход химической энергии в электрическую. Классификация гальванических… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
technical_translator_dictionary.academic.ru
Кислородный газ - Большая Энциклопедия Нефти и Газа, статья, страница 1
Кислородный газ
Cтраница 1
Кислородный газ получают при подаче в газогенератор в качестве дутья одного технич. [1]
Кислородный газ, как все газы, прозрачен и, как большая часть газов, бесцветен. Запаха и вкуса он не имеет, что понятно уже из того, что он находится в воздухе. [2]
По мнению Лавуазье, например, кислородный газ является комбинацией кислорода с теплородом. [3]
Для того, чтобы произвести опыт горения водорода в кислородном газе, должно из сосуда, выделяющего водород, провести газоотводную трубку, которую загнуть, как на рисунке, и зажечь выделяющийся водород в воздухе, а после опустить в стклянку с кислородом. Горение в кислороде будет то же самое, как и в воздухе, пламя останется бледным, несмотря на то, что температура его весьма значительно повысится. Поучительно при этом то, что можно зажечь кислород в водороде, как водород в кислороде. Для того, чтобы показать горение кислорода в водороде, наполняют газометр кислородом и проводят от его крана вертикально восходящую трубку, кончающуюся тонким отверстием. Перед этим отверстием должно укрепить две проволоки на таком расстоянии, чтобы спираль Румкорфа производила ряд искр. Когда около отверстия укреплены проволоки и чрез них проходит ряд искр, то газоотводную трубку вводят в колокол, наполненный водородом ( см. рис.) и обращенный ( по легкости водорода) отверстием вниз. Если отверстие газоотводной трубки будет уже находиться в колоколе, то тогда ( не ранее, иначе может произойти взрыв) отворяют кран газометра, кислород притекает в водород и зажигается искрой. Здесь очевидно, что пламя не есть водород горящий, а есть то место, где кислород соединяется с водородом, потому что может быть получено пламя кислорода, точно так же, как и пламя водорода. [4]
Так как образование водяного газа сопровождается поглощением теплоты, то процесс его получения чередуется с получением воздушного или кислородного газа, что позволяет поддерживать уголь в раскаленном состоянии. [5]
Если представим себе ( говорит Вельцин), что п объемов озона состоит из п объемов кислорода, соединенных с т объемами того же элемента, и что при окислительном действии озон отдает т объемов кислорода и оставляет п кислородного газа, то все предыдущие факты можно изъяснить - иначе должно предположить, что озон бесконечно плотен. Чтобы узнать плотность озона ( приводим опять слова Соре), нельзя употребить непосредственного определения веса данного объема газа, потому что нельзя получить озон в чистом состоянии. Он всегда смешан с весьма большим количеством кислорода. Нужно, значит, прибегнуть к таким веществам, которые поглощали бы озон, не поглощая кислорода и не разрушая озона. [6]
Очевидно Дальтон ссылается на свои слова в первой части Новой системы: В то время, когда я создавал теорию смешанных газов, у меня было путаное представление, которое, как я полагаю, имеется в настоящее время у многих, а именно, что частицы упругих флюидов все одинаковы по величине, что данный объем кислородного газа содержит поэтому в точности столько же частиц, как и такой же объем водородного газа... [7]
Такую безионную воду используют, например, для приготовления растворов пероксида водорода. Кислородная, или окисленная вода - это очищенная вода, в которой под давлением растворен кислородный газ. Кислород сохраняется в воде под давлением: когда бутылку открывают, кислород выделяется из воды в виде пузырьков газа в течение нескольких суток. [8]
В Лейпциге видена мною лаборатория проф. Эрдмана и в ней - снаряд, употребляемый этим ученым для органических анализов н струе воздуха и кислородного газа, при нагревании пламенем спирта, но измененному им способу Гесса. [9]
Большим достоинством способа изображения является, естественно, то, что он избирает простейшие объяснения; однако, это не имело бы места, если предположить, что атом и объем являются дробными частями друг друга. Например, было сделано предположение, что вода состоит из одного атома водорода и одного атома кислорода; она образуется из двух объемов водородного газа и одного объема кислородного газа; исходя из этого было рассчитано, что вес одного объема горючих тел составляет половину веса атома, тогда как атом и объем кислорода должны иметь одинаковый вес. [10]
Более чистый продукт получается при разложении азотносвинцовой соли Pb ( NO3) 2 2NO2 - ( - О - - - f - РЬО, когда образуется нелетучая окись свинца, кислородный газ и двуокись азота. Когда температура приемника будет выше - 9, то кристаллы плавятся и при 0 дают уже красновато-желтую жидкость, подобную той, которая получается при разложении азотносвинцовой соли. Пары азотноватого ангидрида имеют характеристический запах и при обыкновенной температуре темнобурый цвет, а при низких температурах цвет паров гораздо слабее. При нагревании, особенно же выше 50, цвет становится густым темнобурым, так что пары почти теряют прозрачность. [11]
Говоря кратко, мы можем сказать, что состав сложного тела есть выражение тех превращений, к которым оно способно. В этом отношении полезно сделать ясное различие между понятием о простом теле как об от [11] - делъном однородном веществе и о нем же как о вещественной части или элементе сложных веществ. В красной ртутной окиси содержится не два простых тела: металл и газ, а два элемента: ртуть и кислород, дающих в отдельности металл и кислородный газ. Не ртуть как металл и не кислород в своем газообразном виде содержатся в красной ртутной окиси: в ней содержится только вещество этих простых тел, как в водяном паре содержится только вещество льда, но не самый лед или как в хлебе содержится вещество зерна, но не самое зерно. [12]
Флогистики спрашивали, каким образом воздух может оказаться связанным при высокой температуре, которая стремится расширить воздух, а также - почему воздух, который имеет газообразную форму, теряет ее под действием теплоты. Согласно Лавуазье, кислородный газ - это основание кислорода теплород. [13]
В бессемеровском газе находится до 25 % СО, в газе от печей для выплавки алюминия 32 2 % СО. В пороховых газах находят да 60 % СО. Воздушный газ почти полностью состоит из СО, парокислородный газ содержит 95 - 97 % смеси СО и Н2, кислородный газ содержит 95 97 % СО, смешанный генераторный ( паровоздушный) газ - 27 % СО, водяной газ 83 - 86 % СО и Н2 ( примерно в равных соотношениях), каменноугольный светильный газ 4 - 11 % СО; газ Монда - 11 % СО. В некоторых вулканических газах обнаружено до 5 6 % СО. [14]
Простое тело при этом служит исходом, как первичное понятие, к которому сводятся все остальные. Говоря кратко, мы можем сказать, что состав сложного тела есть выражение тех превращений, к которым оно способно. В этом отношении полезно сделать ясное различие между понятием о простом теле как об отдельном однородном веществе, и о нем же, как о вещественной части или элементе сложных веществ. В красной ртутной окиси содержится не два простых тела - металл и газ, а два элемента: ртуть и кислород, дающих в отдельности металл и кислородный газ. Не ртуть, как металл, и не кислород в своем газообразном виде содержатся в красной ртутной окиси: в ней содержится только вещество этих простых тел, как в водяном паре содержится только вещество льда, но не самый лед, или как в хлебе содержится вещество зерна, но не самое зерно. О существовании элемента можно сделать представление, не зная самого простого тела, а изучив только его соединения и зная, что они дают, во всевозможных обстоятельствах, вещества не тождественные с другими, нам известными соединениями. Так, например, в отдельности долго не знали фтора, а между тем должны были признать его за особый элемент, потому что были известны его соединения с другими простыми телами и определено различие этих соединений от всех других сходственных сложных тел. Чтобы еще яснее уразуметь различие понятий о простом теле и элементе ( или радикале, как говорил Лавуазье), необходимо заметить, что сложные тела также образуют новые, еще сложнейшие соединения. Из этих новых соединений нередко первоначальное сложное тело может быть извлечено совершенно теми же способами, какими и простые тела извлекаются из своих соответственных соединений. [15]
Страницы: 1 2
www.ngpedia.ru
газообразный кислород - это... Что такое газообразный кислород?
- газообразный диэлектрик
- газообразный нефтепродукт
Смотреть что такое "газообразный кислород" в других словарях:
газообразный кислород — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN gaseous oxygen … Справочник технического переводчика
КИСЛОРОД — O (oxygenium), химический элемент VIA подгруппы периодической системы элементов: O, S, Se, Te, Po член семейства халькогенов. Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об.), в земной коре в… … Энциклопедия Кольера
кислород — а; м. Химический элемент (O), газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду. ◊ Перекрыть кислород кому л. Создать невыносимые условия жизни, работы. ◁ Кислородный,… … Энциклопедический словарь
Кислород — самый распространенный элемент земной коры. Содер. его составляет 49,13 по весу и 91,8% по объему. В литосфере содер. 47% К. по весу, в гидросфере 85,89% и в атмосфере 23,01%. Подавляющая часть атомов К. (около 99,99%) имеет высокую хим.… … Геологическая энциклопедия
КИСЛОРОД — (символ О), обычно газообразный химический элемент, необходимый для ДЫХАНИЯ растений и животных и для горения. Был открыт в 1774 г. Джозефом ПРИСТЛИ и независимо от него Карлом ШЕЕЛЕ (около 1772 г.). Газ без вкуса и запаха, являющийся самым… … Научно-технический энциклопедический словарь
КИСЛОРОД — (лат Oxygenium, от греч. oxys кислый и gennao рождаю) О, хим. элемент VI гр. периодич. системы, ат. н. 8, ат. м. 15,9994. Прир. К. состоит из трех стабильных изотопов: 16 О (99,759%), 17 О (0,037%) и 18 О (0,204%]. Конфигурация внеш. электронной… … Химическая энциклопедия
Кислород — 8. Кислород По ГОСТ 5583 и ГОСТ 6331 Источник: ГОСТ 21957 76: Техника криогенная. Термины и определения … Словарь-справочник терминов нормативно-технической документации
Кислород — (латинское Oxygenium) О, химический элемент VI группы периодической системы Менделеева; атомный номер 8, атомная масса 15,9994. При нормальных условиях К. газ без цвета, запаха и вкуса. Трудно назвать другой элемент, который играл бы на… … Большая советская энциклопедия
Кислородный коктейль — Кислородный коктейль насыщенный кислородом напиток. Для формирования структуры коктейля используются пищевые пенообразователи экстракт корня солодки или спум смеси. Санатории, дома отдыха и прочие заведения оздоровительного… … Википедия
Электрохимия* — Содержание: Введение. Историческая справка. Обозначения, принятые в Э. Основные законы и принципы. Перенос ионов. Электропроводность растворов. Электровозбудительная сила. Переход химической энергии в электрическую. Классификация гальванических… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Электрохимия — Содержание: Введение. Историческая справка. Обозначения, принятые в Э. Основные законы и принципы. Перенос ионов. Электропроводность растворов. Электровозбудительная сила. Переход химической энергии в электрическую. Классификация гальванических… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
dic.academic.ru
Кислород — самый нужный газ на Земле — Благо Дарю
Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (лат. Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекулакоторого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.

Физические свойства
В мировом океане содержание растворённого O2 больше в холодной воде, а меньше — в тёплой.При нормальных условиях кислород — это газ без цвета, вкуса и запаха.1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C).Межатомное расстояние — 0,12074 нм. Является парамагнетиком.При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.Жидкий кисл
xn----7sbbblh9b0av4l.xn--j1amh
Кислород газообразный
 Кислород
Кислород
Кислород — бесцветный (в толстом слое — голубой) газ без вкуса и запаха. Он немного тяжелее воздуха и малорастворим в воде. При охлаждении до -183°С кислород превращается в подвижную жидкость голубого цвета, а при -219°С — замерзает. Как и положено элементу, занимающему место в правом верхнем углу таблицы Менделеева, кислород — один из самых активных элементов-неметаллов и обладает ярко выраженными окислительными свойствами. Вездесущий, всемогущий и невидимый — это все о нем. Еще он не имеет ни вкуса, ни запаха. Создается впечатление, что разговор идет о том, чего вообще не существует. Однако это вещество есть, мало того: без него человечество попросту задохнулось бы. Поэтому, наверное, Лавуазье с ходу назвал этот газ «жизненным газом».
Кислород всемогущий
По мнению людей религиозных, вездесущим, всемогущим и в то же время невидимым может быть только бог. В действительности же все эти три эпитета вполне можно отнести к химическому элементу с атомным номером 8 – кислороду. Если бы растения в процессе фотосинтеза не превращали воду и углекислый газ в органические соединения, и этот процесс не сопровождался высвобождением связанного кислорода, то, исчерпав довольно быстро запасы атмосферного кислорода, весь животный мир, включая человечество, вскоре задохнулся бы. Кислород — вездесущ: из него в значительной степени состоят не только воздух, вода и земля, но и мы с вами, наши еда, питье, одежда; в подавляющем большинстве окружающих нас веществ есть кислород. Могущество кислорода проявляется уже в том, что мы им дышим, а ведь дыхание это синоним жизни. И еще кислород можно считать всемогущим потому, что могучая стихия огня, как правило, сильно зависит от нашего кандидата в вездесущие и всемогущие. Что касается третьего эпитета — «невидимый», то здесь, вероятно, нет нужды в доказательствах. При обычных условиях элементарный кислород не только бесцветен и потому невидим, но и не воспринимаем, не ощутим никакими органами чувств. Правда, недостаток, а тем более отсутствие кислорода мы ощутили бы моментально...
Открытие: XVIII век
То, что кислород невидим, безвкусен, лишен запаха, газообразен при обычных условиях, надолго задержало его открытие. Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду. Открытие кислорода (англ. Oxygen, франц. Oxygene, нем. Sauerstoff) ознаменовало начало современного периода развития химии. С глубокой древности было известно, что для горения необходим воздух, однако многие века процесс горения оставался непонятным. Лишь в XVII в. Майов и Бойль независимо друг от друга высказали мысль, что в воздухе содержится некоторая субстанция, которая поддерживает горение. Кислород открыли почти одновременно и независимо друг от друга два выдающихся химика второй половины XVIII в.— швед Карл Вильгельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше, но его трактат «О воздухе и огне», содержавший информацию о кислороде, был опубликован позже, чем сообщение об открытии Пристли.Джозеф Пристли: «1 августа 1774 года я попытался извлечь воздух из ртутной окалины и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению». И все-таки главная фигура в истории открытия кислорода — не Шееле и не Пристли. Они открыли новый газ — и только. Позже Фридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суждено было революционизировать химию, пропадал в их руках бесследно... Собственно открывшим кислород поэтому остается Лавуазье, а не те двое, которые только описали кислород, даже не догадываясь, что они описывают». Подробное изучение свойств кислорода и его роли в процессах горения и образования окислов привело Лавуазье к неправильному выводу о том, что этот газ представляет собой кислотообразующее начало. В 1779 г. Лавуазье ввел для кислорода название Oxygenium (от греч. «окис» – «кислый» и «геннао» – рождаю») — «рождающий кислоты».
«Окислительный» элемент
Если можно так выразиться, окислительнее кислорода — только один элемент, фтор. Именно поэтому баки с жидким кислородом — необходимая принадлежность большинства жидкостных ракетных двигателей. Получено соединение кислорода даже с таким химически пассивным газом, как ксенон. Для развития активной реакции кислорода с большинством простых и сложных веществ нужно нагревание — чтобы преодолеть потенциальный барьер, препятствующий химическому процессу. С помощью катализаторов, снижающих энергию активации, процессы могут идти и без подогрева, в частности, соединение кислорода с водородом. Высокая окислительная способность кислорода лежит в основе горения всех видов топлива, включая порох, для горения которых не нужен кислород воздуха: в процессе горения таких веществ кислород выделяется из них самих. Процессы медленного окисления различных веществ при обычной температуре имеют для жизни не меньшее значение, чем горение — для энергетики. Медленное окисление веществ пищи в нашем организме — «энергетическая база» жизни. Заметим попутно, что наш организм не слишком экономно использует вдыхаемый кислород: в выдыхаемом воздухе кислорода примерно 16%. Тепло преющего сена — результат медленного окисления органических веществ растительного происхождения. Медленное окисление навоза и перегноя согревает парники.
Применение: «море энергии»
В металлургииКонвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородо-воздушную смесь. Сварка и резка металловКислород в баллонах широко используется для газопламенной резки и сварки металлов. Ракетное топливоВ качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода). В медицинеКислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, профилактики гипоксии в виде кислородных коктейлей, кислородных подушек. В пищевой промышленностиВ пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ.Кислород применяется в лечебной практике, причем не только при легочных и сердечных заболеваниях, когда затруднено дыхание. Подкожное введение кислорода оказалось эффективным средством лечения таких тяжелых заболеваний, как гангрена, тромбофлебит, слоновость, трофические язвы. Не менее важен он и для промышленности. Обогащение воздуха кислородом делает эффективнее, быстрее, экономичнее многие технологические процессы, в основе которых — окисление. А на таких процессах пока держится почти вся тепловая энергетика. Превращение чугуна в сталь тоже невозможно без кислорода. Именно кислород «изымает» из чугуна избыток углерода. Одновременно улучшается и качество стали. Нужен кислород и в цветной металлургии. Жидкий кислород служит окислителем ракетного топлива. При сжигании водорода в токе кислорода образуется весьма обыкновенное вещество — Н2O. Конечно, ради получения этого вещества не следовало бы заниматься сжиганием водорода (который, кстати, часто именно из воды получают). Цель этого процесса иная, она будет ясна, если ту же реакцию записать полностью, учитывая не только химические продукты, но и энергию, выделяющуюся в ходе реакции: Н2+0,5O2=h3O+68317 калорий. Почти семьдесят больших калорий на грамм-молекулу! Так можно получить не только, «море воды», но и «море энергии». Для этого и получают воду в реактивных двигателях, работающих на водороде и кислороде. Та же реакция используется для сварки и резки металлов. Правда, в этой области водород можно заменить ацетиленом. Кстати, ацетилен все в больших масштабах получают именно с помощью кислорода, в процессах термоокислительного крекинга: 6СН4 + 4O2 = С2Н2 + 8Н2 + ЗСО + СO2 + ЗН2O. Это только один пример использования кислорода в химической промышленности. Кислород нужен для производства многих веществ (достаточно вспомнить об азотной кислоте), для газификации углей, нефти, мазута... Любое пористое горючее вещество, например, опилки, будучи пропитанными голубоватой холодной жидкостью — жидким кислородом, становится взрывчатым веществом. Такие вещества называются оксиликвитами и в случае необходимости могут заменить динамит при разработке рудных месторождений. Ежегодное мировое производство (и потребление) кислорода измеряется миллионами тонн. Не считая кислорода, которым мы дышим.
Производство кислорода
Попытки создать более или менее мощную кислородную промышленность предпринимались еще в прошлом веке во многих странах. Но от идеи до технического воплощения часто лежит «дистанция огромного размера»... Особенно быстрое развитие кислородной промышленности началось после изобретения академиком П.Л.Капицей турбодетандера и создания мощных воздухоразделительных установок.Проще всего получить кислород из воздуха, поскольку воздух — не соединение, и разделить воздух не так уж трудно. Температуры кипения азота и кислорода отличаются (при атмосферном давлении) на 12,8°С. Следовательно, жидкий воздух можно разделить на компоненты в ректификационных колоннах так же, как делят, например, нефть. Но чтобы превратить воздух в жидкость, его нужно охладить до минус 196°С. Можно сказать, что проблема получения кислорода — это проблема получения холода. Чтобы получать холод с помощью обыкновенного воздуха, последний нужно сжать, а затем дать ему расшириться и при этом заставить его производить механическую работу. Тогда в соответствии с законами физики воздух обязан охлаждаться. Машины, в которых это происходит, называют детандерами. Чтобы получить жидкий воздух с помощью поршневых детандеров, нужны были давления порядка 200 атмосфер. КПД установки был немногим выше, чем у паровой машины. Установка получалась сложной, громоздкой, дорогой. В конце тридцатых годов советский физик академик П.Л.Капица предложил использовать в качестве детандера турбину. Главная особенность турбодетандера Капицы в том, что воздух в ней расширяется не только в сопловом аппарате, но и на лопатках рабочего колеса. При этом газ движется от периферии колеса к центру, работая против центробежных сил. Турбодетандер «делает» холод с помощью воздуха, сжатого всего лишь до нескольких атмосфер. Энергия, которую отдает расширяющийся воздух, не пропадает напрасно, она используется для вращения ротора генератора электрического тока. Современные установки для разделения воздуха, в которых холод получают с помощью турбодетандеров, дают промышленности, прежде всего металлургии и химии, сотни тысяч кубометров газообразного кислорода.
Показатели качества газообразного медицинского кислорода ГОСТ 5583-78
| Кислород, не менее | 99,5 |
| Водяной пар, не более | 0,009 |
| Двуокись углерода, не более | 0,01 |
Показатели качества газообразного технического кислорода ГОСТ 5583-78
| Кислород, не менее | 99,7 | 99,5 |
| Водяной пар, не более | 0,007 | 0,009 |
| Двуокись углерода | Не нормируется |
Не нормируется |
По всем вопросам обращаться по телефону +7(3412) 311-005
www.techgazy.ru
Что легче кислород или углекислый газ. Чем отличается кислород от воздуха
Действительно, природный газ является дешевым и доступным топливом . Поднёс спичку и вот — тепловая и даже световая энергия. Ей достаточно легко управлять и пользоваться.Но всё ли так надёжно и просто?
Природный газ добывают на газовых месторождениях, и он от места добычи по газопроводам поступает к нашим газовым плитам и отопительным аппаратам. Можно проще — к плитам и котлам. Как хорошо. Бери и пользуйся!
Затем, чтобы поднять воду, вам нужно преодолеть давление водяного столба. Высокое, т.е. нормальное атмосферное давление. Во втором случае, когда вода поднимается до 1 м, плунжер также подвергается давлению 1 при температуре выше, а давление, действующее снизу, происходит от.
Поэтому необходимо преодолеть давление водяного столба. Таким образом, надежды на получение двигателя, который не потребляет энергию, рассеиваются. Замочите огонь кипятком. Кипящая вода удушает огонь быстрее, чем холодная вода, поглощая тепло испарения пламени и обматывая их паром, тем самым предотвращая доступ воздуха. Было бы лучше, если бы пожарные всегда имели кипящую воду, готовую подавлять пожары?
Так мы берём и пользуемся. Свои действия довели до автоматизма: зажигаем спичку, подносим ее к газовой горелке, открываем кран… Правильно, так и надо. Нельзя давать выходить газу без горения, иначе…
Основным горючим компонентом природного газа является метан . Это один из углеводородов, из-за которых так много шума — политического, экономического… Содержание его в природном газе может быть до 98%. Кроме метана в состав природного газа входят этан, пропан, бутан . К негорючим компонентам относятся: азот, углекислый газ, кислород, пары воды. Кстати, интересно знать, что горючими элементами таблицы Менделеева в нашей природе являются только углерод, водород и частично сера . Больше ничего не горит.
Пожарный насос не сможет набирать кипящую воду, так как под его поршнем должен быть 1-вольтовый пар вместо разреженного воздуха. Газ, содержащийся в контейнере. Контейнер А содержит сжатый воздух при давлении более 1 при комнатной температуре. На ртутном столбе на манометре указывается давление сжатого газа. Когда клапан В открывается, выделяется определенное количество газа, а ртутная колонна трубки манометра падает до высоты, соответствующей нормальному давлению. Некоторое время спустя было замечено, что, хотя ключ остался закрытым, ртуть снова поднялась.
Метан в смеси с воздухом в 5−15% случаев взрывоопасен , т. е. при внесении огня смесь мгновенно воспламеняется и выделяет большое количество тепла. Давление при этом увеличивается в 10 раз! Что это такое и как это выглядит, пояснять не буду, поверьте автору — страшно!
Представим себе (пусть это будет страшный сон), что в помещении, у которого внутренний объём 100 м.куб. оказалось от 5 до 15 м.куб. природного газа (замечу сразу, что специфический запах при этом будет невыносимым). И вот туда направляется кто-то в ночной рубахе, колпаке и со свечкой в руках. Ему так хочется узнать — что так противно воняет… Не узнает! Не успеет…
Пузырь на дне океана. Если бы около дна океана, на глубине 8 км, была бы пузырьковая форма, поднялась бы к поверхности? Закон Мариотта утверждает, что плотность газа обратно пропорциональна давлению. Применяя этот закон к рассмотренному случаю, мы можем заключить, что плотность воздуха под давлением 800 ат будет в 800 раз выше, чем при нормальном давлении. Воздух вокруг нас в 770 раз плотнее воды. По этой причине пузырьковый воздух на дне океана должен быть более плотным, чем вода, поэтому он не может появиться.
Однако этот вывод вытекает из ошибочного предположения, что закон Мариотта по-прежнему действует при давлении 800 ат. Уже при давлении 200 на воздухе сжато 190 раз вместо 200; при давлении 400 ат. 315 раз. Чем больше давление, тем ярче разница от величины, установленной законом Мариотта. При давлении 600 на воздухе сжимается 387 раз.
Сам природный газ не имеет цвета, вкуса и запаха. Его одорируют! Вот именно, придают всем известный «аромат», а интенсивность запаха делают такой, чтобы человеческий нос ощутил газ, когда его объем уже составляет 1% . Это значит, что еще 4% и страшный сон с кем-то в ночной рубахе, колпаке и свечкой в руках станет реальностью…
Колесо Сегнера в пустоте. Будет ли колесо Сегнера превраща
www.tariferix.ru















