Большая Энциклопедия Нефти и Газа. Какой заряд у кислорода
Строение атома кислорода (O), схема и примеры
Общие сведения о строении атома кислорода
Порядковый номер равен 8. Заряд ядра равен +8. Атомный вес – 15,999а.е.м. В природе встречаются три изотопа кислорода: 16O,17O и 18O, из которых наиболее распространенным является 16O (99,762 %).
Электронное строение атома кислорода
Атом кислорода имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –VI (халькогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 6 валентных электронов. Обладает высокой окислительной способностью (выше только у фтора).
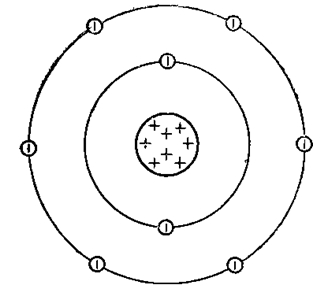
Рис. 1. Схематичное изображение строения атома кислорода.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p4.
Кислород – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
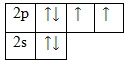
У кислорода есть 2 пары спаренных электронов и два неспаренных электрона. Во всех своих соединениях кислород проявляет валентность II.
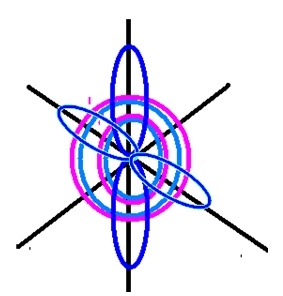
Рис. 2. Пространственное изображение строения атома кислорода.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Кислород как химический элемент - Ида Тен
Кислород – химический элемент, свойства которого будут рассмотрены в следующих нескольких параграфах. Обратимся к Периодической Системе химических элементов Д.И. Менделеева. Элемент кислород расположен во 2 периоде, VI группе, главной подгруппе.
Там же указано, что относительная атомная масса кислорода равна 16.
По порядковому номеру кислорода в Периодической Системе можно легко определить количество электронов, содержащихся в его атоме, заряд ядра атома кислорода, количество протонов.
Валентность кислорода в большинстве соединений равна II. Атом кислорода может присоединять два электрона и превращаться в ион: O0 + 2ē = O−2.
Стоит отметить, что кислород – самый распространенный элемент на нашей планете. Кислород входит в состав воды. Морские и пресные воды на 89% по массе состоят из кислорода. Кислород входит в состав множества минералов и горных пород. Массовая доля кислорода в земной коре составляет около 47%. В воздухе кислорода содержится около 23% по массе.
Физические свойства кислорода
При взаимодействии двух атомов кислорода образуется устойчивая молекула простого вещества кислорода O2. Данное простое вещество, как и элемент, называется кислородом. Не путайте кислород-элемент, и кислород – простое вещество!
По физическим свойствам кислород – бесцветный газ без запаха и вкуса. Практически нерастворим в воде (при комнатной температуре и нормальном атмосферном давлении растворимость кислорода составляет около 8 мг на один литр воды).
Кислород растворим в воде – в 1 л воды при температуре 20°С растворяется 31 мл кислорода (0,004% по массе). Однако этого количества достаточно для дыхания рыб, живущих в водоемах. Газообразный кислород немного тяжелее воздуха: 1 л воздуха при температуре 0°С и обычном давлении весит 1,29 г, а 1 л кислорода – 1,43 г.
Кислород проявляет интересные свойства при сильном охлаждении. Так, при температуре –183°С кислород конденсируется в прозрачную подвижную жидкость бледно- голубого цвета.
Если жидкий кислород охладить еще сильнее, то при температуре –218°С кислород «замерзает» в виде синих кристаллов. Если температуру постепенно повышать, то при –218°С, твердый кислород начнет плавится, а при –183°С – закипит. Следовательно, температуры кипения и конденсации, а также температуры замерзания и плавления для веществ являются одинаковыми.
Для хранения и транспортировки жидкого кислорода используют так называемые сосуды Дьюара. Сосуды Дьюара используют для хранения и транспортировки жидкостей, температура которых должна длительное время оставаться постоянной. Сосуд Дьюара носит имя его изобретателя, шотландского физика и химика Джеймса Дьюара.
Простейшим сосудом Дьюара является бытовой термос. Устройство сосуда довольно простое: это колба, помещенная в большую колбу. Из герметичного пространства между колбами откачивается воздух. Благодаря отсутствию воздуха между стенками колб, жидкость, налитая во внутреннюю колбу, долгое время не остывает или не нагревается.
Кислород — парамагнитное вещество, то есть в жидком и твердом состояниях он притягивается магнитом
В природе существует еще одно простое вещество, состоящее из атомов кислорода. Это озон. Химическая формула озона О3. Озон, так же как и кислород, в обычных условиях – газ. Озон образуется в атмосфере во время грозовых разрядов. Характерный запах свежести после грозы является запахом озона.
Если озон получить в лаборатории и собрать значительное количество его, то в больших концентрациях озон будет иметь резкий неприятный запах. Получают озон в лаборатории в специальных приборах – озонаторах. Озонатор – стеклянная трубка, в которую подают ток кислорода, и создают электрический разряд. Электрический разряд превращает кислород в озон:
В отличие от бесцветного кислорода, озон – газ голубого цвета. Растворимость озона в воде составляет около 0,5 л газа на 1 литр воды, что значительно больше, чем у кислорода. С учетом этого свойства озон применяется для обеззараживания питьевой воды, так как оказывает губительное действие на болезнетворные микроорганизмы.
При низких температурах, озон ведет себя аналогично кислороду. При температуре –112°С он конденсируется в жидкость фиолетового цвета, а при температуре –197°С кристаллизуется в виде темно-фиолетовых, почти черных кристаллов
Таким образом, можно сделать вывод, что атомы одного и того же химического элемента могут образовывать разные простые вещества.
Явление существования химического элемента в виде нескольких простых веществ называется аллотропией.
Простые вещества, образованные одним и тем же элементом, называют аллотропными модификациями
Значит, кислород и озон – аллотропные модификации химического элемента кислорода. Существуют данные, что при сверхнизких температурах, в жидком или твердом состоянии кислород может существовать в виде молекул О4 и О8.
Круговорот кислорода в природе
Количество кислорода в атмосфере постоянно. Следовательно, расходующийся кислород постоянно пополняется новым.
Важнейшими источниками кислорода в природе является углекислый газ и вода. Кислород попадает в атмосферу главным образом в результате процесса фотосинтеза, протекающего в растениях, согласно схеме реакции:
CO2 + h3O → C6h22O6 + O2.
Кислород может образовываться и в верхних слоях атмосферы Земли: вследствие воздействия солнечного излучения, водяные пары частично разлагаются с образованием кислорода.
Кислород расходуется при дыхании, сжигании топлива, окислении различных веществ в живых организмах, окислении неорганических веществ, содержащихся в природе. Большое количество кислорода расходуется в технологических процессах, таких как, например, выплавка стали.
Круговорот кислорода в природе можно представить в виде схемы:

- Кислород – элемент VI группы, главной подгруппы, 2 периода Периодической Системы Д.И. Менделеева
- Элемент кислород образует в природе две аллотропные модификации: кислород О2 и озон О3
- Явление существования химического элемента в виде нескольких простых веществ называется аллотропией
- Простые вещества называют аллотропными модификациями
- Кислород и озон имеют различные физические свойства
- Кислород – бесцветный газ без запаха, вкуса, практически не растворим в воде, при температуре –183°С конденсируется в бледно-голубую жидкость. При температуре –218°С кристаллизуется в виде кристаллов синего цвета
- Озон – газ синего цвета с резким неприятным запахом. Хорошо растворим в воде. При температуре –112°С конденсируется в фиолетовую жидкость, кристаллизуется в виде темно-фиолетовых, почти черных кристаллов, при температуре –197°С
- Жидкий кислород, озон и другие газы хранят в сосудах Дьюара
idaten.ru
Кислород эффективный заряд ядра - Справочник химика 21
По мере заполнения данной оболочки, например 2/7-оболочки, ионизационный потенциал растет с увеличением атомного числа, а поскольку электроны данной оболочки очень мало экранируют друг друга, эффективный заряд ядра также растет. Надо отметить исключение в группе кислорода ионизационный потенциал О меньше, чем Н. Пока в р-оболочке имеются 3 или меньше электронов, они все могут находиться на различных из трех возможных р-орбит Рх> Ру Рх) что электростатическое отталкивание минимально. 4/7-электрон должен сесть на орбиту, которая занята одним электроном. Повышенное электростатическое отталкивание является причиной того, что электрон связан менее прочно, чем можно было ожидать из рассмотрения одного лишь эффективного. заряда ядра. [c.228]
Эффективный заряд атома, входящего в состав соединения, определяется как алгебраическая сумма его отрицательного электронного заряда и положительного заряда ядра. В настоящее время известно более десятка экспериментальных методов определения значений эффективных зарядов в большинстве своем с точностью (0,1 — 0,3)е, что соизмеримо с точностью вычисления этих зарядов в квантовой химии и теории твердого тела. В табл. 9 приведены данные по эффективным зарядам атомов, которые получены рентгеноспектральным методом д.пя ряда типичных неорганических веществ. Знаком отмечены эффективные заряды на металлических элементах, знаком — на электроотрицательных атомах. К чисто ионным соединениям близки только галогениды щелочных металлов, хотя и для них эффективные заряды не достигают единицы. Все остальные соединения, в том числе галогениды, оксиды, сульфиды кальция и магния, являются только частично ионными. Кроме того, эффективные заряды на типических электроотрицательных атомах (кислород, сера) почти не превосходят 1, в то время как заряды металлических элементов (кальций, алюминий) могут быть заметно больше единицы. Это объясняется тем, что энергия присоединения двух электронов к кислороду и сере (сродство к электрону второго порядка) отрица- [c.63]
Чем объяснить уменьшение эффективного заряда ядра атома при переходе от гелия к литию от бериллия к бору от азота к кислороду [c.18]
На рис. 19 приведен график изменения потенциалов ионизации, в нем отчетливо выражена периодичность. Несоответствие изменения потенциалов ионизации изменению эффективного заряда ядра от азота к кислороду, от фосфора к сере обусловливается уже отмеченной повышенной устойчивостью наполовину заполненных р-орбиталей. Уменьшение ионизационных потенциалов в группах объясняется увеличением атомного радиуса. При [c.33]
Способность атома фтора к захвату электрона можно объяснить исходя из одноэлектронной интерпретации энергии ионизации. На рис. 2.10 изображено изменение эффективного заряда ядра, который ощущают валентные электроны фтора, по мере их последовательного удаления. Кривая на графике экстраполирована к Е(,. Как видно из такой экстраполяции, на электрон, который легче всего удалить, действует эффективный заряд ядра, равный приблизительно 1,0, Это означает, что даже у отрицательного иона притяжение к ядру перевешивает отталкивание электронов. На рис. 2.10 приведен также график для кислорода. На этот раз полученное экстраполяцией зна- [c.64]
Расстояния между ядрами атомов и угол между связями в мономерной молекуле Н2О измерены надежно и с достаточной точностью. Менее надежны данные о распределении эффективного электрического заряда. В соответствии с данными Бьеррума [5] положительный заряд ядра атома кислорода полностью экранирован электронами. Экранирована также основная часть заряда протонов. Таким образом, можно считать, что эффективные электрические заряды молекулы воды сосредоточены в верщинах тетраэдра, центр которого совпадает с центром молекулы, и находятся на расстоянии 0,99 А от ядра атома кислорода. Молекула воды имеет два положительных и два отрицательных полюса с эффективным зарядом 0,17 е каждый (е — заряд электрона), образующих почти правильный тетраэдр. Несмотря на то что эта модель довольно грубо описывает строение молекулы воды, на ее основе можно объяснить некоторые особенности структуры льда. Существуют и другие предположения о распределении электронного заряда в молекуле воды, подтвержденные Вер-веем [6а]. Во всяком случае, основой проверки любой теории, касающейся распределения электронного заряда, служит величина дипольного момента молекулы воды (1,87 Д), полученная в результате надежных экспериментов. [c.32]
Связь между атомами разных элементов всегда более или менее полярна, что обусловлено различием размеров и электроотрицательностей атомов. Например, в молекуле хлорида водорода НС1 связующее электронное облако смещено в сторону более электроотрицательного атома хлора. Вследствие этого заряд ядра водорода уже не компенсируется, а на атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра. Иными словами, атом водорода в НС1 поляризован положительно, а атом хлора отрицательно на атоме водорода возникает положительный заряд, на атоме хлора — отрицательный. Этот заряд б, называемый эффективным, можно установить экспериментально. Согласно имеющимся данным эффективный заряд на атоме водорода молекулы H l составляет бн =+0,18, а на атоме хлора Oq =—0,18 абсолютного заряда электрона. Можно сказать, что связь в молекуле НС1 имеет на 18% ионный характер, т. е. полярна. Ниже приведены значения эффективных зарядов на атомах кислорода в оксидах элементов 3-го периода [c.80]
Как уже указывалось на стр. 132, атом кислорода в молекуле воды находится в состоянии хр -гибридизации. Поэтому валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°). Электроны, образующие связи О—Н, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных 5р -орбиталях, смещены относительно ядра атома и создают два отрицательных полюса (рис. 71). [c.199]
Эффективный заряд атома, входящего в состав соединения, определяется как алгебраическая сумма его отрицательного электрон-мого заряда и положительного заряда ядра. В настоящее время известно более десятка экспериментальных методов определения значений эффективных зарядов в большинстве своем с точностью 0,1 — Д,3 е, что соизмеримо с точностью вычисления этих зарядов в квантовой химии и теории твердого тела. В табл. 10 приведены данные по эффективным зарядам атомов, которые получены рентгеноспектральным методом для ряда типичных неорганических веществ. Знако.м -Ь отмечены эффективные заряды на металлических элементах, знаком — на электроотрицательных атомах. К чисто ионным соединениям близки только галогениды щелочных металлов, хотя и для них эффективные заряды не достигают единицы. Все остальные соединения, в том числе галогениды, оксиды, сульфиды кальция и магния, являются только частично ионными. Кроме того, эффективные заряды на типических электроотрицательных атомах (кислород, сера) почти не превосходят 1, в то время как заряды металлических элементов (кальций, алюминий) могут быть заметно больше единицы. Это объясняется тем, что энергия присоединения двух электронов к кислороду и сере (сродство к электрону второго порядка) отрицательна. Расчеты показывают, что сродство к электрону второго порядка для кислорода равно —732, а для серы составляет —334 кДж/моль. Значит, ионы типа и 5 не существуют, и все оксиды, сульфиды, независимо от активности металлов, не относятся к ионным соединениям. Если двухзарядные анионы в действительности не -существуют, тем более нереальны многозарядные одноатомные отрицательные ионы. [c.84]
Аналогично электрическому дипольному моменту двухатомной молекулы можно описать электрический дипольный момент связи. Например, в молекуле НдО каждая из связей О—Н имеет свой дипольный момент, равный произведению эффективного заряда атома Н на расстояние между ядрами О и Н и направленный от ядра атома кислорода к ядру атома водорода. [c.152]
Для тонких водных прослоек расчеты структурных изменений удалось пока осуществить лишь в немногих случаях. Антонченко, Давыдов и Ильин [109, 141] провели численные расчеты методом Монте-Карло, используя для описания межмолекулярных взаимодействий в воде потенциал Роулинсона. Он включает, кроме потенциала Леннард—Джонса, кулоновское взаимодействие между четырьмя эффективными электрическими зарядами в каждой молекуле воды. Два положительных заряда д = +0,328е расположены на атомах водорода на расстоянии 0,8743 А от атома кислорода. Два отрицательных заряда д = —0,328е расположены на расстояниях 0,25 А от центра атома кислорода на линии, перпендикулярной плоскости молекулы. Эти заряды аппроксимируют распределения максимальной плотности электронов вокруг ядра атома кислорода. Взаимодействие между зарядами двух молекул воды приближенно описывает межмолекулярную водородную связь. [c.231]
Поэтому можно считать, что взаимодействие между ядром атома водорода и долей электронной плотности (с зарядом, равным—1), которая находится вблизи этого ядра, т. е. как бы атомом водорода в молекуле воды, и ядром атома кислорода и долей электронной плотности (с зарядом, равным —8), находящейся вблизи этого ядра — как бы атомом кислорода в молекуле воды, — будет очень сильным, и его называют химической связью, которая связывает эти эффективные атомы в одно целое. Взаимодействие между эффективными атомами водорода в молекуле воды является значительно более слабым, чем в молекуле водорода, и поэтому считают, что эти атомы в молекуле воды не связаны друг с другом химическими связями, а оказывают друг на друга лишь взаимное влияние . [c.19]
Эффект сопряжения существенно изменяет энергию водородной связи молекул ароматических соединений с молекулами воды, что должно сильно отразиться на величине растворимости производных бензола в воде. Так, эффект оттягивания электронной плотности из ароматического ядра на введенную в молекулу фенола нитрогруппу приводит к повышению эффективного положительного заряда у атома кислорода, в результате чего энергия Н-связей между фенольной группой и молекулами воды значительно уменьшается. В соответствии с этим растворимость п-нитрофенола в 10 раз меньше растворимости фенола (табл. 7). [c.29]
Четыре атома кислорода в анионе СЮ , действуя как электрофильные лиганды, заметно притягивают к себе 5р -облака возникающих 0-связей и, таким образом, как бы оттягивают на себя часть электронного экрана, лежащего между пустой Зй-орбиталью атома хлора и его ядром. В результате эффективный ядерный заряд, способный действовать на электрон Зй-орбита-ли, заметно возрастает и потому заселение 3 -орбитали становится энергетически выгодным З -облако менее диффузно и способно прочнее связываться с ядром. На такие подготовленные в энергетическом смысле З -орби-тальные вакансии могут частично переходить электроны от неподеленных пар атомов кислорода. [c.281]
Второй период образует атомы от до Ne. В направлении — Ке растет эффективный заряд ядра, в связи с чем уменьшаются размеры атомов (см. Гшах), возрастает потенциал ионизации и осуществляется, начиная с В, переход к неметаллам. Потенциал ионизации отражает не только рост в ряду —Ке, но и особенности электронных конфигураций потенциал ионизации у бора ниже, чем у бериллия. Это указывает на упрочнение заполненных нодоболочек ( у бериллия). Более высокий потенциал ионизации азота по сравнению с кислородом указывает на повышенную прочность конфигурации р , в которой каждая орбиталь занята одним / -электроном. Аналогичные соотношения наблюдаются и в следующем периоде у соседей Mg—А1 и Р—5. У атомов второго периода отрыв электрона с внутреннего Ь -слоя требует такого высокого ПИ (75,62 эВ уже у лития), что в химических и оптических процес--сах участвуют только внешни электроны. Сродство к электрону в ряду Ы—Р имеет тенденцию к возрастанию. Но у берилжя оболочка заполнена, и сродство к электрону эндотермично так же, как и у гелия (1л ). Обладая самым высоким потенциалом ионизации ю всех неметаллов и высоким сродством к электрону, фтор является наиболее электроотрицательным элементом в периодической системе. Для атома неона СЭ (Ке)=—0,22 эВ. Оболочка з р атома Ке, электронный октет, характеризуется суммарным нулевым спином и нулевым орбитальным моментом (терм 5о). Все это, вместе с высоким потенциалом ионизации и отрицательным сродством к электрону, обусловливает инертность неона. Такая же з р конфигурация внешнего слоя характерна для вСех элементов нулевой группы. Исследования последних лет показывают, что 1 п, Хе,Кг и Аг дают химические соединения со фтором и кислородом. Очевидно, что з р конфигурация не влечет как непременное следствие химической инертности. Все атомы со спаренными электронами (терм о) — диамагниты (Не, Ве, Ке и т. д.). Конфигурации внешнего электронного слоя у атомов 2-го и 3-го периодов, стоящих в одних и тех же группах, одинаковы, чем объясняется близость химических свойств элементов, стоящих в одних и тех же группах (сравните Ка иЬ1 в табл. 5). Но наблюдается и различие элементы второго периода обладают постоянной валентностью, а третьего — переменной. Это связано с тем, что у атомов третьего периода есть вакантные -состояния в третьем квантовом слое, а во втором слое таких соединений нет. [c.62]
Характеристика элемента. Бериллий, так же как и литий, относится к числу -элементов. Четвертый электрон, появляющийся в атоме Ве, помещается на 25-орбитали. Энергия ионизации бериллия выще, чем у лития, из-за большего заряда ядра. Эффективный заряд ядра, влияющий на четвертый -электрон, равен гэфф=1,66. В результате взаимодействия ядра с электронным окружением атом становится меньше (/ ве=1,ИА). Удалить электроны с 2 -орбиталп не просто первый потенциал ионизации почти в два раза больше, чем у лития, а второй потенциал так высок (18,2 эВ), что существование иона Ве + (с полной потерей двух электронов) практически невозможно. Даже в соединениях с фтором связи Ве—Р в значительной степени ковалентны, не говоря уже о связях с другими элементами. Следовательно, степень окисления -Ь2, приписываемая ему, величина условная. Для образования ковалентных связей бериллию необходимо разъединение (распаривание) 25-электронов. Чтобы это произошло, один из них должен перейти на более высокую 2р-орбиталь. Таким образом, когда атом бериллия переходит в такое состояние, его два электрона занимают две эквивалентные 5р-гибридизованные орбитали. Несмотря на то что связи бериллия в основном ковалентны даже в простых солях, все же был оценен его примерный ионный радиус 0,31 А. Это меньше, чем у атома водорода и иона Н+, и, следовательно, создает значительное поле положительного заряда и делает его способным прочно связывать анион кислорода, даже отнимая его у гидроксил-иона [c.205]
Эффективные заряды ядра и средние радкусы для подгрупп бериллия и кислорода в одноэлектронном приближении [c.70]
В принципе такие спектры сходны с ЯМР низкого разрешения. К примеру, химические сдвиги в спектрах ЯМР тоже зависят от эффективных зарядов атомов. Однако помимо данного фактора на них влияет такое множество других, что вьщелить эту зависимость в чистом виде оказывается довольно трудно. ЭСХА же трактуется значительно проще. Кроме того (не стоит забывать), рентген б равным успехом позволяет видеть сигналы не только углерода, но и любых других атомов, кроме водородных на рис. 84 вынесена лишь часть спектра, в котором есть еще линии и кислорода, и фтора. И если на ядрах последнего ЯМР тоже возможен, то кислород с его нулевым спином для ЯМР немой . Именно для таких элементов, особенно для серы с ее разнообразными, порой трудно доказуемыми валентными состояниями, рентгеноэлектронная спектроскопия применяется наиболее часто и успешно. [c.208]
Стабилизация феиоксид-анионов обусловлена эффектом сопряжения - делокализацией отрицательного заряда в результате его взаимодействия с я-орбнталями бензольного кольца. Феиоксид-анион можно поэтому представить набором граничных резонансных структур или в виде резонансного гибрида (схема 12.24, а). Делокализация в случае неионизированного фенола за счет неподеленной электронной пары атома кислорода в гидроксильной группе менее эффективна, так как она происходит с разделением зарядов (см. схему 12.24, б). Сопряженные с бензольным кольцом двойные связи увеличивают кислотность, как это наблюдается в случае введения в ядра-положение [c.429]
chem21.info
Химия. Как правильно расставить степень окисления?
ок, давай возьмеме кпримеру h3MnO4,перенная степень окисления у Марганца, значит клеем разборки с кислородом и водородом у кислорода -2,а таких атомов у нас 4.значит -2*4=-8(и ставь эти числа над элементами в формуле чтоб видно было) дальше водород, у него +1,а таких атомов 2 следовательно +1*2=+2 уловила? теперь, вся молекула должна быть с зарядом 0 значит мы должны посчитать какой заряд должен быть у марганца, чтоб получился 0 в итоге +2(от всего водорода) и -8 от кислорода... значит нам надо еще +6 и заряды уравняются понятно? если нет, то пиши на мэйл, объясню еще раз
Na2B4O7 У Na (+1). Таких атомов 2. Значит, (+1)х2=+2 У кислорода (-2). Таких атомов 7. Отсюда (-2)х7=-14 В сумме молекула должна быть электронейтральна (0). +2-14=-12 (приходится на натрий и кислород) . Надо узнать, какая степень окисления у В, чтобы в сумме получился 0. Значит, на весь В приходится +12. Обрати внимание, меняем знак. Таких атомов 4. Дальше 12:4=3. А про h3MnO4 Маша написала
Есть еще способ: написать уравнение с одним неизвестным УЧИТЫВАЯ ЗНАКИ и приравнять к НУЛЮ. Так ВЫ сможете сосчитать ЛЮБЫЕ САМЫЕ ТРУДНЫЕ ФОРМУЛЫ, если будете заниматься со мной.
touch.otvet.mail.ru
Отрицательно заряженный атом - кислород
Отрицательно заряженный атом - кислород
Cтраница 3
Степень полимеризации максимальна при низких значениях рН, когда в наличии имеется достаточное количество свободных протонов; при этих условиях отрицательно заряженные атомы кислорода в оксианионах способны превращаться в гидроксидные группы - ОН, которые затем участвуют в реакции конденсации, приводящей к образованию полимерных ионов. [31]
Электростатическое отталкивание между отрицательно заряженными карбоксильными группами к анионе малешшвой кислоты, вероятно, является наиболее важным влиянием, так как отрицательно заряженные атомы кислорода много ближе друг к другу, чем в поно фумаровон кислоты. [32]
Ка я-нитрофенола меньше, чем рКа лг-нитрофенола, так как ь последнем нитрогруппа не находится в прямом полярном сопряжб нии с отрицательно заряженным атомом кислорода. [33]
Эффект увеличения скорости реакции под влиянием сульфогруппы 8Оз сравнительно невелик, что объясняется действием / - эффекта, возникающего за счет трех отрицательно заряженных атомов кислорода. [34]
Взаимодействие молекул аммиака через неподеленную электронную пару атома азота с катионами и через один или два атома водорода групп NH с соседними отрицательно заряженными атомами кислорода остова цеолита должно приводить к асимметричному возмущению молекулы. [35]
Наиболее устойчивые комплексы образуются лигандами, на донорных атомах которых максимален эффективный заряд при минимальном радиусе: йбном F и лигандами, координирующимися через отрицательно заряженные атомы кислорода. [36]
Если же в качестве растворителя используется диметилсульфоксид, то сольватация осуществляется путем взаимодействия метоксид-аниона с положительно заряженным атомом серы и катиона металла - с отрицательно заряженным атомом кислорода. [38]
В хромовом комплексе этого красителя во внутренней координационной - сфере хром соединен с тремя молекулами воды, с одним нейтральным атомом азота и с двумя отрицательно заряженными атомами кислорода. [39]
Можно предполагать, что фуроксановое кольцо имеет сильный отрицательный индуктивный эффект благодаря положительному заряду на атоме азота N-оксидной группы и сильные положительные мезомерный и электромерный эффекты ввиду наличия отрицательно заряженного атома кислорода в той же группе. [40]
Гидридная подвижность водорода в альдегидах в реакции Канниццаро, так же как в алкоголятах алюминия в реакции Меервейна - Пондорфа - Верлея, очевидно есть следствие внутримолекулярной нуклеофильной атаки отрицательно заряженного атома кислорода на углерод. В результате гидридная подвижность водорода у атома углерода настолько возрастает, что гидрид-ион переходит даже к такому слабому акцептору, как карбонильная группа второй молекулы альдегида. [41]
В хромовом комплексе этого красителя во внутренней координационной сфере атом хрома соединен с четырьмя нейтральными группами и атомами ( три молекулы воды и один атом азота) и двумя отрицательно заряженными атомами кислорода. [42]
Отклонения структурно закономерны: все лгета-заместители лежат на прямой, пора-заместители ( JW) - типа также лежат на прямой, а отклоняются лишь жгра-заместители ( - Л /) - типа: NO 2, CHO, CN и т.п. Эти отклонения можно связать с тем, что в фенолят-анионе отрицательно заряженный атом кислорода непосредственно связан с бензольным кольцом, в то время как в анионе бензойной кислоты отрицательный заряд отделен от бензольного ядра карбонильным углеродом. [43]
Дело в том, что в отличие от 0-фенантродина и а а - дипиридила, координирующихся к тита-ну ( Ш) двумя равноценными гетероароматическими атомами азота ( благодаря чему хелатный цикл составляет полностью сопряженную систему), шшолиновая кислота координируется к титаву ( Ш) двумя неравноценными в отношении координационной связи атомами - гете-роароиатическим атомом азота и отрицательно заряженным атомом кислорода карбоксильной группы. Хелатный цикл образующегося соединения не составляет полностью сопряженной системы. Большая поляризуемость неподеленной пары электронов атома азота по сравнению с атомом кислорода ведет к большему взаимному перекрыванию орбита-лей азота с 3d - орбиталями титана ( Ш) и к большей степени делока-дизации, чем в случае связи с атомом кислорода. Кроме того, наличие отрицательно заржевного кислорода карбоксильной группы, для которого характерно образование с металлами прочныхе-донорных-акцепторных связей, в сочетании с хе-латообразованием приводит к тому, что значение констант нестойкости соединений титана ( Ш) с пиколиновой кислотой близки значениям для соединений титана ( 1У) с этим реагентом и даже ниже его. [44]
Этот ряд оказался обратным установленному для водных растворов, в которых рКа метилового спирта меньше, чем трет-бути-лового; это объясняется тем, что в отсутствие растворителя отрицательный заряд атома кислорода стабилизируется поляризацией связей С-С и С - Н и, поскольку в грег-бутильной группе их больше, чем в метильной, стабилизация трет-бутокси-аниона больше, чем метокси-аниона. В присутствии растворителя отрицательно заряженный атом кислорода взаимодействует с кислотными центрами растворителя ( если растворитель имеет протони-зированный атом водорода, то образуется водородная связь), что приводит к стабилизации аннона. При этом возможно проявление стерических эффектов при взаимодействии анионов с растворителем и, так как в rper - бутокси-анионе атом кислорода экранирован значительно больше, чем в метилат-анионе, стабилизация последнего растворителем больше. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Отрицательно заряженный ион - кислород
Отрицательно заряженный ион - кислород
Cтраница 2
Важное значение в топливном элементе имеет электролит. Для температуры выше 1000 используются твердые электролиты, причем ток в таких электролитах должен переноситься только отрицательно заряженными ионами кислорода. Этому требованию удовлетворяет, например, двуокись циркония и некоторые другие сложные системы. Электроды высокотемпературных элементов менее чувствительны к отравлению; это позволяет расширить ассортимент материалов для электродов и снижает требования к очистке топлива. Но зато резко увеличивается коррозия электродов и конструктивных узлов топливного элемента. В результате часто наблюдаются изменения структуры электрода и его растрескивание. По этим причинам срок службы высокотемпературных элементов исчисляется лишь месяцами, тогда как низкотемпературные элементы работают годы. [16]
Высшие полбжительные валентности Элементов, образующих оксиды, равны номерам групп периодической системы, в которых они находятся, и в нашем ряде возрастают да единицу. Если число атомов ( элементарных ионов) элемента в формуле равно двум, то нужно учитывать, что они Судут связаны между собой через отрицательно заряженный ион кислорода. [17]
Окисная пленка растет за счет переноса ионов. Однако при этом должно также происходить перемещение электронов в том же направлении, что и перемещение положительно заряженных ионов металла, или в обратном направлении относительно перемещения отрицательно заряженных ионов кислорода. Движение электронов, через окислы связано с дефектами решетки окисла ( см. разд. [18]
Адсорбированные ионы кислорода образуют часть поверхности решетки и связаны подобно соседним ионам кислорода, уже присутствующим в решетке. За исключением ионов фтора, которые имеют практически те же самые размеры и поэтому могут достаточно хорошо присоединяться к незаполненному тетраэдру SiO4, никакие другие анионы не могут заместить отрицательно заряженные ионы кислорода. Кроме того, поверхность кремнезема практически не заряжена в нейтральной среде, так как противоположно заряженные ионы водорода прочно связаны в форме нейтральных групп ОН. Если среда является щелочной, то ионы водорода замещаются ионами натрия, которые, будучи несходными с протоном, не могут входить в электронную структуру иона и поэтому более склонны к гидратации. [19]
Для ионов, лежащих на вновь образованной поверхности, эти связи частично разрушаются, в результате чего на такой поверхности всегда существуют положительно и отрицательно заряженные активные центры с ненасыщенной ионной связью. После соприкосновения поверхности с водным раствором ионы гидроксила ОН - из раствора будут присоединяться к положительно заряженным металлическим ионам, достраивая кристаллическую решетку и заряжая поверхность отрицательно, а ионы водорода Н - к отрицательно заряженным ионам кислорода твердой фазы, сообщая поверхности положительный заряд. [20]
Вторая группа объединяет керметы на основе оксидов. Оксиды плохо смачиваются расплавленными металлами, и в результате достигнуть прочной связи между металлом и оксидом, как правило, не удается. Объясняется это тем, что на поверхности оксидов имеются отрицательно заряженные ионы кислорода, которые отталкивают электроны металла и тем самым препятствуют хорошему сцеплению между ними. Поэтому при спекании керметов состава оксид - металл при температуре, превосходящей температуру плавления металла-связки, металл вытекает. Во избежание такого явления керметы оксидного типа обжигают при температуре ниже плавления металла, когда последний находится в вязкотекучем, но еще в твердом состоянии. [21]
При сближении атомов и перекрытии валентных энергетических зон между элементами происходит перераспределение электронов: электроположительный элемент теряет валентные электроны, превращаясь в положительный ион, а электроотрицательный - приобретает их, достраивая тем самым свою валентную зону до устойчивой конфигурации, как у инертных газов. Таким образом, в узлах ионного кристалла располагаются ионы. Представитель этой группы - кристалл FeO, решетка которого состоит из отрицательно заряженных ионов кислорода и положительно заряженных ионов железа. [22]
Часто на поверхности частиц грунта минералы имеют не полностью уравновешенные атомы, так как внешние электрические заряды остаются свободными. Поэтому частицы грунта ведут себя как заряженные тела. Величина их заряда обусловлена поверхностной активностью минеральных частиц, которая особенно сильно проявляется во взаимодействии с молекулами воды, имеющими положительно заряженные ионы водорода и отрицательно заряженные ионы кислорода. Это взаимодействие приводит к притяжению ориентированных дипольных молекул воды к поверхности минеральных частиц. [23]
Это - главное и существенное в данной реакции. Получив положительный заряд, ионы водорода притянулись к отрицательно заряженным ионам кислорода, и образовались молекулы воды. Так как решающее значение в реакциях окисления-восстановления имеет перемещение электронов, окислительно-восстановительными мы назвали все реакции, обусловленные перемещением электронов от какого-либо одного элемента к другому; об элементе, отдающем электроны, условились говорить, что он окисляется, а об элементе, получающем электроны, что он восстанавливается. [24]
Как только на поверхности образуется ион кислорода, он может диффундировать в решетку. Например, он может двигаться в промежутки решетки, и, таким образом, в ней образуется избыток кислорода. В этом случае дефекты решетки появляются в местах локализации избыточных ионов кислорода. Адсорбция значительг ных количеств кислорода на решетке пятиокиси ванадия должна привести к образованию отрицательно заряженных ионов кислорода, которые остаются на поверхности и могут привести к образованию положительных зарядов решетки в результате оттягивания электронов к слою адсорбированного кислорода. Этот положительный заряд может затем помешать дальнейшей адсорбции кислорода вследствие возникающих электростатических сил. [25]
При изучении роста очень тонких пленок ( w 100 А) необходимо принимать во внимание возможность ограничения скорости роста процессами переноса по поверхности пленки, а не переносом через пленку. Известным примером такого рода эффектов служит окисление алюминия, когда после образования нескольких первых слоев скорость падает до очень низкого значения. То же наблюдается и при окислении некоторых других металлов. Скорость окисления алюминия определяется стадией перехода его в виде ионов Als через границу раздела металл-окисел в междоузлии решетки окисла. Этот барьер намного больше того, который приходится преодоле-вать иону при переходе из одного междоузлия в другое, так что скорость диффузии в самом окисле не определяет скорости окисления в целом. Вероятность того, что такой переход произойдет, определяется выражением v ехр ( - е / / е0Т), где v - частота колебаний атома. Скорость переходов повышается под действием электрического поля, возникающего в результате адсорбции на внешней поверхности отрицательно заряженных ионов кислорода, поскольку они притягивают ионы А13 через слой окисла. [26]
Страницы: 1 2
www.ngpedia.ru