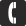Молярная масса кислорода. Чему равна молярная масса кислорода? Масса кислорода
Молярная масса кислорода. Чему равна молярная масса кислорода?
Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная масса, которую можно рассчитать для атомов, ионов и молекул. Один из важнейших элементов на Земле — кислород, с его участием протекают многие реакции и процессы. Для выполнения расчетов по формулам соединений, уравнениям реакций используется молярная масса кислорода, которая численно равна относительной массе его атома или молекулы.
Кислород
Общие сведения о кислороде (химическом элементе):
- латинское название — Oxygenium;
- химический символ — O;
- находится в верхней части 16-й группы (ранее — группы VI A) периодической таблицы;
- расположен во втором периоде сразу после азота, перед фтором;
- относится к семейству халькогенов;
- номер элемента в периодической таблице и заряд ядер его атомов — 8.
Кислород как один из компонентов атмосферы долгое время не могли выделить в чистом виде. Газ называли «животворящим», «эликсиром жизни». Честь открытия кислорода делят между собой ученые с мировым именем: К. Шееле, Дж. Пристли, А. Лавуазье. Термин «оксиген» предложил А. Лавуазье, исходя из важной роли вещества, его атомов в процессах образования оксидов и кислот.

При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.

Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
Молярная масса эквивалента кислорода
Эквивалентной называют величину, равную массе 1 моля атомов любого одновалентного элемента. В общем случае можно определить эквивалентную массу, поделив молярную массу атомов химического элемента на его валентность, найденную по формуле конкретного соединения. В большинстве своих соединений кислород, как химический элемент-халькоген, двухвалентен. Молярная масса кислорода может быть найдена по таблице Менделеева, ее округленное значение — 16. Эквивалентная масса в 2 раза меньше — 8. В химии применяется закон эквивалентов, который гласит, что вещества вступают в реакцию между собой в количествах, равных их эквивалентам. При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.

Кислород — один из важнейших элементов в земной коре, на него приходится 46,6 % массы. Простое соединение с тем же названием — второе по распространенности в атмосфере Земли. Содержание молекулярного кислорода в воздухе — 20,947 % по объему. При участии атомов элемента и молекул вещества протекают многие реакции и процессы в технике, промышленности, живой и неживой природе. Важно учесть количественные отношения в этих процессах, что значительно облегчает использование физических величин, в том числе молярной массы кислорода.
fb.ru
Молярная масса кислорода (O), формула и примеры
Молярная масса кислорода
Единицей измерения молярной массы является г/моль или кг/кмоль. Молярная масса вещества в граммах численно равна его молекулярной (атомной) массе, выраженной в атомных единицах массы:
M = Ar.
Относительная атомная масса атомарного кислорода равна 15,99903 а.е.м. Его относительная молекулярная масса будет равна 15,99903, а молярная масса:
M(O) = Mr (O) × 1 моль = 15,99903 г/моль.
Известно, что молекула кислорода двухатомна – O2, тогда, относительная атомная масса молекулы кислорода будет равна:
Ar(O2) = 15,99903 × 2 = 31,99806а.е.м.
Относительная молекулярная масса молекулы кислорода будет равна 31,99806, а молярная масса:
M(O2) = Mr (O2) × 1 моль = 31,99806 г/моль или просто 32 г/моль.
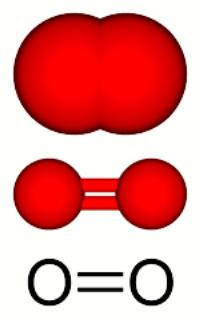
Кислород представляет собой газ без цвета и запаха (схема строения атома представлена на рис. 1), плохо растворимый в воде с очень низкими значениями температур плавления(-218,9oC) и кипения (-183oC).
Рис. 1. Строение атома кислорода.
Известно, что в природе кислород может находиться в виде трех изотопов 16O (99,76%), 17O (0,04%) и 18O (0,2%). Эти изотопы характеризуются различным содержанием нейтронов в ядре атома, а значит и молярной массой. В первом случае она будет равна 16 г/моль, во втором – 17 г/моль, а в третьем – 18 г/моль.
Молярную массу газа можно рассчитать, как произведение его плотности по отношению к любому другому газу на молекулярную массу последнего. Под плотностью понимают отношение массу определенного объема данного газа к массе такого же объема другого газа (при одинаковых температуре и давлении), молекулярная масса которого известна.
Молекулярную массу вещества в газообразном состоянии также можно рассчитать, зная его молярный объем: найти объем (н.у.), занимаемый определенной массой данного вещества, а затем вычислить массу 22,4 л этого вещества при этих же условиях.
Кроме этих способов, чтобы определить молярную массу газа, возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона), однако это метод является наименее точным из всех перечисленных.
Примеры решения задач
ru.solverbook.com
Молярная масса кислорода. Чему равна молярная масса кислорода?
Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная масса, которую можно рассчитать для атомов, ионов и молекул. Один из важнейших элементов на Земле — кислород, с его участием протекают многие реакции и процессы. Для выполнения расчетов по формулам соединений, уравнениям реакций используется молярная масса кислорода, которая численно равна относительной массе его атома или молекулы.
Кислород
Общие сведения о кислороде (химическом элементе):
- латинское название — Oxygenium;
- химический символ — O;
- находится в верхней части 16-й группы (ранее — группы VI A) периодической таблицы;
- расположен во втором периоде сразу после азота, перед фтором;
- относится к семейству халькогенов;
- номер элемента в периодической таблице и заряд ядер его атомов — 8.
Кислород как один из компонентов атмосферы долгое время не могли выделить в чистом виде. Газ называли «животворящим», «эликсиром жизни». Честь открытия кислорода делят между собой ученые с мировым именем: К. Шееле, Дж. Пристли, А. Лавуазье. Термин «оксиген» предложил А. Лавуазье, исходя из важной роли вещества, его атомов в процессах образования оксидов и кислот.

Как находят молярную массу элемента или вещества?
При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Видео по теме
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.

Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
Молярная масса эквивалента кислорода
Эквивалентной называют величину, равную массе 1 моля атомов любого одновалентного элемента. В общем случае можно определить эквивалентную массу, поделив молярную массу атомов химического элемента на его валентность, найденную по формуле конкретного соединения. В большинстве своих соединений кислород, как химический элемент-халькоген, двухвалентен. Молярная масса кислорода может быть найдена по таблице Менделеева, ее округленное значение — 16. Эквивалентная масса в 2 раза меньше — 8. В химии применяется закон эквивалентов, который гласит, что вещества вступают в реакцию между собой в количествах, равных их эквивалентам. При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.

Кислород — один из важнейших элементов в земной коре, на него приходится 46,6 % массы. Простое соединение с тем же названием — второе по распространенности в атмосфере Земли. Содержание молекулярного кислорода в воздухе — 20,947 % по объему. При участии атомов элемента и молекул вещества протекают многие реакции и процессы в технике, промышленности, живой и неживой природе. Важно учесть количественные отношения в этих процессах, что значительно облегчает использование физических величин, в том числе молярной массы кислорода.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
 Образование Чему равна степень окисления кислорода? Валентность и степень окисления кислорода
Образование Чему равна степень окисления кислорода? Валентность и степень окисления кислородаВсе мы дышим воздухом, который в основном состоит из молекул азота и кислорода с незначительным добавлением других элементов. Таким образом, кислород является одним из наиважнейших химических элементов. Кроме того, мо...
 Домашний уют Чему равна плотность кирпича?
Домашний уют Чему равна плотность кирпича?Кирпич – это один из самых известных строительных материалов. Он обладает рядом важнейших свойств, которые делают его незаменимым. Кирпич устойчив к воздействию осадков, способен выдержать большое количество цик...
 Еда и напитки Какая плотность подсолнечного масла? Чему равна плотность подсолнечного масла?
Еда и напитки Какая плотность подсолнечного масла? Чему равна плотность подсолнечного масла?Масло подсолнечника создается на основе растительных жиров, которые добывают из семян этого растения. Этот тип продукта считается наиболее распространенным среди жителей России и близлежащих стран.Химический с...
 Здоровье Чему равна норма уровня сахара в крови?
Здоровье Чему равна норма уровня сахара в крови?Глюкоза – один из основных энергетических материалов нашего организма. Ко...
 Образование Пядь - это сколько? Чему равна пядь? Что означает слово «пядь»?
Образование Пядь - это сколько? Чему равна пядь? Что означает слово «пядь»?Иногда и сегодня можно услышать слова из старорусского языка. Они настолько глубоко вошли в обиход, что без них речь становится тусклой и бесцветной. Однако, употребляя подобные выражения, мы зачастую и не догадываемс...
 Образование Диагональ равнобокой трапеции. Чему равна средняя линия трапеции. Виды трапеций. Трапеция - это..
Образование Диагональ равнобокой трапеции. Чему равна средняя линия трапеции. Виды трапеций. Трапеция - это..Трапеция – это частный случай четырехугольника, у которого одна пара сторон является параллельной. Термин «трапеция» произошел от греческого слова τράπεζα, означающего "...
 Образование Чему равна скорость света
Образование Чему равна скорость светаХотя в обыденной жизни редко кому приходится непосредственно рассчитывать, чему равна скорость света, интерес к данному вопросу проявляется еще в детстве. Удивительно, но все мы ежедневно сталкиваемся с признаком к...
 Бизнес Предельный продукт труда - это что такое, чему равна его величина?
Бизнес Предельный продукт труда - это что такое, чему равна его величина?Чем бы ни занималась фирма, она в любом случае работает на результат. А этот результат есть произведенная продукция. Продукт производства может быть как вещественным, так и невещественным. На машиностроительном заводе...
 Образование Какова поверхность Земли? Чему равна поверхность Земли?
Образование Какова поверхность Земли? Чему равна поверхность Земли?Земля – уникальная планета. Она сильно отличается от других планет Солнечной системы. Только здесь имеется все необходимое для нормального развития жизни, в том числе вода. Она занимает более 70% всей поверхност...
 Образование Чем равна удельная теплота сгорания дров?
Образование Чем равна удельная теплота сгорания дров?Удельная теплота сгорания дров - это количество теплоты, которое выделяется при сгорании одного килограмма (единицы объема) газообразного, жидкого, твердого топлива. В качестве международной единицы измерения для данн...
monateka.com
Химик.ПРО - Масса кислорода | Решение задач по химии бесплатно
Найти массу кислорода (O2), необходимого для полного сжигания 67,2 литров (нормальные условия) сероводорода (h3S) до сернистого газа (SO2).
Решение задачи
Запишем уравнение реакции горения сероводорода (h3S):
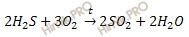
Отмечу то, что если сжигаемое вещество содержит серу, то при горении, независимо от количества кислорода, образуется сернистый газ (SO2).
Учитывая, что сероводорода (h3S) – бесцветный газ с характерным запахом, вычислим химическое количество сероводорода (h3S) по формуле, устанавливающей связь между химическим количеством вещества и объемом:
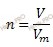
Получаем:
n (h3S) = 67,2 / 22,4 = 3 (моль).
По уравнению реакции рассчитаем химическое количество кислорода (O2), необходимого для полного сжигания 67,2 литров сероводорода (h3S):
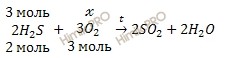
х моль O2 необходимо для полного сжигания 3 моль h3S
3 моль O2 необходимо для полного сжигания 2 моль h3S
Откуда:
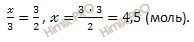
Учитывая, что молярная масса кислорода (O2) равна 32 г/моль, найдем массу кислорода (O2) по формуле, устанавливающей связь между массой и химическим количеством вещества:
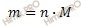
Получаем:
m (O2) = 4,5 ∙ 32 = 144 (г).
Ответ:
масса кислорода (O2) равна 144 грамма.
Похожие задачи по химии
himik.pro
Молярная масса кислорода. Чему равна молярная масса кислорода?
Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная масса, которую можно рассчитать для атомов, ионов и молекул. Один из важнейших элементов на Земле — кислород, с его участием протекают многие реакции и процессы. Для выполнения расчетов по формулам соединений, уравнениям реакций используется молярная масса кислорода, которая численно равна относительной массе его атома или молекулы.
Кислород
Общие сведения о кислороде (химическом элементе):
- латинское название — Oxygenium;
- химический символ — O;
- находится в верхней части 16-й группы (ранее — группы VI A) периодической таблицы;
- расположен во втором периоде сразу после азота, перед фтором;
- относится к семейству халькогенов;
- номер элемента в периодической таблице и заряд ядер его атомов — 8.
Кислород как один из компонентов атмосферы долгое время не могли выделить в чистом виде. Газ называли «животворящим», «эликсиром жизни». Честь открытия кислорода делят между собой ученые с мировым именем: К. Шееле, Дж. Пристли, А. Лавуазье. Термин «оксиген» предложил А. Лавуазье, исходя из важной роли вещества, его атомов в процессах образования оксидов и кислот.
Как находят молярную массу элемента или вещества?
При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.
Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
Молярная масса эквивалента кислорода
Эквивалентной называют величину, равную массе 1 моля атомов любого одновалентного элемента. В общем случае можно определить эквивалентную массу, поделив молярную массу атомов химического элемента на его валентность, найденную по формуле конкретного соединения. В большинстве своих соединений кислород, как химический элемент-халькоген, двухвалентен. Молярная масса кислорода может быть найдена по таблице Менделеева, ее округленное значение — 16. Эквивалентная масса в 2 раза меньше — 8. В химии применяется закон эквивалентов, который гласит, что вещества вступают в реакцию между собой в количествах, равных их эквивалентам. При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.
Кислород — один из важнейших элементов в земной коре, на него приходится 46,6 % массы. Простое соединение с тем же названием — второе по распространенности в атмосфере Земли. Содержание молекулярного кислорода в воздухе — 20,947 % по объему. При участии атомов элемента и молекул вещества протекают многие реакции и процессы в технике, промышленности, живой и неживой природе. Важно учесть количественные отношения в этих процессах, что значительно облегчает использование физических величин, в том числе молярной массы кислорода.
4u-pro.ru
Содержание
Инструкция
|
completerepair.ru
Молярная масса - кислород - Большая Энциклопедия Нефти и Газа, статья, страница 1
Молярная масса - кислород
Cтраница 1
Молярная масса кислорода М 32 х х 10 - 3 кг / моль, поэтому в 0 1 кг кислорода имеется и [ 0 1 / ( 32.10 - 3) ] - 6 02 10 1 88 - Ш24 молекул. [1]
Здесь [ Л 32 кг / кмоль - молярная масса кислорода, Я - универсальная газовая постоянная. [2]
Обозначим через ml и М1 - массу и молярную массу кислорода, через / п2 и М2 - массу и молярную массу гелия. [3]
PJ - первоначальные значения температуры и давления газа; / и - молярная масса кислорода. [4]
К - абсолютная температура кислорода до нагревания; М 0 032 кг / моль - молярная масса кислорода, R 8 32 Дж / ( К моль) - универсальная газовая постоянная. [5]
Дж / ( кг - К), где R - универсальная газовая постоянная моля газа, равная 8 314; / - молярная масса кислорода. [6]
Па - давление газа, р01 43 кг / мэ - плотность кислорода при нормальных условиях, р0 1 013 - 105 Па - нормальное атмосферное давление, ц32 - 10 - 3 кг / моль - молярная масса кислорода, 8 314 Дж / ( моль - К) - молярная газовая постоянная. [7]
Дано: У 200 0 м8 - объем газа, Г300 К - температура газа, р1 6 105 Па - давление газа, р01 43 кг / м3 - плотность кислорода при нормальных условиях, р0 1 013 - 105 Па - нормальное атмосферное давление, М 32 - 10 3 кг / моль - молярная масса кислорода, R 8 314 Дж / ( моль - К) - газовая постоянная. [8]
Дано: У200 0м3 - объем газа, Г300 К - температура газа, р1, 6 - 105 Па - давление газа, р 1 43 кг / м3 - плотность кислорода при нормальных условиях, р0 1 013 - 105 Па - нормальное атмосферное давление, р32 - 10 3 кг / моль - молярная масса кислорода, 8 314 Дж / ( моль - К) - молярная газовая постоянная. [9]
Дано: V200 0 м3 - объем газа, Г300 К - температура газа, р1 6 - 105 Па - давление газа, р 1 43 кг / м3 - плотность кислорода при нормальных условиях, рв1 013 - 105 Па - нормальное атмосферное давление, ц32 - 10 - 3 кг / моль - молярная масса кислорода, Я8 314 Дж / ( моль - К) - молярная газовая постоянная. [10]
Молярная масса вещества ( в г / моль) численно равна относительной атомной или молекулярной массе этого вещества. Относительная атомная масса кислорода равна 16, значит, молярная масса атомного кислорода составляет 16 г / моль, а молярная масса кислорода О2 равна 32 г / моль. [11]
Масса 1 моль вещества, или молярная масса, численно равна относительной молекулярной массе этого вещества, выраженной в атомных единицах массы. Так, относительная молекулярная масса кислорода равна 32 а. Молярная масса кислорода составляет 32 г / моль. [12]
Под каким давлением будет находиться выделившийся кислород, если он находится в объеме 0 5л при температуре 15 50 К. Электрохимический эквивалент и молярная масса кислорода равны соответственно 8 3 10 - 8 кг / Кл и 3 2 10 2 кг / моль. [13]
В вертикальном цилиндре под поршнем находится 2 кг кислорода. Найти количество теплоты, сообщенное кислороду; работу, совершаемую им при расширении; его удельную теплоемкость в двух случаях: а) поршень не закреплен; б) поршень закреплен. Молярная масса кислорода 32 10 - 3 кг / моль. [14]
Страницы: 1 2
www.ngpedia.ru