Плотность сжиженного газа. Плотность углекислого газа г см3
Плотность сжиженного газа (S), значение и примеры
Плотность сжиженного газа и другие его физические свойства
Процесс перевода вещества из газообразного состояния в жидкое используется в научных, промышленных и коммерческих целях.
Одной из важнейших характеристик сжиженного газа является его плотность. Определение значения данной величины можно осуществлять различными методами, причем наиболее достоверные результаты получаются, когда пробу, отобранную из жидкой фазы, испаряют в газометр и вычисляют плотность с помощью газового пикнометра.
Однако этот метод, хотя и является весьма точным, требует значительного времени и практически неприменим для некоторых сортов сжиженного газа, в частности газов, содержащих пентан и другие более тяжелые углеводороды, кипящие при температурах выше 36oС. Поэтому для определения плотности сжиженных газов часто используют приборы под названием ареометры.
Плотности некоторых сжиженных газов приведены в таблице ниже.
Таблица 1. Плотность сжиженных газов.
|
Сжиженный газ |
Плотность, г/см3 |
|
Водород |
0,0708 |
|
Кислород |
1,141 |
|
Азот |
0,808 |
|
Хлор (20oС) |
1,408 |
|
Гелий ( |
0,13 |
|
Природный газ |
0,4 |
|
Воздух (-490oС) |
0,960 |
|
Пропан (0oС) |
0,5297 |
|
Изобутан (0oС) |
0,5810 |
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Плотность - Плотности некоторых газов
Химия - Плотность - Плотности некоторых газов
28 февраля 2011Оглавление:1. Плотность2. Виды плотности и единицы измерения3. Зависимость плотности от температуры4. Плотности астрономических объектов5. Плотности некоторых газов6. Измерение плотности
| Азот | 1,250 | Кислород | 1,429 |
| Аммиак | 0,771 | Криптон | 3,743 |
| Аргон | 1,784 | Ксенон | 5,851 |
| Водород | 0,090 | Метан | 0,717 |
| Водяной пар | 0,598 | Неон | |
| Воздух | 1,293 | Углекислый газ | 1,977 |
| Хлор | 3,214 | Гелий | 0,178 |
| Этилен | 1,260 |
Плотности некоторых жидкостей
| Бензин | 0,74 | Молоко | 1,03 |
| Вода | 1,00 | Ртуть | 13,60 |
| Керосин | 0,82 | Эфир | 0,72 |
| Глицерин | 1,26 | Спирт | 0,80 |
| Морская вода | 1,03 | Скипидар | 0,86 |
| Масло оливковое | 0,92 | Ацетон | 0,792 |
| Масло машинное | 0,91 | Серная кислота | 1,84 |
| 0,81—0,85 | Жидкий водород | 0,07 |
Плотность некоторых пород древесины
| Бальса | 0,15 | Пихта сибирская | 0,39 |
| Секвойя вечнозелёная | 0,41 | Ель | 0,45 |
| Ива | 0,46 | Ольха | 0,49 |
| Осина | 0,51 | Сосна | 0,52 |
| Липа | 0,53 | Конский каштан | 0,56 |
| Каштан съедобный | 0,59 | Кипарис | 0,60 |
| Черёмуха | 0,61 | Лещина | 0,63 |
| Грецкий орех | 0,64 | Берёза | 0,65 |
| Вишня | 0,66 | Вяз гладкий | 0,66 |
| 0,66 | Клён полевой | 0,67 | |
| Тиковое дерево | 0,67 | Бук | 0,68 |
| Груша | 0,69 | Дуб | 0,69 |
| Свитения | 0,70 | Платан | 0,70 |
| Жостер | 0,71 | Тис | 0,75 |
| Ясень | 0,75 | Слива | 0,80 |
| Сирень | 0,80 | Боярышник | 0,80 |
| Пекан | 0,83 | Сандаловое дерево | 0,90 |
| Самшит | 0,96 | Эбеновое дерево | 1,08 |
| Квебрахо | 1,21 | Бакаут | 1,28 |
| Пробка | 0,48 |
Просмотров: 6295
| Полярные вещества |
4108.ru
СОСТАВ И СВОЙСТВА ПРИРОДНЫХ ГОРЮЧИХ ГАЗОВ — Город эрудитов
.
Газы нефтяных и газовых месторождений – это горючие газы. Они состоят из углеводородов: метана СН4, этана С2Н6, пропана С3Н8, бутана С4Н10, пентана С5Н12 и гептана С7Н16. Это – ближайшие гомологи метана.
Кроме углеводородов встречаются азот N2, углекислый газ СО2, иногда сероводород Н2S. Довольно часто, но в очень небольших количествах в природном газе имеются сопутствующие инертные газы: гелий Не, аргон Ar, ксенон Хе и др.
Газ, состоящий преимущественно из метана и этана и содержащий мало пропана и бутана, называют сухим или бедным.
Газ, в котором кроме метана СН4 и этана С2Н6 имеются пропан С3Н8, бутан С4Н10, пентан С5Н12, гексан С6Н14,, гептан С7Н16 и др., называют жирным или богатым. Точной границы между ними нет.
Для газов нефтяных месторождений характерно преобладание тяжелых углеводородов от 0,4 до 40-50%. Содержание метана обычно 30-90%. Тяжелые углеводороды в газах – это все углеводороды с удельным весом, превышающим удельный вес этана.
Удельный вес газа определяется отношением веса единицы объема газа по отношению к весу одинакового объема сухого атмосферного воздуха, удельный вес которого принимают 1,0 при температуре 0°С и давлении 760 мм рт. ст.
Чем больше удельный вес газа, тем богаче газ тяжелыми углеводородами. Наоборот, небольшой удельный вес указывает на обилие в газе метана.
Плотность – масса вещества в единице объема в кг/м3или г/см 3.
Плотность газа. 1 грамм-молекула любого газа при нормальных условиях (температура 0°С и давление 0,1 МПа) занимает 22,412 л, т.е. в 1 м3 любого газа содержится 44,6 моля. Обычно пользуются относительной плотностью газа по воздуху.
При температуре 0°С и давлении 0,1 МПа, масса 1 м3 воздуха составляет 1,293 кг.
Относительная плотность метана – 0,555; этана – 1,046; пропана – 1,547; бутана – 2,074; углекислого газа – СО2 – 1,519; сероводорода – 1,176 и т.д.
Для каждого газа существует определенная тепловая граница – наивысшая температура, выше которой газ не переходит в жидкое состояние, как бы велико ни было давление.
Точно так же для каждого газа существует предельное давление, ниже которого, как бы ни была низка температура, газ не переходит в жидкое состояние.
Эти предельные температуры и давления приводятся ниже и называются критическими.
Учитывая, что в условиях месторождений нефть и газ залегают обычно под давлением 20-14 атм. при температуре 30-90°С, можно сделать вывод, что из этих углеводородов только метан будет находиться в газообразном состоянии, остальные углеводороды будут представлены их парами.
Таблица
Газ | Молекулярная масса | Температура кипения при 760 мм рт ст. | Температура критическая, °С | Критиче-ское давление, мПа | Плотность по воздуху |
| Метан СН4 | 16,04 | -161,5 | -82,5 | 4,58 | 0,554 |
| Этан С2Н6 | | -88,3 | 32 | 4,87 | 1,038 |
| Пропан С3Н8 | 44,10 | -42,2 | 96 | 4,24 | 1,522 |
| Бутан С4Н10 | 58,12 | -0,5 | 153 | 3,64 | 2,00 |
| Пентан С5Н12 | 72,15 | 36,1 | 196 | 3,36 | 2,49 |
| Гексан С6Н14 | 86,17 | 68,9 | 234,5 | 2,73 | 2,97 |
| Гептан С7Н16 | 100,2 | 98,4 | 266,8 | 2,64 | 3,4 |
| Октан С8Н18 | 114,2 | 125,6 | 295,7 | 2,42 | – |
Теплота сгорания – это количество тепла, которое выделяется при сгорании 1 м3 газа.
Наибольшая теплота сгорания свойственна более жирным газам. Так, для метана она равна 8000 кал/м3; этана – 15680; бутана – 29000 кал /м3.
Газы обладают способностью сокращаться на 1/273 часть своего объема при температуре 0°С при каждом понижении температуры на 1°С, если только давление остается постоянным.
Расширение газа будет в таком же соотношении при повышении температуры. Значит, при температуре -273°С газ не имел бы объема. Такая температура называется абсолютным нулем.
Однако, практически все газы превращаются в жидкости или твердые тела, прежде чем эта температура будет достигнута.
Растворимость газов в нефти зависит от температуры, давления и свойств растворителя, состава газа.
Растворимость газа в нефти измеряется количеством газа в кубических метрах на 1 м3 или 1 т товарной нефти при давлении 0,1 МПа и температуре 20°С.
Растворимость увеличивается при росте давления и снижается при повышении температуры и увеличении молекулярной массы и плотности нефти, а также с возрастанием доли нафтеновых и ареновых соединений.
Коэффициентом растворимости называют количество газа, растворяющегося в единице объема или массы нефти при увеличении давления на единицу.
В качестве критерия оценки фазового состояния пластовой системы можно условно принять, что в газовой залежи приходится свыше 1000 объемов газа на 1 объем жидкости, в нефтяной с растворенным газом – менее 1000 объемов.
Отношение объема газа к объему или массе добываемой с ним жидкости называется газовым фактором.
При глубине 2000 м, т.е. давлении 21-22 МПа, растворимость газа будет примерно 200 м3/м3, при глубине 1200 м – около60 м3/м3. Это усредненное соотношение газа и нефти в пласте.В реальных залежах оно может существенно отличаться в большую или меньшую сторону.
Нефть может быть предельно насыщена газом, т.е. количество газа в объеме нефти равно его растворимости при данных температурах и давлении, или недонасыщена им. В первом случае пластовое давление равно давлению насыщения нефти газом. При его снижении (например в результате разработки) часть газа выделится в свободную фазу, а в газонефтяном растворе установится равновесие при новом, более низком пластовом давлении (давлении насыщения) и новой более низкой газонасыщенности нефти.
Гидратообразование. Наличие в газе воды обуславливает при определенной температуре и давлении образование кристаллогидратов углеводородных газов. Гидраты газов представляют собой кристаллические соединения. Это твердые растворы, где растворителем является вода.
Гидраты имеют эмпирические формулы: для метана – СН4•7Н2О; этана – С2Н6•8Н2О ; пропана – С3Н8•18 Н2О и др. Для каждого углеводорода характерна максимальная температура (критическая температура гидратообразования), выше которой нельзя вызвать образование гидратов никаким повышением давления. Для метана она равна 21,5°С; этана – 14,5°С; пропана – 5,5°С; бутана – 1,4°С.
Чем тяжелее углеводородный газ, тем легче он образует гидраты, но начиная с пентана углеводороды гидратов не образуют.
Гидратообразование происходит не только в процессе эксплуатации и транспорта газа, но и в пористой среде осадочного чехла с формированием гидратных залежей. Гидратообразование приурочено к районам распространения многолетних мерзлых пород, где глубина промерзания горных пород достигает 500-700 м и более. Внешне газовые гидраты похожи на лёд или снег.
www.eruditcity.ru
Плотность углерода (C), значение и примеры
Плотность углерода и другие его физические свойства
Углерод существует в природе в свободном состоянии в виде двух аллотропных видоизменений – алмаза, кристаллизующегося в кубической и гексагональной (лонсдейлит) системе, и графита, принадлежащего к гексагональной системе.
Алмаз – бесцветное, прозрачное вещество, чрезвычайно сильно преломляющее лучи света. Одна половина атомов углерода в алмазе располагается в вершинах и центрах граней одного куба, а другая – в вершинах и центрах граней другого куба, смещенного относительно первого в направлении его пространственной диагонали. Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объема.
Важнейшие характеристики углерода приведены в таблице ниже:
Таблица 1. Физические свойства и плотность углерода.
|
Характеристика |
Алмаз |
Графит |
|
Плотность, г/см3 |
3,47 – 3,55 |
2,09 – 2,23 |
|
Теплопроводность, Вт/(м×К) |
900 – 2300 |
100 – 354,7 |
|
Твердость |
10 |
1-2 |
|
Температура плавления, oС |
3700 – 4000 |
Около 4000 |
Графит представляет собой темно-серые кристаллы со слабым металлическим блеском. Он имеет слоистую решетку – плоская сетка, составленная из правильных шестиугольников, в вершинах которых находятся ядра атомов углерода.
Такие формы углерода, как древесный уголь, кокс или сажа имеют неупорядоченную структуру. Также есть аллотропные модификации, полученные синтетическим путем – это карбин и поликумулен – разновидности углерода, построенные из линейных цепных полимеров типа -C = C- или = C = C =.
Известны также аллотропные модификации углерода, имеющие следующие названия: графен, фуллерен, нанотрубки, нановолокна, астрален, стеклоуглерож, колоссальные нанотрубки; аморфный углерод, углеродные нанопочки и углеродная нанопена.
Распространенность углерода в природе
Углерод не принадлежит к самым распространенных элементам в природе – из общего числа атомов земной коры на его долю приходится лишь 0,14% (масс.). Тем не менее значение углерода исключительно велико, так как его соединения являются основой всех живых организмов.
Формы нахождения углерода в природе многообразны. Кроме тканей живых организмов и продуктов их разрушения (каменный уголь, нефть и т.д.), он входит в состав многих минералов, имеющих большей своей частью формулу MeCO3, где Ме – двухвалентный металл. Наиболее распространенным из таких минералов является кальцит (CaCO3), образующий иногда громадные скопления на отдельных участках земной поверхности. Атмосфера содержит углерод в виде углекислого газа (CO2), который в растворенном состоянии также находится во всех природных водах.
Краткое описание химических свойств и плотность углерода
В обычных условиях углерод весьма инертен. Напротив, при достаточно высоких температурах он становится химически активным по отношению к большинству металлов и многим металлоидам. «Аморфный» углерод значительно более реакционноспособен, чем обе основные формы этого элемента (алмаз и графит).
При нагревании «аморфного» углерода на воздухе он энергично взаимодействует с кислородом, причем по реакции
C + O2 = CO2 + 94 ккал
Образуется двуокись углерода (углекислый газ). Алмаз и графит сгорают лишь в чистом кислороде и при достаточно высоких температурах (100-800oС).
Примеры решения задач
ru.solverbook.com
люди кто мне скажет плотность ксенона(Xe) и углекислого газа (CO2)!!! ТОМУ +10
Молярный объём любого газа при нормальных условиях составляет 22,4 л/ моль. Молярную массу определяем по формуле вещества.<br><br>22,4 л СО2 весят 44г при нормальных условиях (0 С , 101 325 Па)<br>плотность= 44г : 22,4 л = ...(г/л)<br><br>22,4 л Хе весят 131г при нормальных условиях (0 С , 101 325 Па)<br>плотность= 131 г : 22,4 л = ...(г /л)<br>Подсчитай сам. Лениво.<br>
ат. Xenon, от греческого xenos — чужой), Хе (читается «ксенон»), химический элемент с атомным номером 54, атомная масса 131,29. Инертный, или благородный, газ. Расположен в группе VIIIA в 5 периоде периодической системы.<br>Природный атмосферный ксенон состоит из девяти изотопов: 124 Хе (0,096%), 126 Хе (0,090%), 128 Хе (1,92%), 129 Хе (26,44%), 130 Хе (4,08), 131 Хе (21,18%), 132 Хе (26,89%), 134 Хе (10,44%) и 136 Хе (8,87%).<br>Радиус атома 0,218 нм. Электронная конфигурация внешнего слоя 5 s 2 p 6 . Энергии последовательной ионизации — 12,130, 21,25, 32,1 эВ. Электроотрицательность по Полингу 2,6. Ксенон — редчайший газ земной атмосферы, содержание в воздухе 8,6·10-5% по объему. Общие запасы ксенона в атмосфере 1,6·1011м3.<br>Одноатомный газ без цвета и запаха. Температура кипения –108,12°C, плавления –11,85°C. Критическая температура 16,52°C, критическое давление 5,84 МПа. Плотность 5,85 кг/м3.<br><br>СО2 - угольный ангидрид, углекислый газ, СО2, бесцветный газ со слегка кисловатым запахом и вкусом, плотность 1,98 г/л.<br>
touch.otvet.mail.ru
|
Плотности некоторых твердых тел, жидкостей и газов (при нормальном атмосферном давлении, t = 20 °C)
|
|
raal100.narod.ru
| объём стягивается к точке, в которой определяется Плотность Отношение Плотность двух веществ при определённых стандартных физических условиях называется относительной Плотность: для жидких и твёрдых веществ она обычно определяется по отношению к Плотность дистиллированной воды при 4 °С, для газов - по отношению к Плотность сухого воздуха или водорода при нормальных условиях. Средняя Плотность тела определяется отношением массы тела m к его объёму V, т. е. r = m/V. Единицей Плотность в СИ является кг/м3, в СГС системе единиц г/см3. На практике пользуются также внесистемными единицами Плотность: г/л, т/м3 и др. Для измерения Плотность веществ применяют плотномеры, пикнометры, ареометры, гидростатическое взвешивание (см. Мора весы). Др. методы определения Плотность основаны на связи Плотность с параметрами состояния вещества или с зависимостью протекающих в веществе процессов от его Плотность Так, плотность идеального газа может быть вычислена по уравнению состояния r = pm/RT, где р - давление газа, m - его молекулярная масса (мольная масса), R - газовая постоянная, Т - абсолютная температура, или определена, например, по скорости распространения ультразвука Диапазон значений Плотность природных тел и сред исключительно широк. Так, Плотность межзвёздной среды не превышает 10-21кг/м3, средняя Плотность Солнца составляет 1410 кг/м3, Земли - 5520 кг/м3, наибольшая Плотность металлов - 22 500 кг/м3(осмий), Плотность вещества атомных ядер - 1017кг/м3, наконец, Плотность нейтронных звёзд может, по-видимому, достигать 1020кг/м3. Значения Плотность некоторых широко используемых веществ и материалов приведены в таблице. См. также Газы, Металлы. Для пористых и сыпучих тел различают истинную Плотность (её определяют без учёта имеющихся в теле пустот) и кажущуюся Плотность (отношение массы тела ко всему занимаемому им объёму). Плотность, как правило, уменьшается с ростом температуры (вследствие теплового расширения тел) и увеличивается с повышением давления. Аномально ведут себя, например, вода, чугун, аморфный кварц. Так, у воды Плотность имеет максимальное значение при 4 °C и уменьшается как с повышением, так и с понижением температуры. При агрегатных превращениях вещества Плотность изменяется скачком (см. Агрегатные состояния), причём при переходе из жидкого состояния в твёрдое Плотность обычно растет, однако у воды, например, она при затвердевании уменьшается.
Лит.: Справочник химика, 3 изд., т. 1, Л., 1971; Перельман В. И., Краткий справочник химика, 6 изд., М., 1963; Измерение массы, объёма и плотности, М., 1972: ГОСТ 2939-63. Газы. Условия для определения объёма. С. Ш. Кивилис.
Плотность веществ, материалов и минералов, кг/м3
Статья про слово "Плотность" в Большой Советской Энциклопедии была прочитана 10622 раз | Интересное | ||||
bse.sci-lib.com









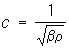 (здесь b - адиабатическая сжимаемость газа).
(здесь b - адиабатическая сжимаемость газа).