Известковая вода и углекислый газ. Вода и углекислый газ
Конечные продукты распада жиров....Например углеводы распадаются на углекислый газ и воду. А жиры????
Обмен жиров. Жиры пищи под действием ферментов желудочного, поджелудочного и кишечного соков (при участии желчи) расщепляются на глицерин и ясирные кислоты (последние подвергаются омылению) . Из глицерина и жирных кислот в эпителиальных клетках ворсинок тонкого кишечника синтезируется жир, свойственный организму человека. Жир в виде эмульсии поступает в лимфу, а вместе с ней — в общий кровоток. Суточная потребность в жирах в среднем составляет 100 г. Избыточное количество жира откладывается в соединительнотканной жировой клетчатке и между внутренними органами. При необходимости эти жиры используются как источник энергии для клеток организма. При расщеплении 1 г жира выделяется наибольшее количество энергии — 38,9 кДж. Конечными продуктами распада жиров являются вода и углекисльш газ. Жиры могут синтезироваться из углеводов и белков. <a href="/" rel="nofollow" title="2668:##:http://www.google.ru/search?sourceid=navclient&hl=ru&ie=UTF-8&rlz=1T4MOOI_ruRU368RU369&q=%d0%9a%d0%be%d0%bd%d0%b5%d1%87%d0%bd%d1%8b%d0%b5+%d0%bf%d1%80%d0%be%d0%b4%d1%83%d0%ba%d1%82%d1%8b+%d1%80%d0%b0%d1%81%d0%bf%d0%b0%d0%b4%d0%b0+%d0%b1%d0%b5%d0%bb%d0%ba%d0%be%d0%b2+" target="_blank" >[ссылка заблокирована по решению администрации проекта]</a>
А жиры остаются и откладываются на брюхе и бедрах!:)
а оно тебе надо. каникулы же
вода и углекислый газ это же сложные эфиры
распад больше выводится через легкие или почки
жиры на глицерин и жирные кислоты, а белки на аминокислоты
touch.otvet.mail.ru
Вода и углекислый газ
А1. Конечными продуктами окисления органических веществ являются:
А7. Синтез молекул АТФ происходит
- в процессе биосинтеза белка
- в процессе синтеза крахмала из глюкозы
- на подготовительном этапе энергетического обмена
- на кислородном этапе энергетического обмена
Часть В В1. Какие общие свойства характерны для митохондрий и хлоропластов?
- не делятся в течение жизни клетки
- имеют собственный генетический материал
- являются одномембранными
- содержат ферменты окислительного фосфорилирования
- имеют двойную мембрану
- участвуют в синтезе АТФ
- происходит в цитоплазме клетки
- происходит в митохондриях
- завершается образованием пировиноградной кислоты или этилового спирта
- энергетический эффект – 2 молекулы АТФ
- завершается образованием АТФ, двуокиси углерода и воды
- энергетический эффект – 36 молекул АТФ
В3. Установите соответствие между признаком энергетического обмена и его этапом.
| Признаки обмена | Этапы энергетического обмена |
| А) гликолиз Б) кислородное расщепление А – 236Б – 145 |
В4. Установите соответствие между характеристикой энергетического обмена веществ и его этапом.
| Характеристика обмена веществ | Этапы обмена веществ |
| А) подготовительный Б) гликолиз А – 235 Б – 146 |
В5. Установите последовательность процессов, протекающих на каждом этапе энергетического обмена в клетках животных.
А) расщепление гликогена до глюкозы
Б) полное окисление пировиноградной кислоты
В) поступление органических веществ в клетку
Г) гликолиз, образование 2 молекул АТФ
ВАГБ
В6. Установите последовательность процессов энергетического обмена
А) бескислородное расщепление глюкозы
Б) выделение продуктов обмена – углекислого газа и воды
В) синтез 36 молекул АТФ на кислородном этапе
Г) образование пировиноградной кислоты (ПВК)
Д) гидролиз высокомолекулярных органических соединений
ДАГВБ Часть С С1. Найдите ошибки в приведенном тексте. Укажите номера предложений, в которых сделаны ошибки, исправьте их.
1.В ходе энергетического обмена веществ в организме на подготовительном этапе происходит расщепление крупных молекул биополимеров до мономеров.
2. В результате первого этапа образуется две молекулы АТФ.
3. На втором этапе в реакциях гликолиза, которые протекают в эукариотической клетке, участие принимает кислород.
4. Завершается энергетический обмен образованием углекислого газа и воды, а также 36 молекул АТФ.
5. Последний этап протекает на мембранах пластид. Ошибки допущены в предложениях № 3 – в реакциях гликолиза кислород участия не принимает, № 4 – Энергетический обмен завершается образованием 38 молекул АТФ, а не 36. № 5. Последний этап протекает в митохондриях. С2. Почему появляются болезненные ощущения в мышцах после их работы?
В результате неполного окисления глюкозы (гликолиза) в условиях недостатка кислорода в мышцах накапливается молочная кислота, которая раздражает нервные окончания, тем самым вызывая болезненные ощущения.
stom.tilimen.org
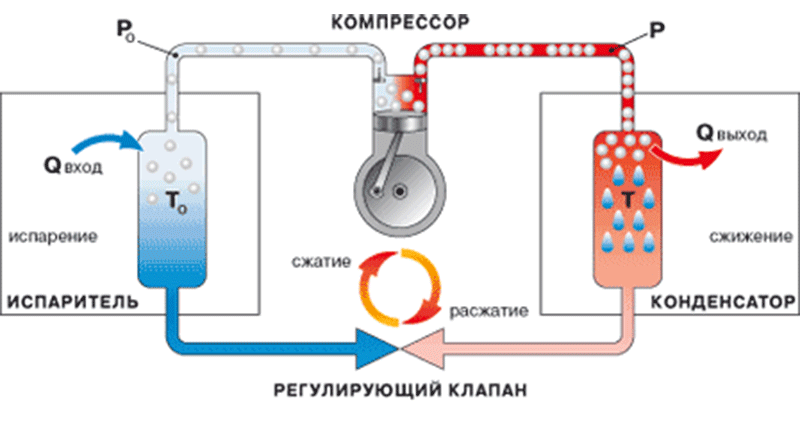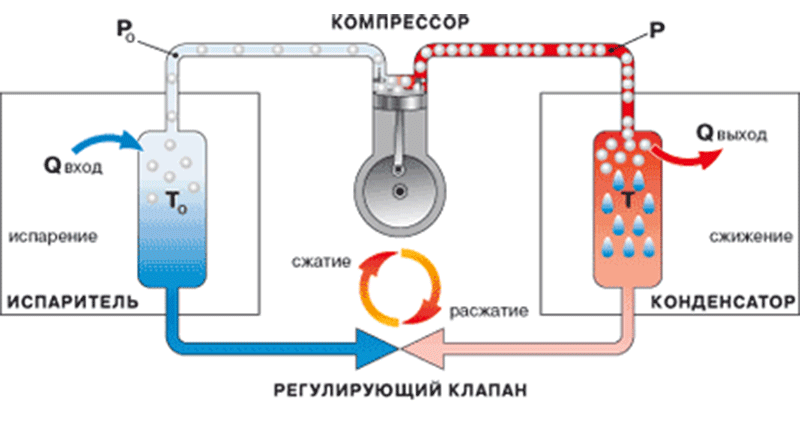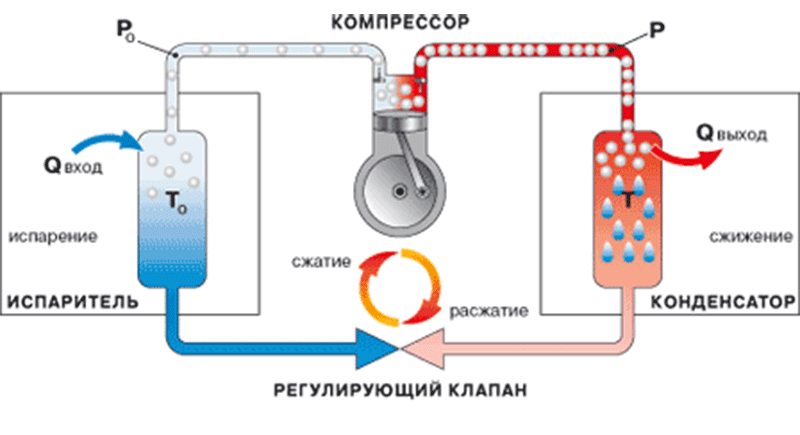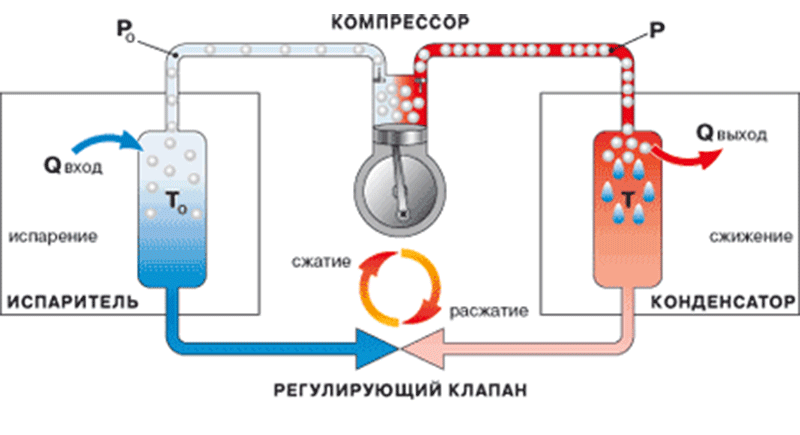
Удаление из воды кислорода и углекислого газа
Г. Овчинников
Растворенные в воде кислород и углекислый газ повышают скорость коррозии стали, особенно при повышенных температурах. Поэтому их положено максимально удалять из котловой воды и воды отопительных систем. В данной публикации предлагается обзор направленных на это современных способов водоподготовки
Котловые системы по их назначению принято подразделять на водогрейные и паровые, поэтому для каждого типа существует свой набор требований к очищенной воде, которые также зависят от мощности и температурного режима.
 Разработку официальных требований осуществляют надзорные органы, однако они всегда мягче рекомендаций производителя, устанавливаемых исходя из гарантийных обязательств. Кроме того, в европейском Союзе эти документы проходят всестороннюю экспертизу в органах стандартизации и профильных организациях с точки зрения эффективности и длительной эксплуатации котла. Поэтому целесообразно ориентироваться именно на рекомендации производителя.
Разработку официальных требований осуществляют надзорные органы, однако они всегда мягче рекомендаций производителя, устанавливаемых исходя из гарантийных обязательств. Кроме того, в европейском Союзе эти документы проходят всестороннюю экспертизу в органах стандартизации и профильных организациях с точки зрения эффективности и длительной эксплуатации котла. Поэтому целесообразно ориентироваться именно на рекомендации производителя.
Установка с зернистым редокситом для удаления кислорода из подпиточной воды пеллетных котлов Национального Ботанического сада им. Н.Н. Гришко
Все многообразие водно-химических режимов регламентируется Правилами технической эксплуатации, а также различными руководящими документами, относящимися к отдельным из перечисленных режимам. Только соблюдение правильного водного и химического режимов обеспечит надежную, безаварийную и долговечную работу котельного оборудования, наряду с системами теплоснабжения.
Вред растворенных в котловой воде газов
Также необходима нейтрализация свободной СО2 в оборотных конденсатах нагревательных систем.
Для удаления кислорода из питательной воды котлов можно использовать как физические, так и химические методы. Обычно их комбинируют, сначала — физические, затем химические методы.
Физические методы
К физическим методам относят применение деаэраторов, которые бывают термическими и вакуумными. Для деаэрации воды также разработаны электромагнитный, высокочастотный и ультразвуковой способы, а также пузырьковый азотный.
Наибольшее распространение в паровых и водогрейных котельных получил термический способ. Он основан на процессах, описанных в законе Генри. Согласно с ним, растворимость идеальных газов в воде при постоянной температуре и невысоком давлении прямо пропорциональна парциальному давлению данных газов над водой. Повышение температуры до уровня насыщения при данном давлении снижает до нуля парциальные давления газов над водой, следовательно, и растворимость газов в воде снижается до нуля. Вследствие нарушения равновесия в системе происходит выделение газов из воды (физическая десорбция).
Подбирая такие соотношения температуры и давления, при которых газы становятся практически нерастворимыми, можно почти полностью удалить их из воды.
За последние годы конструкции аппаратов для удаления газов были значительно улучшены. В настоящее время имеется несколько удачных типов деаэраторов, каждый из которых приспособлен для специальной цели. Существуют установки для деаэрации холодной воды без нагревания, дающие 15000 м3 в день и снижающие содержание кислорода до 0,22 мл/дм3. Вода в таком аппарате разбрызгивается по специальным лоткам камеры, находящейся под низким давлением. Газы могут удаляться паровыми эжекторами с холодильниками или вакуумными насосами.
В паровых котельных применяются в основном смешивающие десорберы атмосферного типа низкого избыточного давления. В таком аппарате струйки воды движутся вниз навстречу поступающему из парораспределительной камеры пару, и, соприкасаясь с ним, нагреваются до температуры кипения, в результате чего из воды выделяется растворенный в ней воздух.
В устройстве поддерживается давление 0,12 МПа, а вода нагревается до 104°C, т.е. до температуры кипения при этом давлении. Испарившаяся вода и воздух через штуцер направляются в теплообменник для подогрева воды, поступающей в аппарат. Номинальная производительность таких деаэраторов 25–300 т/ч.
В котельных с водогрейными котлами, где нет пара, используются вакуумные деаэраторы, в которых поддерживается давление около 0,03 МПа при температуре кипения около 69°C. Такое разрежение создается при помощи водоструйного эжектора.
Главным условием удаления газов из горячей воды является поддержание ее в тонкораспыленном состоянии (в течение достаточного времени) при температуре кипения, соответствующей давлению, при котором растворенные газы свободно выделяются в газообразную фазу. При простом типе открытого нагревателя питательной воды деаэратор, при нагреве до 88—93°C и свободном отводе газов в атмосферу, снижает концентрацию кислорода приблизительно до 0,3 мл/дм3.
Устройства для удаления кислорода для систем горячего водоснабжения для больших зданий и комплексов зданий устроены иначе. Воду нагревают под вакуумом так, чтобы температура кипения ее не превышала 60—80°C при помощи рядов змеевиков с греющим паром. Затем воду разбрызгивают вниз по тарелкам. Температура пара, поступающего в нижние змеевики, выше температуры воды, которая вследствие этого испаряется; пар увлекает выделившиеся газы через клапан, охлаждаемый входящей холодной водой. Конденсат из клапана стекает обратно, в тарелочную камеру, в то время, как газы выбрасываются вакуумным насосом или паровым эжектором.
если устройство помещается в подвале здания, то требуется циркуляционный насос для горячей воды, иногда его устанавливают в чердачных технических этажах здания, чтобы подача воды реализовывалась за счет естественной циркуляции. В таких условиях достигается концентрация кислорода 0,04 мл/дм3, что обеспечивает защиту системы от коррозии при температуре ниже 70°С.
В деаэраторах для котловой питательной воды осуществляется прямой контакт воды с паром. Чаще всего применяются аппараты тарелочного типа, работающие под давлением или вакуумом. Десорбер с распылением, работающий под небольшим давлением, широко применяется в котельных установках. В деаэраторе тарелочного типа холодная питательная вода проходит через холодильник, затем поступает в камеру, нагреваемую паром, где разбрызгивается на металлические тарелки. После этого вода стекает в резервуар для хранения. Пар наполняет все пространство, причем направление его движения таково, что он нагревает воду и удаляет выделяющиеся газы. Таким образом, можно достигнуть практически полного отсутствия кислорода в воде.
В более современной модели деаэратора происходит распыление воды в атмосферу пара при давлении приблизительно 0,1 кг/см2. Этот тип десорбера разработан для судовых котлов. Устройство состоит из холодильника, секции с паровым обогревом, деаэрационной секции, окружающей впуск пара, и секции для хранения деаэрированной воды, расположенной внизу аппарата. Холодная питательная вода проходит через холодильник, затем через распыляющие форсунки, поступает в камеру, обогреваемую паром, и снова через форсунки в деаэрационную камеру, а затем в водосборник. Пар входит в деаэрационную камеру под давлением 0,7 кг/см2 и подымается в холодильник, где выпускаются удаляемые газы, а теплота пара передается воде, поступающей в аппарат. Большая часть растворенного кислорода удаляется из воды при первоначальном ее нагревании; последние 5% кислорода удаляются значительно труднее. Для этого служит деаэрационная камера, которая обеспечивает практически полное удаление кислорода из воды.
Наиболее мощные деаэраторы удаляют также всю свободную двуокись углерода и частично — полусвязанную углекислоту и другие газы. При этом, вследствие отсутствия двуокиси углерода, рН воды увеличивается.
Существует безреагентная технология глубокого удаления кислорода для паровых и водогрейных систем, с использованием гидрофобных мембран в контакторах, что позволяет достигать глубокой степени очистки воды – до 1 мкг/дм3.
Применение десорбционных методов позволяет удалять газ до известного предела, недостаточного в ряде случаев по условиям использования воды. Кроме того, не всегда имеется возможность и необходимость включения в схемы сложных аппаратов для газоудаления. Поэтому на многих теплоэлектростанциях для обработки питательной и добавочной воды применяются химические методы связывания O2 и CO2 в вещества, являющимися безопасными в коррозионном отношении.
Химические методы
В основе химических методов удаления из воды растворенных газов лежит их химическое связывание, достигаемое введением реагентов или фильтрованием через специальные загрузки.
Для извлечения из воды кислорода применяют ее фильтрование через легко окисляющиеся вещества, например, стальные стружки, другие регенерируемые загрузки.
Степень удаления свободного кислорода для предотвращения коррозии котлов и сетей, зависит от температуры теплоносителя, объема воды.
Обычно при 70°, как это имеет место во многих системах ГВС, не требуется уменьшение содержания кислорода ниже 0,07 мл/дм3. Для паровых котлов, работающих под давлением ниже 17,5 кг/см2 (без экономайзеров) желательный предел не должен превышать примерно 0,02 мл/дм3. Для котлов высокого давления (или при применении экономайзеров) требуется практически полное отсутствие кислорода, т. е. ниже 0,0035 мл/дм3.
Содержание O2 в системах холодной воды при одноступенчатой аэрации достигает значения не более 0,2 мл/дм3, а при условии содержания кислорода менее 0,07 мл/дм3, применяется дополнительная обработка воды, выходящей из деаэратора, дозированием химических препаратов.
Существует много реагентов и их композиций под разными коммерческими названиями, которые могут быть использованы для нейтрализации кислорода. У каждого реагента есть свои положительные и отрицательные свойства и качества. Они будут рассмотрены ниже.
Самым распространенным реагентом для химического удаления кислорода из воды служит сульфит натрия Na2SO3 под разными фирменными названиями. Как в чистом виде, так и в виде каталитически активной формы. В качестве катализаторов используют оченьнебольшие количества меди или кобальта.
Рекомендуемые концентрации сульфита натрия у разных авторов значительно отличаются. Для удаления 1 кг кислорода требуется около 8 кг сульфита натрия, однако есть много рекомендаций по дозированию избыточного количества этого катализатора – от 2 до 40 мг/дм3 для конкретных котлов и режимов работы.
Обработка воды с помощью Na2SO3 основана на реакции окисления сульфита растворенным в воде кислородом:
2Na2SO3 + O2 = 2Na2SO4.
В этой реакции в качестве восстановителя выступает четырехвалентная сера S4+, которая отдает электроны кислороду, окисляясь до S6+.
Важным показателем процесса связывания кислорода является скорость реакции между сульфитом натрия и кислородом. Она зависит от температуры обрабатываемой воды и, в соответствии с законом действия масс, — от количества вводимого реагента.
Так, при температуре воды 40°C и дозировке стехиометрического количества сульфита натрия процесс завершается за 6—7 минут, при температуре 80°C время реакции составляет немногим более 1 минуты. При 70% избытке реагента, в соответствии с законом действия масс, реакция протекает до конца в течение 2 минут при любой температуре.
При температуре свыше 275°C (давление насыщения 6 МПа) сульфит натрия может разлагаться с образованием SO2 или h3S, что заметно увеличивает скорость коррозии оборудования пароконденсатного тракта.
Поэтому данный реагент может быть использован только для обескислороживания воды котлов среднего давления (3–6 МПа), испарителей и для подпиточной воды тепловой сети.
Раствор сульфита натрия концентрацией 3–6% готовят в баке, защищенном от контакта с атмосферой, и затем, с помощью дозатора, вводят в обрабатываемую воду с некоторым избытком против стехиометрического количества.
Однако передозировка реагента во много раз повышает электропроводность котловой воды (содержание солей), а также шламообразование, возможны проблемы в связи с образованием пены в котловой воде.
Сульфитирование просто в осуществлении, не требует громоздкой и дорогой аппаратуры. Недостатком данного метода является то, что оно увеличивает сухой остаток в количестве 10–12 мг/дм3 на 1 мг/дм3 растворенного кислорода.
Разработана и применяется оригинальная эффективная технология по удалению O2 из воды с применением зернистого фильтрующего материала, изготовленного на основе синтетических ионитов макропористой структуры, в которую встраиваются активные центры металлов, в частности, двухвалентного железа.
В процессе фильтрации воды через слой загрузочного материала окисление растворенным кислородом переводит закисные формы железа (FeO) в двойной оксид железа (FeO•Fe2O3nh3O) или в полутораокиси (Fe2O3•nh3O).
Сущность технологического процесса заключается в применении сорбента, имеющего достаточно высокую емкость поглощения по кислороду (т.е. представляющего собой редоксит в восстановленной форме). В качестве такого сорбента использован ионитный комплекс с переходным металлом, введенным в фазу ионита.
При этом процесс химического поглощения кислорода можно представить в виде следующего уравнения:
4RMe(ОН)n + О2 + 2h3O →4RMe(OH)(n+1),
где R – нерастворимый в воде сложный радикал ионита;Ме – переходной металл.
По мере фильтрации воды через слой редоксита все большая его часть будет переходить в окисленную форму и, наконец, способность к дальнейшему поглощению кислорода будет полностью исчерпана. По истечению рабочего цикла Redox-фильтра истощенный сорбент подвергается регенерации.
Регенерация представляет собой процесс восстановления поглотительной способности редоксита путем пропуска через слой, например, тиосульфата натрия:
RMe(ОН)n + 2h3O →4RMe(OH)(n-1),
где R – нерастворимый в воде сложный радикал ионита;Ме – переходной металл.
Перед пропуском регенерационного раствора редоксит необходимо взрыхлять обратным током воды. После его отмывают от избытка реагента и продуктов регенерации.
Для барабанных котлов высоких и сверхвысоких давлений применяется гидразин в форме гидразин-гидрата или гидразин-сульфата, которые энергично взаимодействуют с кислородом, окисляясь в итоге до воды и азота, т.е. не повышая солесодержания воды:
N2h5·h3O + O2 = 3h3O + N2.
Гидразин-гидрат можно успешно применять для обработки питательной воды как барабанных, так и прямоточных котлов (он не повышает сухого остатка воды), в то время как гидразин-сульфат — только для обработки питательной воды барабанных котлов (он несколько увеличивает сухой остаток).
Скорость реакции зависит от температуры, pH среды, избытка гидразина, в соответствии с законом действия масс, а также присутствия катализаторов. При температуре менее 30°C гидразин практически не взаимодействует с O2, но при 105°C, pH = 9–9,5 и избытке гидразина около 0,02 мг/дм3 время практически полного связывания кислорода составляет несколько секунд.
Гидразин вводится в воду в виде 0,1–0,5% раствора с избытком против стехиометрического количества с учетом того, что часть его расходуется на восстановление высших оксидов железа и меди из отложений на трубах.
Гидразин-сульфат может применяться при любых давлениях, однако наиболее целесообразно использовать его только при давлении 70 кгс/см2 и выше, а при низком давлении лучше применять сульфит натрия вследствие его меньшей стоимости.
Расчет дозы гидразина g (мкг/кг) в пересчете на Nh5рекомендуется производить по формуле:
g=С1+0,35С2+0,15С3+0,25С4+40,
где С1 — концентрация кислорода в питательной воде до ввода гидразина, мкг/кг;С2 – концентрация нитритов в питательной воде до ввода гидразина, мкг/кг;С3 – концентрация железа в питательной воде, мкг/кг;С4 – концентрация меди в питательной воде, кг/кг.
Концентрация гидразина в рабочем растворе С (мг/кг) рассчитывается по формуле:
С = D/DH,
где D – расход питательной воды, т/ч;DН – средняя (регулируемого диапазона) подача насоса-дозатора, л/ч.
При приготовлении рабочего раствора гидразин-сульфата, последний должен быть нейтрализован едким натром. его количество, необходимое для нейтрализации, y (кг) рассчитывается по формуле:
у=0,62у1+0,04ЩVб,
где у1 – количество загружаемого гидразинсульфата, кг;Щ – щелочность по фенолфталеину воды, используемой для приготовления рабочего раствора, мг-экв/кг;Vб – объем бака, м3.
В котловой воде и в пароперегревателях избыток гидразина разлагается с образованием аммиака:
3N2h5 = 4Nh4 + N2.
При организации гидразинной обработки воды следует учитывать, что гидразин является высокотоксичным и канцерогенным веществом, при концентрации выше 40% он горюч, поэтому должны предусматриваться специальные строгие меры безопасности.
Для связывания кислорода в котловой воде могут применяться и другие органические и неорганические соединения. Например гидрохинон (парадиоксибензол), пирогаллол (несимм-триоксибензол), изоаскорбиновая кислота, карбогидразин, N, N-диэтилгидроксиламин (ДЭГА). Их применение регламентируется рекомендациями производителя конкретного оборудования.
Все вышеперечисленные химические соединения могут входить в рецептуру многих комплексных фирменных составов для обработки котловой воды и внутрикотловых поверхностей.
Углекислота, поступающая в пароводяной цикл через различные воздушные неплотности оборудования, а также и за счет разложения карбонатов солей (в добавочной воде), приводит к понижению рН воды. Это, в свою очередь, усиливает процессы коррозии за счет взаимодействия водородных ионов с металлом, а также за счет снижения защитных свойств окисной пленки на поверхности металла. Вследствие этого углекислота всегда является фактором усиления коррозии.
Для предотвращения углекислотной коррозии оборудования конденсатно-питательного тракта ТЭС с барабанными котлами применяется способ связывания свободной углекислоты путем ввода в конденсат турбин или питательную воду щелочного реагента – водного раствора аммиака. Основной задачей такой обработки является повышение pH воды и конденсата на участках пароводяного тракта, что надежно обеспечивает защиту оборудования от коррозии с водородной деполяризацией.
Дозировка аммиака определяется его количеством, необходимым для связывания диоксида углерода в гидрокарбонат аммония. Небольшой избыток Nh4 сверх этого количества образует уже карбонат аммония и повышает pH воды до значений выше 8,5:
Nh4 + h3O + CO2 = Nh5HCO3,Nh5HCO3 + Nh4 = (Nh5)2CO3.
Из приведенных уравнений следует, что для связывания 1 мг/дм3 CO2 достаточно 0,26 мг/дм3 аммиака.
Аммиак обычно вводится в обрабатываемую воду в виде 1–5% раствора Nh5OH с помощью насосов-дозаторов, автоматизированных по расходу воды. При концентрации свободной углекислоты в воде или паре свыше 8 мг/дм3 применение аммиака обычно недопустимо, так как может протекать коррозия медных сплавов (латуни), применяющихся для изготовления оборудования конденсатно-питательного тракта.
Разработан и применяется комбинированный гидразино-аммиачный режим,который характеризуется вводом в теплоноситель (в основном в питательную воду) аммиака в целях повышения рН воды и нейтрализации воздействия углекислоты, а также вводом гидразина с целью снижения содержания остаточного кислорода после деаэраторов питательной воды. Благодаря воздействию высокого значения рН, замедляются коррозионные процессы стали и медных сплавов. Однако аммиак, помимо способности к повышению рН аминируемой воды, обладает также способностью специфического коррозионного воздействия на медные сплавы. Поэтому доза аммиака при введении гидразино-аммиачного режима ограничивается поддержанием в питательной воде содержания аммиака на уровне, не превышающем 1 мг/дм3.
Больше важных статей и новостей в Telegram-канале AW-Therm. Подписывайтесь!
Вам также может понравиться
aw-therm.com.ua
Известковая вода и углекислый газ
Человеку вода нужна как в быту, постоянно, так и на производстве. Даже если само производство воды не касается, то людей, которые это производство обслуживают нужно и кормить, и поить, и мыться им тоже нужно где-то. Потому представить себе жизнь человека без использования воды, сегодня невозможно, а вот представить себе человека, который каждый день использует в пищу известковую воду очень даже. Проблема эта решаема! Но далеко не все пока стремятся этот недостаток воды устранить.
Нежелание умягчать воду – истоки
История с водой началась не недавно. Потребители далеко не все стремятся мгновенно устанавливать у себя умягчающие аппараты, хоть и понимают вред от известковой воды. С таким положением вещей производители умягчающих установок борются не первый год. Просвященность населения растет, но поскольку такой прибор не является прибором первой необходимости, то и потребности в нем в кризис, не испытывают.
Какую воду можно считать жесткой, а какая под это понятие не подходит. Ниже представлена таблица ранжирования видов воды, в зависимости от количества углекислого газа и размера примесей солей жесткости. Причем соотношение кальция и магния в такой воде совершенно безразлично, вода все равно будет считаться известковой, даже если одной соли в ней будет 0,000001, а другой 0,9999999. Причем и устранение излишков не подразумевает направленность методов на вычитание из состава воды только одного вида соли.
Таблица 1. Показатель известковой воды в эквиваленте миллиграмм на литр
| Степень известковости | Параметр миллиграмм/экв-л. |
| Мягкая Известковая Очень известковая | До 5 6-9 10-12 |
Такое разделение является примерным. Некоторые специалисты выделяют еще слабо жесткую воду с параметрами от 5 до 7. Кстати такая вода может встречаться в центральной системе водоснабжения. Но показатель семь уже означает, что на стенках посуды оборудования будет образовываться вредный осадок.
Что еще сдерживает потребителей от приобретения нужных фильтров для очистки известковой воды, кроме стоимости их и необходимости экономить в кризис. Здесь выходит на передний фон медленная достаточно реакция организма на углекислый газ. Что собственно человека может заставить совершить траты?
- Определенная выгода;
- Угроза здоровью;
- Поломки дорогих приборов.
Все три причины вполне применимы к работе известковости, только вот работают эти причины не всегда достаточно стимулирующее. Понимая даже угрозу своему организму, потребитель далеко не всегда может проголосовать в сторону приобретения прибора-умягчителя. Больше всего он переживает о своих сиюминутных тратах. И если вода слишком известковая, то поломка бытового прибора без защиты не заставит долго себя ждать.
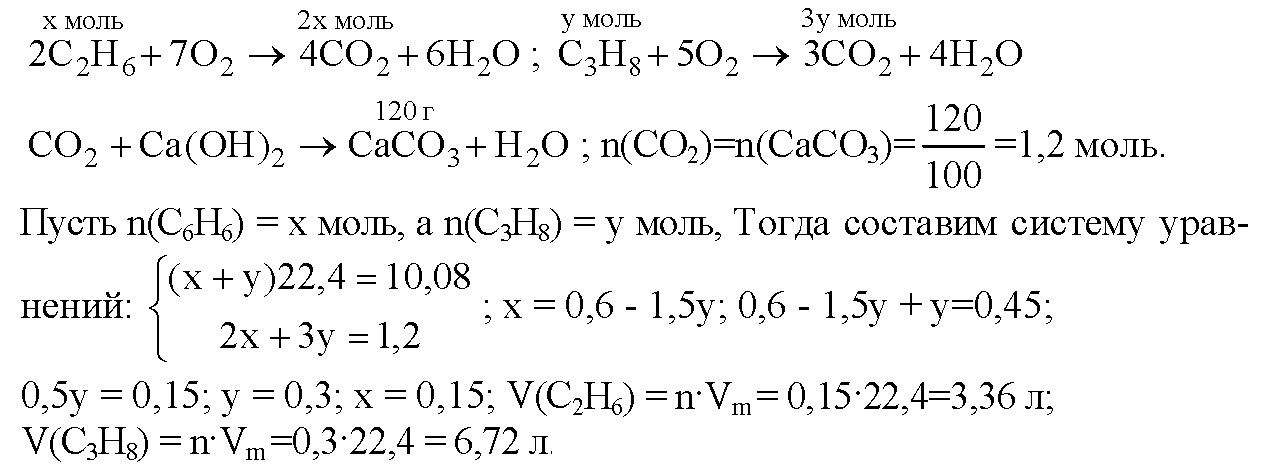
Второй момент, важный для потребителя, более экономный расход воды – она ведь тоже сегодня не дешевая, а при использовании мягкой воды и воды идет меньше на ту же стирку, и средств для стирки тоже используется меньше.
Известь в воде приводит к ряду проблем. Одна из них, это помутнение воды. Более всего расстраивает потребителя, да и промышленность – образование налета на стенках оборудования. В случае с личным потреблением этот налет образовывается везде, абсолютно. В том числе и на поверхностях внутренних органов. Некачественная вода является причиной появления углекислого газа и образования камней и песка в органах человека.
И если организму все равно, проводит тепло или нет известковый осадок, то для оборудования, которое греет воду, это крайне важно. Задача теплогрейного оборудования быстро анагреть воду до определенной температуры. Если оно работает с известковой жидкостью, то очень быстро на стенках образуется определенный блокирующий налет. Изоляционные свойства углекислого газа не дают возможности греть воду, как и раньше. Многие спрашивают, почему происходит помутнение известковой воды при контакте с углекислым газом? Чем больше нарастает осадок на поверхностях, тем хуже вода греется и тем больше тепла остается внутри поверхностей или нагревательного элемента. И каким бы ни бил закаленным металл, из которого производят прибор, долго перегревы он не выдержит. Результатом таких атак станет перегорание прибора. Без возможности восстановления зачастую. Чем не аргумент для потребителя приобрести подобное устройство защиты.
К тому же работа с мягкой водой приятнее и волосам, и коже. Не будет сухости, выпадания. Мыло будет лучше мылиться, да и для того, чтобы его смыть потом с кожи, понадобиться меньше воды.
Некоторые люди склонны покупать мягкую питьевую воду. Так они надеются защитить хотя бы свой организм от плохой воды. Но ведь в этом случае хорошая вода попадает только во внутрь, а купаться человек продолжает в некачественной воде, да и вся система тепло и водоснабжения остается, как старушка с корытом, со своей известковой водой и углекислым газом. Так, что покупка специальной питьевой воды только расходов добавляет, но проблему в сути ее не решает, увы.
Осторожность при работе с известковой водой!
К минералам, образующим известковость в воде следует относиться осторожно. Не все с ними так однозначно. Сегодня, наверное, даже ребенок скажет, что кости образует такой минерал, как кальций. Вот он то и является одной из составляющих частей известковости. И тут крайне важно соблюдать норму. Тоже самое относится и к магнию. Человек не должен злоупотреблять такими минералами в воде. Но и дефицит своему организму он тоже не должен устраивать.
Соли кальция являются основными для костей, зубов. Любой вывих при дефиците кальция в организме может обернуться закрытым переломом. И виной тому хрупкие кости. Вырастить роскошную шевелюру и иметь крепкие ногти при потреблении бедной на кальций воды невозможно.
Точно также сохранить здоровье не получится, если использовать воду с избыткой извести. Тогда пойдет обратная реакция и внутри организма начнут образовываться солевые центры, которые потом при выведении из организма могут доставлять адские боли или же совсем порежут каналы, соединяющие почки и мочеполовую систему.
Дефицит магния относится немного к другим жизненно важным системам организма. Только вот на кости наличие углекислого газа тоже влияет, тем более, что это естественные соли, а не синтетически созданные. Но более всего от отсутствия магния страдает нервная система. Магний влияет на баланс в организме. При его дефиците человек становится чрезвычайно раздражительным и нервным без причины. Да и на состояние мышц магний тоже влияет. Потому крайне важно правильно умягчать воду, и неконтролируемо ничего не делать.
Кстати, подобные ограничения очень хорошо показывают претензии, которые на сегодня предьявляются врачами к мембранным фильтрам, как варианту борьбы с жесткостью. Мембранный прибор хорош для промышленности более чем. Он выдаст воду, с такими показателями какие ему зададут. Главное мембрану правильную установить.
Оставляет разве только растворенные газы. Но в этом и главная незадача. Слишком. Все очень слишком. Получается, что вместе с плохим, уходит и хорошее. И это делает воду дистиллированной, и значит бедной в сравнении с нормальной мягкой водой. В связи с этим мембранные фильтры снабжают кондиционерными установками для восстановления минеральных солей. Но врачи считают, что такие привнесенные соли намного хуже человеческим организмом воспринимаются. Потому советуют хотя бы смешивать известковую воду и очищенную, для достижения баланса, хотя бы минимально.
У мембранного устройства есть еще минусы, которые правда успешно нивилируются качеством получаемой воды. Во-первых, когда вода очищается в этом приборе, то очень большой объем воды задерживается внутри прибора и в дренаж от этого объема сливается больше половины, то есть очень большой отход при производстве хорошей воды. Потому мембранные приборы устанавливают под мойку, чтобы уловить карбонатную жесткость, ведь вода себе неспешно умягчалась, не задерживая при этом остальной поток.
Отходы не такие вредные, как при смоляной обработке. Но слишком много воды с собой они забирают. Но для квартиры такой прибор считается одним из лучших для получения питьевой воды.
Есть еще кувшин-очиститель. Он переносной, компактный, удобный. Но большого объема питьевой воды не произведет. Для этого нужно врезать в систему смоляной катионный фильтр в магистральном виде. Кувшин же без посторонней помощи чистит воду, просто пропуская ее через картридж с ионообменной смолой. При контакте ионы сменяют друг друга и происходит помутнение. В кувшине остается обогащенная, натриевыми солями вода с нормальным порогом жесткости. Если его нужно еще понизить, то можно просто еще раз залить эту же воду на очистку.
Но смола быстро вымывается. Для получения питьевой воды ее нужно поменять. Стоит такой картридж примерно треть стоимости прибора. То есть сам прибор дешевый, а вот замена постоянная картриджей стоит недешево. Но это нужно делать обязательно, т.к. если этого не сделать, произойдет помутнение воды. Об этом очень многие потребители забывают. Заморочки с заменами и перекрытием углекислого газа доставляют потребителю неудобства.
Нет таких недостатков у электромагнитного устройства. Вот для обработки всей воды, поступающей в квартиру такой прибор является самым удобным. И вода вся проходит абсолютно, никаких дренажей и сливов, и менять что-то не надо. Крайне удобно. Поставил и мойся, купайся, стирай. Все оборудование находится под надежной защитой.
filtryvodi.ru