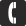Диоксид углерода: формула, свойства и области применения. Co2 это
CO2 Meter - CO и CO2
CO - окись углерода и CO2 - двуокись углерода часто путают. Имена звучат одинаково, оба они бесцветные и без запаха газов, и при высоких концентрациях оба могут быть смертельными. Разница заключается в том, что CO2 является общим природным газом, необходимым для всей растительной и животной жизни. CO не является обычным явлением. Чаще всего это побочный продукт кислородно-голодного сжигания топлива.
СМИ часто добавляют в замешательство. Раньше мы слышали рассказы о самоубийстве, вставляя садовый шланг в выхлопную трубу и окно автомобиля, а затем запустили мотор до тех пор, пока СО (угарный газ) не запустил пассажира автомобиля. Сегодня нам говорят, что выхлопная труба нашего автомобиля является основным источником «смертельного» парникового газа CO2. Легко понять, почему они смущены.
Полезно понять сходства и различия между CO и CO2:
О окиси углерода
- СО образуется естественным образом в следовых количествах частичнымокисление метана ватмосферы, вулканов и лесных пожаров
- CO образуется на опасных уровнях путем сжигания кислородом в ненадлежащих вентилируемых устройствах для сжигания топлива, таких как масляные и газовые печи, газовые водонагреватели, газовые печи, газовые или керосиновые обогреватели, камины и дровяные печи
- CO производится на опасных уровнях двигатель внутреннего сгорания что DO НЕ использовать каталитический нейтрализатор
- Это самый распространенный тип смертельного отравления в мире
Рекомендуемые уровни СО
- 0.1 ppm - текущий средний уровень СО на планете
- OSHA ограничивает долгосрочные уровни воздействия на рабочем месте до 50 ppm (частей на миллион)
- Симптомы легкого отравления CO включают головные боли и головокружение при концентрациях менее 100 ppm
- Концентрации вплоть до 700 ppm могут быть опасными для жизни
О углекислом газе
- CO2 - общий газ в атмосфере и необходим для жизни растений
- CO2 является естественным побочным продуктом дыхания человека и животных, ферментации, химических реакций и сжигания ископаемых видов топлива и древесины
- CO2 является негорючим
- CO2 генерируется двигателями внутреннего сгорания, которые DOиспользовать каталитический нейтрализатор
- Отравление CO2 редко; однако аквалангисты должны следить за этим (изгибы)
- Утечка емкостей CO2 под давлением в закрытых помещениях может быть опасна для пассажиров - как с высоким уровнем CO2, так и с относительно низкого уровня кислорода (смещение)
Рекомендуемые уровни CO2
- 400 ppm - текущий средний уровень CO2 на планете
- ASHRAE рекомендует предел 1,000 ppm для офисных зданий и классных комнат
- OSHA ограничивает долгосрочные уровни воздействия на рабочем месте до 5,000 ppm
- Сонливость может возникать при 10,000 ppm - распространенная в закрытых автомобилях или аудиториях
- Симптомы мягкого отравления CO2 включают головные боли и головокружение при концентрациях менее 30,000 ppm (3%)
- При 80,000 ppm (8%) CO2 может быть опасным для жизни
Каковы сходства между CO и CO2?
- Углерод и кислород объединяются для образования обоих газов
- Оба бесцветные, безвкусные и без запаха
- Оба находятся в воздухе по всему миру (хотя и в разных концентрациях)
- Оба выпускаются во время горения или пожара
Понимание PPM - частей на миллион
Части на миллион (ppm или ppmv) - это то, как ученые измеряют небольшое количество молекул газа в воздухе, поскольку количество молекул газа в объеме значительно меньше 1%. Вместо того, чтобы говорить «1% газа по объему», ученые скажут «10,000 ppmv» (10,000 / 1,000,000 = 1%) или сократят его до«10,000 ppm».
Например, проще написать, что уровень CO2 в комнате вырос с 400 ppm до 859 ppm, чем для записи уровня CO2, с 0.04% до 0.0859%. Однако оба они верны.
Подробнее о частях на миллион здесь.
Как монооксид и диоксид получили свои имена
Вы можете поблагодарить древних греков за то, что они дали нам свои имена для цифр:
• mono = 1• di = 2• tri = 3• tetra = 4• penta = 5• hexa = 6• hepta = 7• octa = 8• ennea = 9• deca = 10
Так мы получаем английские слова как триугол (стороны 3), СШАPentagon (одностороннее 5) или декаthlon (конкурсы 10). Итак, первая половинамоноxide означает атом кислорода 1, а первая половинаdiоксид означает атомы кислорода 2.
Для второй половины слова мы имеем окись, Оксид - это название простого соединения кислорода с другим элементом или группой. Например, добавьте кислород к элементу водорода, и вы получите водородный диокись (h30) или воды. Другие оксиды, о которых вы, возможно, слышали, - это закись азота (NO2 - смеющийся газ) или оксид цинка (ZnO - активный ингредиент в солнцезащитном креме).
Источник: Википедия
ru.co2meter.com
CO2 название вещества
Диоксид углерода 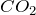 или углекислый газ (CO2 название вещества) при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.Химически
или углекислый газ (CO2 название вещества) при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.Химически 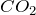
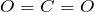 . С сильными восстановителями при высоких температурах
. С сильными восстановителями при высоких температурах 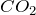 проявляет окислительные свойства. Углем он восстанавливается до угарного газа:
проявляет окислительные свойства. Углем он восстанавливается до угарного газа: ![Rendered by QuickLaTeX.com \[CO_2 + C \rightarrow 2CO (1000^{0}C).\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1630a023b026911360bd4a6a2d76fde0_l3.png)
Магний, зажженный на воздухе, продолжает гореть и в атмосфере 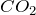 :
:
![Rendered by QuickLaTeX.com \[CO_2 + 2Mg \rightarrow 2MgO + C.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cc9a8ed24d2c86327c4049f97934aa41_l3.png)
Углекислый газ проявляет кислотные свойства: реагирует со щелочами, гидратом аммиака. Восстанавливается водородом.
![Rendered by QuickLaTeX.com \[CO_2 + NaOH_dilute \rightarrow NaHCO_3;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d61c4265649d62b0c2c4149f0d25fc74_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + NH_3\cdotH_2O \rightarrow NH_4HCO_3;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c378463792f769703aca9da6e75e6432_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + 4H_2 \rightarrow CH_4 + 2H_2O (200^{0}C, kat = Cu_2O).\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-512d5869c863fd2a4436a6db270c7e65_l3.png)
В лабораториях диоксид углерода обычно получают, действуя на мрамор 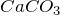 соляной кислотой в аппарате Киппа:
соляной кислотой в аппарате Киппа:
![Rendered by QuickLaTeX.com \[ CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2_gas.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ecb25e3841d9bd6cb60baa8bda8d2ffa_l3.png)
В промышленности большие количества диоксида углерода получают при обжиге известняка:
![Rendered by QuickLaTeX.com \[ CaCO_3 \rightarrow CaO + CO_2_gas.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5325e0bec88e95b91b0f89dfde58f771_l3.png)
Углекислый газ играет важную роль в биологических (фотосинтез), природных (парниковый эффект) и геохимических (растворение в океанах и образование карбонатов) процессах. В больших количествах он поступает в окружающую среду в результате сжигания органического топлива, гниения отходов и т.д.
ru.solverbook.com
Оксид углерода(IV) - это... Что такое Оксид углерода(IV)?
| _ | |
| Другие названия | углекислый газ, двуокись углерода,сухой лёд(твердый) |
| Формула | CO2 |
| Молярная масса | 44,0095(14) г/моль |
| В твердом виде | сухой лёд |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Плотность и фазовое состояние | 1,9769 кг/м³, при н.у.;771 кг/м³, жидкий;1512 кг/м³, твёрдый |
| Растворимость в воде | 1,45 кг/м³ |
| Удельная теплоемкость | 0,846 кДж/(кг*С) при 27 °C |
| Удельная теплота плавления | 25,13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6,35 и 10,33 |
| Вязкость | 0,07 пз при −78 °C |
| Форма молекулы | линейная |
| Кристаллическая решётка | молекулярная |
| Дипольный момент | ноль |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | |
| R-phrases | R: As, Fb[источник не указан 1315 дней] |
| S-phrases | S9, S23, S36 (ж) [источник не указан 1315 дней] |
| RTECS number | FF6400000 |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Оксиды | COC3O2стандартных условиях (25 °C, 100 кПа)Infobox disclaimer and references |
Оксид углерода(IV) (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %.[1]
Не следует путать с Диоксином.
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Свойства
Физические
Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом ) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен[источник не указан 60 дней], но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Однако недостаток углекислого газа тоже опасен (см. Гипокапния)[источник не указан 60 дней].
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя. Смесь полученных газов, промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната, чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его, таким образом, отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
Жидкая углекислота широко применяется в системах пожаротушения, в огнетушителях и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании, а также для накачивания шин/камер велосипедных колес.[источник не указан 85 дней].
Когда углекислота применяется в газовой фазе, то для хранения она используется под давлением, как сжиженный газ, в виде жидкой фазы. Хранение углекислоты в баллоне в сжиженном состоянии намного выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру 31°С. Когда в 40-литровый баллон с нормальным давлением 100 кгс/сm² залито 30 кг сжиженного углекислого газа, то при температуре 31°С в баллоне будет только жидкая фаза с давлением 100 кгс/сm². Если температура будет выше, то следует уменьшить заполнение баллона или использовать баллоны с более высоким рабочим давлением. Если углекислота будет охлаждаться, то при температуре 21°С при нормальном заполнении в баллоне появиться газовая фаза.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле и т.д.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Углекислый газ в природе
Изменения концентрации атмосферного углекислого газа (кривая Килинга). Измерения в обсерватории на горе Мауна-Лоа, Гавайи.Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемых топлив (угля, нефти, газа), заметно увеличивающееся в зимний сезон[2].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность
Углекислый газ является тяжелым, по сравнению с воздухом, газом без цвета и запаха. Воздействие его повышенных концентраций на живые организмы относит его к удушающим газам (англ.)русск.. Незначительные повышения концентрации до 2-4% в непроветриваемых помещениях приводят к развитию сонливости и слабости. Опасными концентрациями считаются уровни 7-10%, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потери сознания в течение периода времени от нескольких минут до одного часа.[3] Отравление этим газом не приводит к долговременным последствиям и после его завершения происходит полное восстановление организма.[4]
Интересные факты
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[5]
- Бо́льшая, по сравнению с человеком, чувствительность других животных к изменениям концентрации этого газа использовалась в качестве естественного детектора опасных концентраций этого газа. Повышенная чувствительность к углекислоте канареек использовалась шахтерами для определения начала скопления этого газа под землей.
- В результате обычного функционирования организма каждого человека в среднем в течение одного дня образуется 1 кг углекислого газа (300 гр углерода).[6]
См. также
Примечания
- ↑ Trends in Carbon Dioxide
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. (1967). «Carbon Dioxide Tolerance Studies». Brooks AFB, TX School of Aerospace Medicine Technical Report SAM-TR-67-77. Проверено 2008-05-02.
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
- ↑ (англ.) How much carbon dioxide do humans contribute through breathing?.(недоступная ссылка — история) Проверено 30 апреля 2009.
Литература
- Вукалович М.П., Алтунин В.В., Теплофизические свойства двуокиси углерода, Атомиздат, Москва, 1965. 456 с.
- Тезиков А.Д., Производство и применение сухого льда, Госторгиздат, Москва, 1960. 86 с.
- Гродник М.Г., Величанский А.Я., Проектирование и эксплуатация углеслотных установок, ″Пищевая промышленность″, Москва, 1966. 275 с.
- Талянкер Ю.Е., Особенности хранения баллонов со сжиженным газом, Журнал "Сварочное производство", №11, 1972, Москва.
Ссылки
dic.academic.ru
CO2 какой это оксид
Диоксид углерода 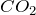 или углекислый газ при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.Химически
или углекислый газ при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.Химически  инертен, что обусловлено высокой энергией связи
инертен, что обусловлено высокой энергией связи 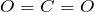 . С сильными восстановителями при высоких температурах
. С сильными восстановителями при высоких температурах  проявляет окислительные свойства. Углем он восстанавливается до угарного газа:
проявляет окислительные свойства. Углем он восстанавливается до угарного газа:
![Rendered by QuickLaTeX.com \[CO_2 + C \rightarrow 2CO (1000^{0}C).\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1630a023b026911360bd4a6a2d76fde0_l3.png)
Магний, зажженный на воздухе, продолжает гореть и в атмосфере  :
:
![Rendered by QuickLaTeX.com \[CO_2 + 2Mg \rightarrow 2MgO + C.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cc9a8ed24d2c86327c4049f97934aa41_l3.png)
Углекислый газ проявляет кислотные свойства (CO2 какой это оксид): реагирует со щелочами, гидратом аммиака. Восстанавливается водородом.
![Rendered by QuickLaTeX.com \[CO_2 + NaOH_dilute \rightarrow NaHCO_3;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d61c4265649d62b0c2c4149f0d25fc74_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + NH_3\cdotH_2O \rightarrow NH_4HCO_3;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c378463792f769703aca9da6e75e6432_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + 4H_2 \rightarrow CH_4 + 2H_2O (200^{0}C, kat = Cu_2O).\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-512d5869c863fd2a4436a6db270c7e65_l3.png)
В лабораториях диоксид углерода обычно получают, действуя на мрамор 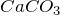 соляной кислотой в аппарате Киппа:
соляной кислотой в аппарате Киппа:
![Rendered by QuickLaTeX.com \[ CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2_gas.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ecb25e3841d9bd6cb60baa8bda8d2ffa_l3.png)
В промышленности большие количества диоксида углерода получают при обжиге известняка:
![Rendered by QuickLaTeX.com \[ CaCO_3 \rightarrow CaO + CO_2_gas.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5325e0bec88e95b91b0f89dfde58f771_l3.png)
Углекислый газ играет важную роль в биологических (фотосинтез), природных (парниковый эффект) и геохимических (растворение в океанах и образование карбонатов) процессах. В больших количествах он поступает в окружающую среду в результате сжигания органического топлива, гниения отходов и т.д.
ru.solverbook.com
Что такое двуокись углерода — CO2

Углекислый газ (CO2) - это соединение находящееся, как правило, в виде газа, которое является более плотным, чем воздух.
Диоксид углерода состоит из атома углерода и двух атомов кислорода. Это бесцветный газ.
 Уровень выбросов CO2 достиг нового рекорда, 142% от доиндустриальной эпохи
Уровень выбросов CO2 достиг нового рекорда, 142% от доиндустриальной эпохи
Количество углекислого газа в воздухе значительно возросло за последние годы, и это одна из основных причин, которые приводят к глобальному потеплению. Почти всё вокруг нас выделяет или использует CO2. Растения, сжигание топлива, использование продуктов питания и напитков, само человеческое тело и многое другое.
Наш организм нуждается в небольшом количестве углекислого газа, чтобы жить. Это соединение контролирует частоту сердечных сокращений, а также другие жизненно важные функции в организме. Однако, если мы вдохнем слишком большое количество CO2, нам станет плохо, мы даже можем задохнуться или впасть в кому.
Человек поглощает кислород из воздуха, которым дышит. Кислород поступает в кровь, к легким, к другим органам и тканям тела, затем превращается в двуокись углерода и, наконец, выделяется наружу при выдохе. CO2 отвечает за потребность человека дышать.
Растения также нуждаются в углекислом газе. Зеленые растения поглощают углекислый газ из воздуха через поры листьев. Вступая в реакцию с водой и солнечным светом, производятся питательные вещества, которые служат строительным материалом для растений. Образующийся при этом кислород выделяется в воздух.
Из воздуха растения поглощают углекислый газ, который затем трансформируют и выделяют кислород, в то время как люди и животные поглощают кислород и выделяют углекислый газ. Этот процесс помогает поддерживать баланс между кислородом и CO2 в воздухе.
Двуокись углерода имеет множество применений, одним из наиболее известных является газификация напитков.
Источник: ecomagazin.ro
Если вам понравился этот материал, то предлагаем вам подборку самых лучших материалов нашего сайта по мнению наших читателей. Подборку - ТОП об экологически безопасных технологиях, новой науке и научных открытиях вы можете найти там, где вам максимально удобно ВКонтакте или В Фейсбуке Если у вас неправильно отображается страница, не воспроизводится видео или нашли ошибку в тексте, пожалуйста, нажмите сюда.ecology.md
формула, свойства и области применения :: SYL.ru
Диоксид углерода (углекислый газ) - часто встречающееся в природе соединение. Оно образуется при окислении различных органических веществ. Наиболее часто встречающиеся процессы образования этого соединения - гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.
Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
Формула
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так:
Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде – в одном литре воды при 20 ⁰С растворяется около 0,88 л CO2. Небольшое понижение температуры кардинально меняет ситуацию – в том же литре воды при 17⁰С может раствориться 1,7 л CO2. При сильном охлаждении это вещество осаждается в виде снежных хлопьев – образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации - угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.
В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + h3O;
NaOH + CO2 = NaHCO3.
Угольная кислота и раствор СО2
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
CO2 + h3O ↔ h3CO3.
Равновесие довольно сильно сдвинуто влево – лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура – тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.
Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н+ и соединения НСО3- . В очень небольшом количестве образуются ионы СО3-.
Угольная кислота – двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные – гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Ca(OH)2 + CO2 = CaCO3↓ + h3O.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение – карбонат кальция превращается в растворимое вещество – гидрокарбонат кальция. Реакция протекает по такому пути:
CaCO3 + h3O + CO2 = Ca(HCO3)2.
Получение диоксида углерода
Если требуется получить небольшое количество СО2,можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
CaCO3 + HCl = CaCl2 + h3O + CO2 ↑.
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
СН4 + 2О2 → 2h3O + CO2.
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
CaCO3 = CaO + CO2 ↑.
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.
В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
www.syl.ru
Уровень CO2 в атмосфере стремительно возрастает: чем нам это грозит
Ученые уверяют, что, несмотря на все усилия, количество СО2 на планете продолжает стремительно увеличиваться. Очевидно, человечеству придется ускорить создание технологий поглощения углекислоты из воздуха, пока изменения климата не стали катастрофическими.
За последние несколько лет многие страны предприняли значительные усилия для сокращения количества углекислого газа, который в результате промышленной деятельности попадают в атмосферу. Заменяя заводы по переработке ископаемого топлива возобновляемыми источниками энергии, к началу 2017 года выбросы парниковых газов все же удалось сократить. Это огромное достижение.
Однако новое исследование говорит, что этого может быть недостаточно. Количество CO2 в атмосфере нашей планеты продолжает увеличиваться. Выбросы парниковых газов растут с тех пор, как много веков назад человек начал сжигать ископаемое топливо, но за последние несколько лет этот показатель находился на примерно одном и том же уровне. В 2015 и 2016 годах количество CO2, которое люди «закачивали» в атмосферу, практически не изменилось с уровня 2014 года.
Если количество CO2, которое попадает в атмосферу каждый год, выравнивается, то общее количество СО2 должно со временем стабилизироваться, верно? Тем не менее, согласно последним данным NOAA, общий объем CO2 в воздухе растет рекордными темпами. Кризис углекислого газа Земли, похоже, не замедляется, а ускоряется. За последние два года показатель роста выбросов CO2 достиг рекордной отметки.
 График изменения уровня CO2 в атмосфере за последние 50 лет
График изменения уровня CO2 в атмосфере за последние 50 лет
Трудно сказать, почему это происходит. Некоторые ученые обвиняют недавнее извержение вулкана Эль-Ниньо, однако вулкан снова уснул в начале 2016 года и спустя год уже не должен значительно влиять на климат. Более вероятная и тревожная гипотеза заключается в том, что углекислый газ больше некому поглощать. На Земле есть ряд поглотителей углерода, абсорбирующих его из атмосферы. Двумя крупнейшими являются океаны и наземные растения, каждый из которых ежегодно впитывает около 25% выбросов CO2 на планете. Проблема в том, что даже эти крупные экосистемы могут насыщаться.
Если уровень поглощение углерода падает, тогда у Земли большие проблемы. Это означает, что нам нужно ускорить развитие технологий искусственного улавливания углерода, которые в настоящее время являются в основном теоретическими. Это также может означать, что мы можем испытать на себе куда более сильные последствия изменения климата, чем прогнозируют ученые.
www.popmech.ru