Фторид кальция. Фторид кальция формула
Фторид кальция — Википедия РУ
Физические свойства
Бесцветные диамагнитные кристаллы (в измельчённом состоянии — белые). До температуры 1151 °C существует α-CaF2 с кубической решеткой (а = 0,54626 нм, z=4, пространственная группа Fm3m), выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде (16 мг/л при 18 °C).
Получение
В природе CaF2 встречается в виде минерала флюорита (плавиковый шпат), который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, жёлтый, оранжевый, красный, бурый, зелёный, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-чёрный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство ~4,5 млн т/год (1983 год).
В лабораторных условиях фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
CaCO3+2HF→CaF2↓+CO2↑+h3O{\displaystyle {\mathsf {CaCO_{3}+2HF{\xrightarrow {}}CaF_{2}\downarrow +CO_{2}\uparrow +H_{2}O}}}Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
Ca+F2→CaF2{\displaystyle {\mathsf {Ca+F_{2}{\xrightarrow {}}CaF_{2}}}}Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
CaO+2HF→CaF2↓+h3O{\displaystyle {\mathsf {CaO+2HF{\xrightarrow {}}CaF_{2}\downarrow +H_{2}O}}}Фторид кальция можно получить обменными реакциями, например:
CaCl2+2Nh5F→CaF2↓+2Nh5Cl{\displaystyle {\mathsf {CaCl_{2}+2NH_{4}F{\xrightarrow {}}CaF_{2}\downarrow +2NH_{4}Cl}}}Химические свойства
Применение
Фторид кальция является основным источником фтора и его соединений. Начиная с конца 1990-х добывалось ~5 млн тонн данного вещества в год.
Фторид кальция является компонентом металлургических флюсов, специальных стекол, эмалей, керамики, оптических и лазерных материалов. Он также используется в качестве флюса при плавке и переработке жидких чугуна и стали.
В лаборатории, фторид кальция широко применяется в качестве оптического материала для инфракрасного и ультрафиолетового излучений, а также как материал с чрезвычайно низким показателем преломления. В первые годы 21-го века цена на рынке фторида кальция упала, и многие крупные заводы были закрыты. Canon и другие производители используют синтетически выращенные кристаллы фторида кальция в качестве компонентов в объективах, уменьшающих рассеивание света.
Отличные механические, технические и эксплуатационные характеристики в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, высокой радиационной устойчивостью позволяют использовать оптические монокристаллы фторида кальция в:
Монокристаллы используются для изготовления окон, призм, линз и других оптических деталей, работающих в диапазоне излучения от ультрафиолетового до инфракрасного. Оптические детали из фторида кальция используются без защитных покрытий.[1]
Опасность применения
Фторид кальция считается относительно безвредным в силу его малой растворимости в воде. Ситуация схожа и с BaSO4, где токсичность, обычно связанная с Ba2+, компенсируется очень низкой растворимостью сульфата.
См. также
Примечания
http-wikipediya.ru
Кальция фторид - это... Что такое Кальция фторид?
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Кальция фосфаты
- Кальция хлорид
Смотреть что такое "Кальция фторид" в других словарях:
КАЛЬЦИЯ ФТОРИД — CaF2, бесцветные кристаллы. В воде практически нерастворим. В природе минерал флюорит. Применяют как флюс в металлургии, для получения HF, в качестве оптического материала в инфракрасной технике … Большой Энциклопедический словарь
кальция фторид — CaF2, бесцветные кристаллы. В воде практически нерастворим. В природе минерал флюорит. Применяют как флюс в металлургии, для получения HF, в качестве оптического материала в ИК технике. * * * КАЛЬЦИЯ ФТОРИД КАЛЬЦИЯ ФТОРИД, CaF2, бесцветные… … Энциклопедический словарь
кальция фторид — kalcio fluoridas statusas T sritis chemija formulė CaF₂ atitikmenys: angl. calcium difluoride; calcium fluoride rus. кальций фтористый; кальция фторид; плавиковый шпат; флюфит ryšiai: sinonimas – kalcio difluoridas … Chemijos terminų aiškinamasis žodynas
КАЛЬЦИЯ ФТОРИД — CaF2, бесцв. кристаллы; до 1151 °С существует a CaF2 с кубич. решеткой ( а =0,54626 нм, z = 4, пространств. группа Fm3m), выше 1151 °С разупорядоченная модификация тетрагон. сингонии; т. пл. 1418 °С; т. кип. ок. 2530 °С; плотн.… … Химическая энциклопедия
КАЛЬЦИЯ ФТОРИД — CaF2, бесцв. кристаллы. В воде практически нерастворим. В природе минерал флюорит. Применяют как флюс в металлургии, для получения HF, в качестве оптич. материала в ИК технике … Естествознание. Энциклопедический словарь
Кальция глюконат — Химическое название: Кальциевая соль глюконовой кислоты Брутто формула: C12h32CaO14 Код CAS: 299 28 5 Международное наименование: Кальция глюконат (Calcium gluconate) Групповая принадлежность: Кальциево фосфорного обмена регулятор Описание… … Википедия
КАЛЬЦИЯ ГАЛОГЕНИДЫ — СаНаl2, бесцв. кристаллы (см. табл.). Хлорид, бромид и иодид гигроскопичны, хорошо раств. в воде, из р ров выделяются в виде кристаллогидратов. Расплавл. К. г. образуют с металлич. Са моногалогениды CaHal, устойчивые выше т р плавления… … Химическая энциклопедия
Фторид кальция — Фторид кальция … Википедия
Фторид брома(I) — Фторид брома(I) … Википедия
Фторид брома(V) — (пентафторид брома) BrF5 соединение брома с фтором, представляющее собой при комнатной температуре легкоиспаряющуюся жидкость светло жёлтого цвета, с сильным раздражающим запахом, и чрезвычайно высокой химической активностью и… … Википедия
dic.academic.ru
ГОСТ 22974.11-96 Флюсы сварочные плавленые. Методы определения фторида кальция
ГОСТ 22974.11 - 96
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ФЛЮСЫ СВАРОЧНЫЕ ПЛАВЛЕНЫЕМетоды определения фторида кальция
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИМинск
Предисловие
1 РАЗРАБОТАН Межгосударственным техническим комитетом по стандартизации МТК 72; Институтом электросварки им. Е.О. Патона НАН УкраиныВНЕСЕН Государственным комитетом Украины по стандартизации, метрологии и сертификации2 ПРИНЯТ Межгосударственным Советом по стандартизации, метрологии и сертификации (протокол № 9 от 12 апреля 1996 г.)За принятие проголосовали:
| Наименование государства | Наименование национального органа по стандартизации |
Азербайджанская Республика | Азгосстандарт |
Республика Беларусь | Госстандарт Беларуси |
Республика Казахстан | Госстандарт Республики Казахстан |
Российская Федерация | Госстандарт России |
Республика Таджикистан | Таджикгосстандарт |
Туркменистан | Главная государственная инспекция Туркменистана |
Республика Узбекистан | Узгосстандарт |
Украина | Госстандарт Украины |
3 Постановлением Государственного комитета Российской Федерации по стандартизации и метрологии от 21 апреля 1999 г. № 134 межгосударственный стандарт ГОСТ 22974.11 - 96 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 января 2000 г.4 ВЗАМЕН ГОСТ 22974.11 - 85
ГОСТ 22974.11 - 96МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТФЛЮСЫ СВАРОЧНЫЕ ПЛАВЛЕНЫЕМетоды определения фторида кальцияMelted welding fluxes. Methods of calcium fluoride determinationДата введения 2000 - 01 - 01
Настоящий стандарт устанавливает пирогидролизный и титриметрический комплексонометрический методы определения фторида кальция при содержании от 1,5 до 65 %.
В настоящем стандарте использованы ссылки на следующие стандарты:ГОСТ 61 - 75 Кислота уксусная. Технические условияГОСТ 83 - 79 Натрий углекислый. Технические условияГОСТ 1027 - 67 Свинец (II) уксуснокислый 3 - водный. Технические условияГОСТ 3118 - 77 Кислота соляная. Технические условияГОСТ 3760 - 79 Аммиак водный. Технические условияГОСТ 3770 - 75 Аммоний углекислый. Технические условияГОСТ 4233 - 77 Натрий хлористый. Технические условияГОСТ 4234 - 77 Калий хлористый. Технические условияГОСТ 4328 - 77 Натрия гидроокись. Технические условияГОСТ 4461 - 77 Кислота азотная. Технические условияГОСТ 4463 - 76 Натрий фтористый. Технические условияГОСТ 5817 - 77 Кислота винная. Технические условияГОСТ 9147 - 80 Посуда и оборудование лабораторные фарфоровые. Технические условияГОСТ 9428 - 73 Кремний (IV) оксид. Технические условияГОСТ 10652 - 73 Соль динатриевая этилендиамин - N, N, N', N' - тетрауксусной кислоты 2 - водная (трилон Б)ГОСТ 18300 - 87 Спирт этиловый ректификованный технический. Технические условияГОСТ 22974.0 - 96 Флюсы сварочные плавленые. Общие требования к методам анализа
Общие требования к методам анализа - по ГОСТ 22974.0.
4.1 Сущность методаМетод основан на разложении фторида кальция парами воды при температуре 1300 "С в присутствии катализатора. Выделившаяся фтористоводородная кислота с избытком пара увлекается в приемник, где титруется гидроксидом натрия.
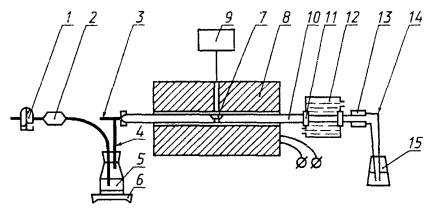 1 - промывная склянка для очистки воздуха или кислорода, заполненная раствором гидроксида натрия массовой концентрации 0,2 г/см3; 2 - шарообразная трубка, заполненная стеклянной ватой для улавливания капель воды со щелочью; 3 - нержавеющая трубка наружным диаметром 20 мм и внутренним - 18 мм, длиной 220 мм, которая входит в трубку 10 и герметично крепится хомутом; 4 - нержавеющая трубка диаметром 10 мм, приваренная к трубке 3; 5 - колба для получения пара; 6 - электрическая плитка; 7 - фарфоровая лодочка № 2 по ГОСТ 9147, предварительно прокаленная в муфельной печи при температуре 900 - 1000 °С в течение 4 - 5 ч; 8 - трубчатая электропечь с карборундовым нагревателем, обеспечивающая температуру (1300 ± 20) °С и установленная с наклоном 4° в сторону приемника; 9 - пирометр; 10 - фарфоровая или кварцевая трубка внутренним диаметром 20 - 22 мм; 11, 13 - резиновый уплотнитель; 12 - бачок для охлаждения трубки водой; 14 - форштос; 15 - приемник для титрования фтористоводородной кислотойРисунок 1 - Установка для определения содержания фторида кальция
1 - промывная склянка для очистки воздуха или кислорода, заполненная раствором гидроксида натрия массовой концентрации 0,2 г/см3; 2 - шарообразная трубка, заполненная стеклянной ватой для улавливания капель воды со щелочью; 3 - нержавеющая трубка наружным диаметром 20 мм и внутренним - 18 мм, длиной 220 мм, которая входит в трубку 10 и герметично крепится хомутом; 4 - нержавеющая трубка диаметром 10 мм, приваренная к трубке 3; 5 - колба для получения пара; 6 - электрическая плитка; 7 - фарфоровая лодочка № 2 по ГОСТ 9147, предварительно прокаленная в муфельной печи при температуре 900 - 1000 °С в течение 4 - 5 ч; 8 - трубчатая электропечь с карборундовым нагревателем, обеспечивающая температуру (1300 ± 20) °С и установленная с наклоном 4° в сторону приемника; 9 - пирометр; 10 - фарфоровая или кварцевая трубка внутренним диаметром 20 - 22 мм; 11, 13 - резиновый уплотнитель; 12 - бачок для охлаждения трубки водой; 14 - форштос; 15 - приемник для титрования фтористоводородной кислотойРисунок 1 - Установка для определения содержания фторида кальция
4.2 Аппаратура, реактивы и растворыУстановка для определения содержания фторида кальция (рисунок 1).Крючок, с помощью которого лодочки помещают в трубку и извлекают из нее, изготовлен из жаропрочной проволоки диаметром 3 - 5 мм, длиной 500 - 600 мм.Натрия гидроксид по ГОСТ 4328, раствор массовой концентрации 0,2 г/см3 и раствор с молярной концентрацией эквивалента 0,02 моль/дм3.Алюминия оксид безводный, прокаленный при температуре 1100 °С в течение 1 ч.Спирт этиловый ректификованный технический по ГОСТ 18300.Метиловый красный (индикатор).Метиленовый голубой (индикатор).Смешанный индикатор: 0,125 г метилового красного и 0,083 г метиленового голубого растворяют в 100 см3 этилового спирта; хранят в темной склянке.Кислота соляная по ГОСТ 3118 молярной концентрации 0,02 моль/дм3 (фиксанал).Массовую концентрацию раствора гидроксида натрия устанавливают по стандартному образцу флюса. Анализ стандартного образца проводят в тех же условиях, что и анализ исследуемого образца.Массовую концентрацию раствора гидроксида натрия Т, г/см3 фторида кальция, вычисляют по формулеT = 


| Массовая доля фторида кальция | Δ | Допускаемое расхождение | d | ||
dк | d2 | d3 | |||
От 1,5 до 2 включ. | 0,16 | 0,20 | 0,16 | 0,20 | 0,10 |
Св. 2 » 5 » | 0,24 | 0,30 | 0,31 | 0,16 | |
» 5 » 10 » | 0,4 | 0,5 | 0,4 | 0,5 | 0,2 |
» 10 » 20 » | 0,5 | 0,6 | 0,5 | 0,6 | 0,3 |
» 20 » 50 » | 0,8 | 1,0 | 0,8 | 1,0 | 0,5 |
» 50 » 65 » | 1,1 | 1,4 | 1,2 | 1,4 | 0,7 |
5.1 Сущность методаМетод основан на осаждении ионов фтора в виде фторхлорида свинца. Избыток свинца титруют раствором трилона Б.5.2 Реактивы и растворыКислота азотная по ГОСТ 4461, разбавленная 1:1.Аммиак водный по ГОСТ 3760, разбавленный 1:1.Аммоний углекислый по ГОСТ 3770.Калий хлористый по ГОСТ 4234.Натрий углекислый безводный по ГОСТ 83.Натрий хлористый по ГОСТ 4233, раствор массовой концентрации 0,05 г/см3.Свинец уксуснокислый по ГОСТ 1027, раствор массовой концентрации 0,025 г/см3.Кислота винная по ГОСТ 5817, раствор массовой концентрации 0,05 г/см3.Кислота уксусная по ГОСТ 61.Кремния (IV) диоксид по ГОСТ 9428.Метиловый оранжевый (индикатор), раствор массовой концентрации 0,001 г/см3.Эриохром черный Т (индикатор): 0,2 г индикатора растирают с 20 г хлористого калия.Соль динатриевая этилендиамин - N, N, N, N - тетрауксусной кислоты 2 - водная (трилон Б) по ГОСТ 10652, раствор с молярной концентрацией эквивалента 0,05 моль/дм3: 9,3 г трилона Б растворяют в 300 см3 воды. Раствор отфильтровывают в мерную колбу вместимостью 1000 см3, доливают водой до метки и перемешивают.Натрий фтористый по ГОСТ 4463, стандартный раствор: 2,210 г фторида натрия растворяют в воде и разбавляют до 1000 см3 водой в мерной колбе. Раствор имеет массовую концентрацию фтора 0,001 г/см3.Массовую концентрацию раствора трилона Б устанавливают по фтору: 50 см3 стандартного раствора переносят в стакан вместимостью 300 см3, прибавляют 10 капель уксусной кислоты, 20 см3 раствора хлористого натрия и из бюретки 25 см3 раствора уксуснокислого свинца. Раствор перемешивают, нагревают до температуры 60 - 70 °С, снова перемешивают до выпадения осадка, после чего оставляют на 12 ч.Раствор с выпавшим осадком переносят в мерную колбу вместимостью 250 см3, разбавляют водой до метки и фильтруют в сухой стакан через сухой фильтр «белая лента», отбрасывая первые порции фильтрата.Отбирают 50 - 100 см3 фильтрата в коническую колбу вместимостью 250 см3, приливают 10 см3 винной кислоты, 10 см3 аммиака (1 : 1), добавляют 0,1 г индикатора эриохрома черного Т и титруют избыток свинца раствором трилона Б до перехода окраски из сиренево - фиолетовой в ярко - голубую.Массовую концентрацию трилона Б С, г/см3 фторида кальция, вычисляют по формулеС =  , (4)где V1 - объем стандартного раствора фторида натрия, см3;2,055 - коэффициент пересчета фтора на фторид кальция;V 2 - объем раствора уксуснокислого свинца, взятого с избытком, см3;V 3 - объем раствора трилона Б, израсходованного на титрование избытка уксуснокислого свинца, см3;k - соотношение между объемами растворов уксуснокислого свинца и трилона Б.Определяют соотношение k: 5 см3 раствора уксуснокислого свинца помещают в коническую колбу вместимостью 250 см3, добавляют 50 см3 воды, 10 см3 винной кислоты, 10 см3 аммиака (1 : 1), 0,1 г индикатора эриохрома черного Т и титруют до перехода окраски из сиренево - фиолетовой в ярко - голубую.Соотношение k вычисляют по формулеk =
, (4)где V1 - объем стандартного раствора фторида натрия, см3;2,055 - коэффициент пересчета фтора на фторид кальция;V 2 - объем раствора уксуснокислого свинца, взятого с избытком, см3;V 3 - объем раствора трилона Б, израсходованного на титрование избытка уксуснокислого свинца, см3;k - соотношение между объемами растворов уксуснокислого свинца и трилона Б.Определяют соотношение k: 5 см3 раствора уксуснокислого свинца помещают в коническую колбу вместимостью 250 см3, добавляют 50 см3 воды, 10 см3 винной кислоты, 10 см3 аммиака (1 : 1), 0,1 г индикатора эриохрома черного Т и титруют до перехода окраски из сиренево - фиолетовой в ярко - голубую.Соотношение k вычисляют по формулеk =  , (5)где V4 - объем раствора уксуснокислого свинца, взятого на титрование, см3;V 5 - объем раствора трилона Б, израсходованного на титрование, см3.5.3 Проведение анализаНавеску флюса массой 0,5 г (при массовой доле фтористого кальция 1,5 - 40 %) или 0,25 г (при массовой доле фтористого кальция 40 - 65 %) смешивают с 0,2 г диоксида кремния и 5 г безводного углекислого натрия и сплавляют в платиновом тигле с крышкой при температуре 950 - 1050 °С в течение 20 - 30 мин. Плав выливают на полированную пластину из нержавеющей стали.Тигель с плавом помещают в стакан вместимостью 300 - 400 см3, приливают 50 см3 горячей воды, накрывают стеклом и выдерживают в теплом месте до полного разложения плава.Тигель извлекают из стакана и обмывают несколько раз водой. Раствор с осадком переносят в мерную колбу вместимостью 100 см3, доливают водой до метки и перемешивают.Раствор фильтруют в сухую колбу через сухой фильтр «белая лента», отбрасывая первую порцию фильтрата. Отбирают 50 см3 фильтрата в стакан вместимостью 300 см3, прибавляют 2 - 3 капли метилового оранжевого и подкисляют азотной кислотой (1 : 1) до оранжевой окраски, прибавляют 4 - 5 г углекислого аммония и кипятят до удаления запаха аммиака (при этом кремниевая кислота выделяется в виде студенистого осадка). Раствор отфильтровывают в стакан вместимостью 300 см3 через вату и промывают 8 - 10 раз горячей водой. Фильтрат подкисляют по метиловому оранжевому азотной кислотой (1 : 1) до изменения окраски раствора, прибавляют 10 капель уксусной кислоты, 20 см3 раствора хлористого натрия и из бюретки 25 - 50 см3 раствора уксуснокислого свинца. Раствор перемешивают, нагревают до температуры 60 - 70 ° С, снова перемешивают до выпадения осадка, после чего оставляют на 12 ч.Раствор с выпавшим осадком переносят в мерную колбу вместимостью 250 см3, разбавляют водой до метки и фильтруют в сухой стакан через сухой фильтр «белая лента», отбрасывая первые порции фильтрата.50 - 100 см3 фильтрата переносят в коническую колбу вместимостью 250 см3, приливают 10 см3 винной кислоты, 10 см3 аммиака (1 : 1), добавляют 0,1 г индикатора эриохрома черного Т и титруют избыток свинца раствором трилона Б до перехода окраски из сиренево - фиолетовой в ярко - голубую.5.4 Обработка результатов5.4.1 Массовую долю фтористого кальция X, %,вычисляют по формулеX=
, (5)где V4 - объем раствора уксуснокислого свинца, взятого на титрование, см3;V 5 - объем раствора трилона Б, израсходованного на титрование, см3.5.3 Проведение анализаНавеску флюса массой 0,5 г (при массовой доле фтористого кальция 1,5 - 40 %) или 0,25 г (при массовой доле фтористого кальция 40 - 65 %) смешивают с 0,2 г диоксида кремния и 5 г безводного углекислого натрия и сплавляют в платиновом тигле с крышкой при температуре 950 - 1050 °С в течение 20 - 30 мин. Плав выливают на полированную пластину из нержавеющей стали.Тигель с плавом помещают в стакан вместимостью 300 - 400 см3, приливают 50 см3 горячей воды, накрывают стеклом и выдерживают в теплом месте до полного разложения плава.Тигель извлекают из стакана и обмывают несколько раз водой. Раствор с осадком переносят в мерную колбу вместимостью 100 см3, доливают водой до метки и перемешивают.Раствор фильтруют в сухую колбу через сухой фильтр «белая лента», отбрасывая первую порцию фильтрата. Отбирают 50 см3 фильтрата в стакан вместимостью 300 см3, прибавляют 2 - 3 капли метилового оранжевого и подкисляют азотной кислотой (1 : 1) до оранжевой окраски, прибавляют 4 - 5 г углекислого аммония и кипятят до удаления запаха аммиака (при этом кремниевая кислота выделяется в виде студенистого осадка). Раствор отфильтровывают в стакан вместимостью 300 см3 через вату и промывают 8 - 10 раз горячей водой. Фильтрат подкисляют по метиловому оранжевому азотной кислотой (1 : 1) до изменения окраски раствора, прибавляют 10 капель уксусной кислоты, 20 см3 раствора хлористого натрия и из бюретки 25 - 50 см3 раствора уксуснокислого свинца. Раствор перемешивают, нагревают до температуры 60 - 70 ° С, снова перемешивают до выпадения осадка, после чего оставляют на 12 ч.Раствор с выпавшим осадком переносят в мерную колбу вместимостью 250 см3, разбавляют водой до метки и фильтруют в сухой стакан через сухой фильтр «белая лента», отбрасывая первые порции фильтрата.50 - 100 см3 фильтрата переносят в коническую колбу вместимостью 250 см3, приливают 10 см3 винной кислоты, 10 см3 аммиака (1 : 1), добавляют 0,1 г индикатора эриохрома черного Т и титруют избыток свинца раствором трилона Б до перехода окраски из сиренево - фиолетовой в ярко - голубую.5.4 Обработка результатов5.4.1 Массовую долю фтористого кальция X, %,вычисляют по формулеX=  , (6)где V - объем раствора уксуснокислого свинца, взятого для осаждения фтор - иона, см3;V 1 - объем раствора трилона Б, израсходованного на титрование избытка уксуснокислого свинца, см3;k - соотношение между объемами растворов уксуснокислого свинца и трилона Б;С - массовая концентрация раствора трилона Б, выраженная в г/см3 фторида кальция;m - масса навески, соответствующая аликвотной части раствора, г.5.4.2 Нормы точности и нормативы контроля точности определения массовой доли фторида кальция приведены в таблице 1.
, (6)где V - объем раствора уксуснокислого свинца, взятого для осаждения фтор - иона, см3;V 1 - объем раствора трилона Б, израсходованного на титрование избытка уксуснокислого свинца, см3;k - соотношение между объемами растворов уксуснокислого свинца и трилона Б;С - массовая концентрация раствора трилона Б, выраженная в г/см3 фторида кальция;m - масса навески, соответствующая аликвотной части раствора, г.5.4.2 Нормы точности и нормативы контроля точности определения массовой доли фторида кальция приведены в таблице 1.
Ключевые слова: метод определения, фторид кальция, массовая доля, реактивы, раствор, метод анализа, гидроксид натрия, кислота, нормы точности
СОДЕРЖАНИЕ
1 Область применения2 Нормативные ссылки3 Общие требования4 Пирогидролизный метод определения фторида кальция5 Титриметрический комплексонометрический метод определения фторида кальция
weldering.com
КАЛЬЦИЯ ФТОРИД - это... Что такое КАЛЬЦИЯ ФТОРИД?
Большой Энциклопедический словарь. 2000.
- КАЛЬЦИЯ ФОСФАТЫ
- КАЛЬЦИЯ ХЛОРИД
Смотреть что такое "КАЛЬЦИЯ ФТОРИД" в других словарях:
кальция фторид — CaF2, бесцветные кристаллы. В воде практически нерастворим. В природе минерал флюорит. Применяют как флюс в металлургии, для получения HF, в качестве оптического материала в ИК технике. * * * КАЛЬЦИЯ ФТОРИД КАЛЬЦИЯ ФТОРИД, CaF2, бесцветные… … Энциклопедический словарь
кальция фторид — kalcio fluoridas statusas T sritis chemija formulė CaF₂ atitikmenys: angl. calcium difluoride; calcium fluoride rus. кальций фтористый; кальция фторид; плавиковый шпат; флюфит ryšiai: sinonimas – kalcio difluoridas … Chemijos terminų aiškinamasis žodynas
Кальция фторид — фтористый кальций, CaF2, соль; бесцветные кристаллы, плотность 3,18 г/см3, tпл 1360 °С. Практически нерастворим в воде. В природе встречается в виде минерала Флюорита (плавиковый шпат), входит в состав Апатита. Применяется как исходное… … Большая советская энциклопедия
КАЛЬЦИЯ ФТОРИД — CaF2, бесцв. кристаллы; до 1151 °С существует a CaF2 с кубич. решеткой ( а =0,54626 нм, z = 4, пространств. группа Fm3m), выше 1151 °С разупорядоченная модификация тетрагон. сингонии; т. пл. 1418 °С; т. кип. ок. 2530 °С; плотн.… … Химическая энциклопедия
КАЛЬЦИЯ ФТОРИД — CaF2, бесцв. кристаллы. В воде практически нерастворим. В природе минерал флюорит. Применяют как флюс в металлургии, для получения HF, в качестве оптич. материала в ИК технике … Естествознание. Энциклопедический словарь
Кальция глюконат — Химическое название: Кальциевая соль глюконовой кислоты Брутто формула: C12h32CaO14 Код CAS: 299 28 5 Международное наименование: Кальция глюконат (Calcium gluconate) Групповая принадлежность: Кальциево фосфорного обмена регулятор Описание… … Википедия
КАЛЬЦИЯ ГАЛОГЕНИДЫ — СаНаl2, бесцв. кристаллы (см. табл.). Хлорид, бромид и иодид гигроскопичны, хорошо раств. в воде, из р ров выделяются в виде кристаллогидратов. Расплавл. К. г. образуют с металлич. Са моногалогениды CaHal, устойчивые выше т р плавления… … Химическая энциклопедия
Фторид кальция — Фторид кальция … Википедия
Фторид брома(I) — Фторид брома(I) … Википедия
Фторид брома(V) — (пентафторид брома) BrF5 соединение брома с фтором, представляющее собой при комнатной температуре легкоиспаряющуюся жидкость светло жёлтого цвета, с сильным раздражающим запахом, и чрезвычайно высокой химической активностью и… … Википедия
dic.academic.ru