Справочник химика 21. Кислород свойства
Развивающий урок по теме кислород и его свойства
Земная кора, воздух, воды рек и океанов насыщенны этим газом. Вначале на планете Земля в атмосфере практически отсутствовал данный элемент. Он стал появляться из-за глобальных изменений, произошедших в составе атмосферы. Появились первичные организмы, способствующие накоплению элемента. Свободный кислород появился и смог накапливаться благодаря жизнедеятельности растений.
Открытие кислородаПроцесс горения долгое время оставался непонятным для людей. В найденных в Китае рукописях говорится о том, что не весь воздух способен поддерживать горение. Леонардо да Винчи указывал, что воздух состоит из смеси газов. Но только один из них живые существа используют для дыхания. Этот же газ расходуется при горении. В XVII веке ученые высказали предположение, что в воздухе содержится какой-то элемент, способный поддерживать горение.
Открыт он был одновременно двумя химиками: английским Джозефом Пристли, шведским Карлом Шееле. Они открыли новый неизвестный газ и дали ему описание. Изучением свойств и роли этого газа занимался французский химик Лавуазье. Он назвал его Oxygenium, установил, что этот элемент входит в состав воздуха, кислот и других веществ. Работа ученого внесла большой вклад в дальнейшее развитие химии, благодаря ей была опровергнута флогистонная теория.
Данный газ тяжелее воздуха, плохо растворяется в воде. Если его охладить до температуры -183°С, он превратится в голубую подвижную жидкость, а замерзнет при -219°С. В твердом состоянии он имеет вид синих кристаллов. Это активный элемент с выраженными окислительными свойствами. Кислород состоит из двух молекул, обладает магнитными свойствами. Для реакции с основной массой веществ необходимо нагревание. Озон располагается в верхних слоях атмосферы и способен защитить нашу планету от ультрафиолетовых лучей. Он является аллотропной модификацией кислорода, состоит из трех молекул, является более сильным окислителем. Этот газ имеет специфический резкий запах и в больших количествах ядовит. Получают его в специальных приборах для медицинских целей, обеззараживания воды и др. Озон образуется под воздействием грозовых разрядов.
Кислород способен взаимодействовать с различными простыми веществами. Вступая в реакцию с металлами, он образует окислы, пероксиды. Вещество не взаимодействует с платиной, золотом, инертными газами, галогенами. Получить соединения этих элементов с кислородом возможно лишь косвенным путем. Если повысить температуру, то возможны реакции с различными неметаллами. В результате многих реакций происходит выделение энергии. С водородом элемент реагирует медленно. Скорость и возможность реакции с различными веществами зависит от температуры, воды. Элемент поддерживает такие важные процессы, как горение, дыхание, гниение.
Применение кислорода и способы его полученияПрименяют элемент в различных отраслях человеческой жизнедеятельности:
Получить элемент можно химическими способами, но они не дают большой производительности. В настоящее время они используются в основном в лабораториях, где кислород может быть получен несколькими способами:- с помощью электролиза водного раствора щелочи;
- разложением бертолетовой соли;
- в результате нагревания перманганата калия и др.
puzkarapuz.ru
Кислород, Вступление | |
| Символ | O |
| Латинское название | Oxygen |
| Тип вещества | простой химический элемент |
| Первооткрыватель | К.В. Шееле |
| Год открытия | 1774 |
Основные параметры кислорода по таблице Менделеева | |
| Атомный номер Z | 8 |
| 15.9994 | |
| Группа | 16 |
| Период | 2 |
| Принадлежность к группе | неметаллы |
Механические свойства кислорода | |
| Плотность газообразных веществ (при 0°C и 760мм.рт.ст) | 1.470 (Килограмм / Метр3) |
| Скорость звука | 317.5 (Метр / Секунда) |
Термодинамические свойства кислорода | |
| Агрегатное состояние при нормальных условиях | газ |
| Точка плавления по Кельвину | 54.85 (Кельвин) |
| Точка плавления по Цельсию | -218.3 (°C) |
| Точка кипения по Кельвину | 90.25 (Кельвин) |
| Точка кипения по Цельсию | -182.9 (°C) |
| Показатель адиабаты | 1.40 |
| Газовая постоянная | 260 (Джоуль / (Килограмм · Кельвин)) |
| Коэффициент объемного расширения газов в интервале температур (0..100°C) при давлении 101.3 кПа | 3.672 · 10 − 3 (1 / Кельвин) |
Магнитные свойства кислорода | |
| Тип магнитной проницаемости | парамагнетик |
Свойства атома кислорода | |
| Конфигурация электронного облака | 1s22s22p4 |
| Радиус атома | 48 · 10 − 12 (Метр) |
| Число протонов p | 8 |
| Число нейтронов n | 8 |
| Число электронов e | 8 |
| Массовое число A | 16 |
| Атомная структура кислорода | 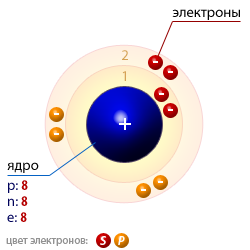 |
Химические свойства кислорода | |
| Валентность | 2 |
Распространенность кислорода | |
| Вселенная состоит из кислорода на | 1% |
| Солнце состоит из кислорода на | 0.9% |
| Мировой океан состоит из кислорода на | 86% |
| Человеческое тело состоит из кислорода на | 61% |
Вселенная | |
| Вселенная состоит из кислорода на | 1% |
www.fxyz.ru
Кислород, физические свойства — Знаешь как
Содержание статьи
К элементам группы кислорода относятся кислород, сера, селен, теллур — элементы, расположенные в главной подгруппе VI группы периодической системы элементов Д. И. Менделеева.
| Энергетические уровни | Радиус атома Å | ||||||
Рассмотрение атомных структур элементов главной подгруппы VI группы показывает, что все они имеют шестиэлектронную структуру внешнего слоя (табл. 13) и в связи с этим обладают сравнительно высокими значениями электроотрицательности. Наибольшей электроотрицательностью обладает кислород, наименьшей — теллур, что объясняется изменением величины атомного радиуса. Особое место кислорода в этой группе подчеркивается тем, что сера, селен и теллур могут непосредственно соединяться с кислородом, но не могут соединяться между собой.
Элементы группы кислорода также принадлежат к числу р-элементов, так как у них достраивается р-оболочка. Для всех элементов семейства, кроме самого кислорода, валентными являются 6 электронов внешнего слоя. В окислительно-восстановительных реакциях элементы группы кислорода часто проявляют окислительные свойства. Наиболее сильно окислительные свойства выражены у кислорода. Для всех элементов главной подгруппы VI группы характерна отрицательная степень окисления —2. Однако для серы, селена и теллура наряду с этим возможны и положительные степени окисления (максимальная +6). Молекула кислорода, как всякого простого газа, двухатомна, построена по типу ковалентной связи, образованной посредством двух электронных пар. Следовательно, кислород двухвалентен при образовании простого вещества. Сера — твердое вещество. В состав молекулы входит 8 атомов серы (S8), но они соединены в своеобразное кольцо, в котором каждый атом серы соединен лишь с двумя соседними атомами ковалентной связью

Таким образом, каждый атом серы, имея с двумя соседними атомами по одной общей электронной паре, сам по себе является двухвалентным. Сходные молекулы образуют селен (Se8) и теллур (Te8).
■ 1. Составьте рассказ о группе кислорода по следующему плану: а) положение в периодической системе; б) заряды ядер и. число нейтронов в ядре; в) электронные конфигурации; г) структура кристаллической решетки; д) возможные степени окисления кислорода и всех остальных элементов этой группы. (См. Ответ) 2. В чем сходство и различие атомных структур и электронных конфигураций атомов элементов главных подгрупп VI и VII групп? 3. Сколько валентных электронов имеется у элементов главной подгруппы VI группы? 4. Как должны себя вести элементы главной подгруппы VI группы в окислительно-восстановительных реакциях? 5. Какой из элементов главной подгруппы VI группы является наиболее электроотрицательным? (См. Ответ)
При рассмотрении элементов главной подгруппы VI группы мы впервые встречаемся с явлением аллотропии. Один и тот же элемент в свободном состоянии может образовывать два или несколько простых веществ. Такое явление называется аллотропией, а сами простые вещества называются аллотропными видоизменениями.
•Запишите эту формулировку в тетрадь.
Например, элемент кислород способен образовывать два простых вещества — кислород и озон. Формула простого вещества кислорода O2, формула простого вещества озона O3. Построены их молекулы по разному:

Кислород и озон — аллотропные видоизменения элемента кислорода. Сера также может образовывать несколько аллотропных видоизменений (модификаций). Известна ромбическая (октаэдрическая), пластическая и моноклиническая сера. Селен и теллур также образуют несколько аллотропных видоизменений. Следует заметить, что явление аллотропии характерно для многих элементов. Различия в свойствах разных аллотропных видоизменений мы рассмотрим при изучении элементов.
■ 6. В чем отличие структуры молекулы кислорода от структуры молекулы озона?
7. Какого типа связь в молекулах кислорода и озона? (См. Ответ)
Кислород — наиболее легкий элемент главной подгруппы VI группы. Атомный вес кислорода 15,994. Молекулярный вес 31,988. Атом кислорода имеет самый малый радиус из элементов этой подгруппы (0,6 Å). Электронная конфигурация атома кислорода: ls22s22p4.

Распределение электронов по орбиталям второго слоя указывает на то, что кислород имеет на р-орбиталях два непарных электрона, которые могут быть легко использованы на образование химической связи между атомами. Характерная степень окисления кислорода. Кислород представляет собой газ, не имеющий цвета и запаха. Он тяжелее воздуха, при температуре —183° превращается в жидкость голубого цвета, а при температуре —219° затвердевает.

Плотность кислорода равна 1,43 г/л. Кислород плохо растворим в воде: в 100 объемах воды при 0° растворяются 3 объема кислорода. Поэтому кислород можно держать в газометре (рис. 34) — приборе для хранения газов, нерастворимых и малорастворимых в воде. Чаще всего в газометре хранят кислород. Газометр состоит из двух главных частей: сосуда 1, служащего для хранения газа, и большой воронки 2 с краном и с длинной трубкой, доходящей почти до дна сосуда 1 и служащей для подачи воды в прибор. Сосуд 1 имеет три тубуса: в тубус 3 с притертой внутренней поверхностью вставляют, воронку 2 с краном, в тубус 4 вставляют газоотводную трубку, снабженную краном; тубус 5 внизу служит для выпуска воды из прибора при его зарядке и разрядке. В заряженном газометре сосуд 1 заполнен кислородом. На дне сосуда находится вода, в которую опущен конец трубки воронки 2.
Рис. 34. Газометр.1 — сосуд для хранения газа; 2 — воронка для подачи воды; 3 — тубус с притертой поверхностью; 4 — тубус для выведения газа; 5 — тубус для выпуска воды при зарядке аппарата.
Если нужно получить из газометра кислород, сначала открывают кран воронки, и вода слегка сжимает кислород, находящийся в газометре. Затем открывают кран на газоотводной трубке, через который выходит кислород, вытесняемый водой.
В промышленности кислород хранят в стальных баллонах в сжатом состоянии (рис. 35, а), или в жидком виде в кислородных «танках» (рис. 36 ).
Рис. 35. Кислородный баллон
•Выпишите из текста названия приборов, предназначенных для хранения кислорода. Кислород является наиболее распространенным элементом. Он составляет почти 50% веса всей земной коры (рис. 37). Человеческий организм содержит 65% кислорода, входящего в состав различных органических веществ, из которых построены ткани и органы. В воде около 89% кислорода. В атмосфере на кислород приходится 23% по весу и 21% по объему. Кислород входит в состав самых разнообразных горных пород (например, известняка, мела, мрамора CaCO3, песка SiO2), руд различных металлов (магнитного железняка Fe3O4, бурого железняка 2Fe2O3 · nh3O, красного железняка Fe2O3, боксита Аl2O3 · nН2O и т. д.). Кислород входит в состав большинства органических веществ.

Физиологическое значение кислорода огромно. Это единственный газ, который живые организмы могут использовать для дыхания. Отсутствие кислорода вызывает остановку жизненных процессов и гибель организма. Без кислорода человек может прожить всего несколько минут. При дыхании поглощается кислород, который принимает участие в окислительно-восстановительных процессах, происходящих в организме, а выделяются продукты окисления органических веществ — вода, двуокись углерода и другие вещества. Как наземные, так и водные живые организмы дышат кислородом: наземные — свободным кислородом атмосферы, а водные — кислородом, растворенным в воде. В природе происходит своеобразный круговорот кислорода. Кислород из атмосферы поглощается животными, растениями, человеком, расходуется на процессы горения топлива, гниение и прочие окислительные процессы. Двуокись углерода и вода, образующиеся в процессе окисления, потребляются зелеными растениями, в которых с помощью хлорофилла листьев и солнечной энергии осуществляется процесс фотосинтеза, т. е. синтеза органических веществ из двуокиси углерода и воды, сопровождающегося выделением кислорода. Для обеспечения кислородом одного человека нужны кроны двух больших деревьев. Зеленые растения поддерживают постоянный состав атмосферы.
■ 8. Каково значение кислорода в жизни живых организмов? 9. Как пополняется запас кислорода в атмосфере? (См. Ответ)
Химические свойства кислорода

Свободный кислород, вступая в реакции с простыми и сложными веществами, ведет себя обычно как окислитель.
Рис. 37. Распространение кислорода в земной коре
Степень окисления, которую он приобретает при этом, всегда —2. В непосредственное взаимодействие с кислородом вступают многие элементы, за исключением благородных металлов, элементов с близкими к кислороду значениями электроотрицательности (галогены) и инертных элементов. В результате соединения кислорода с простыми и сложными веществами образуются окислы. Многие простые вещества горят в кислороде, хотя на воздухе либо не горят, либо горят очень слабо. Натрий сгорает в кислороде ярко-желтым пламенем; при этом образуется перекись натрия (рис. 38): 2Na + O2 =Na2O2, Сера горит в кислороде ярко-голубым пламенем с образованием сернистого ангидрида: S + O2 = SO2 Древесный уголь на воздухе едва тлеет, а в кислороде сильно раскаляется и сгорает с образованием двуокиси углерода (рис. 39): С + O2 = СO2

Рис. 36. Кислородный танк
Фосфор горит в кислороде белым, ослепительно ярким пламенем, причем образуется твердая белая пятиокись фосфора: 4Р + 5O2 = 2Р2O5 Железо горит в кислороде, разбрасывая искры и образуя железную окалину (рис. 40). Горят в кислороде и органические вещества, например метан СН4, входящий состав природного газа: Сh5 + 2O2 = CO2 + 2h3O Горение в чистом кислороде происходит гораздо интенсивнее, чем на воздухе, и позволяет получить Значительно более высокие температурь. Это явление используют для интенсификации ряда химических процессов и более эффективного сжигания топлива. В процессе дыхания кислород, соединяясь с гемоглобином крови, образует оксигемоглобин, который, являясь весьма нестойким соединением, легко разлагается в тканях с образованием свободного кислорода, идущего на окисление. Гниение, коррозия металлов также являются окислительными процессами, протекающими с участием кислорода. Распознают чистый кислород, внося в сосуд, где предполагается его наличие, тлеющую лучинку. Она ярко вспыхивает — это и является качественной пробой на кислород.
■ 10. Каким образом, имея в своем распоряжении лучинку, можно распознать находящиеся в разных сосудах кислород, водород , двуокись углерода? 11. Какой объем кислорода пойдет на сжигание 2 кг каменного угля, содержащего в сечем составе 70% углерода, 5% водорода, 7% , кислорода, остальное— негорючие компоненты? (См. Ответ)

Рис. 38. Горение натрия Рис. 39. Горение угля Рис. 40. Горение железа в кислороде.
12. Хватит ли 10 л кислорода для сжигания 5 г фосфора? 13. 1 м3 газовой смеси, содержащей 40% окиси углерода, 20% азота, 30% водорода н 10% двуокиси углерода сожгли в кислороде. Какой объем кислорода был израсходован? 14. Можно ли сушить кислород, пропуская его через: а) серную кислоту, б) хлорид кальция, в) фосфорный ангидрид, г) металлический натрий? 15. Как освободить двуокись углерода от примеси кислорода и наоборот, как освободить кислород от примеси двуокиси углерода? 16. 20 л кислорода, содержащего примесь двуокиси углерода пропустили через 200 мл 0,1 н. раствора гидроокиси бария. В результате катион Ва2+ был полностью осажден. Сколько двуокиси углерода (в процентах) содержал исходный кислород? (См. Ответ)
Получение кислорода
Получают кислород несколькими способами. В лаборатории кислород получают из Кислородсодержащих веществ, которые могут легко его отщеплять, например из перманганата калия КМnO4 (рис. 41) или из бертолетовой соли КСlO3: 2КМnО4 = K2MnO4 + МnО2 + O2↑
2КСlO3 = 2КСl + O2↑ При получении кислорода из бертолетовой соли для ускорения реакции должен присутствовать катализатор — двуокись марганца. Катализатор ускоряет разложение и делает его более равномерным. Без катализатора может

Рис. 41. Прибор для получения кислорода лабораторный способом из перманганата калия. 1 — перманганат калия; 2 — кислород; 3 — вата; 4 — цилиндр — сборник.
произойти взрыв, если бертолетова соль взята в большом количестве и особенно если она загрязнена органическими веществами. Из перекиси водорода кислород получают также в присутствии катализатора — двуокиси марганца МnО2 по уравнению: 2Н2O2[МnО2] = 2Н2O + О2
■ 17. Зачем при разложении бертолетовой соли добавляют МnО2? (См. Ответ) 18. Образующийся при разложении КМnO4 кислород можно собирать над водой. Отразите это в схеме прибора. 19. Иногда при отсутствии в лаборатории двуокиси марганца вместо нее в бертолетову соль добавляют немного остатка после прокаливания перманганата калия. Почему возможна такая замена? 20. Какой объем кислорода выделится при разложении 5 молей бертолетовой соли? (См. Ответ)
Кислород может быть получен также разложением Нитратов при нагревании выше температуры плавления: 2KNO3 = 2KNO2 + О2 В промышленности кислород получают в основном из жидкого воздуха. Переведенный в жидкое состояние воздух подвергают испарению. Сначала улетучивается азот (его температура кипения — 195,8°), а кислород остается (его температура кипения —183°). Этим способом кислород получается почти в чистом виде. Иногда при наличии дешевой электроэнергии кислород получают электролизом воды: Н2O ⇄ Н+ + OН— Н+ + е— → Н0 на катоде 2ОН— — е— → h3O + О; 2О = О2 на аноде
■ 21. Перечислите известные вам лабораторные и промышленные способы получения кислорода. Запищите их в тетрадь, сопровождая каждый способ уравнением реакции. (См. Ответ) 22. Являются ли реакции, используемые для получения кислорода, окислительно-восстановительными? Дайте обоснованный ответ. 23. Взято по 10 г следующих веществ; перманганата калия, бертолетовой соли, нитрата калия. В каком случае удастся получить наибольший объем кислорода? 24. В кислороде, полученном при нагревании 20 г перманганата калия, сожгли 1 г угля. Какой процент перманганата подвергся разложению? (См. Ответ)
Применение кислорода
Кислород — самый распространенный элемент в природе. Он широко применяется в медицине, химии, промышленности и т. д. (рис. 42).

Рис. 42. Применение кислорода.
Летчики на больших высотах, люди, работающие в атмосфере вредных газов, занятые на подземных и подводных работах, пользуются кислородными приборами (рис. 43).
В тех случаях, когда дыхание затруднено вследствие того или иного заболевания, человеку дают дышать чистым кислородом из кислородной подушки или помещают его в кислородную палатку. В настоящее время для интенсификации металлургических процессов широко применяют воздух, обогащенный кислородом, или чистый кислород. Кислородно-водородная и кислородно-ацетиленовая горелки применяются для сварки и резки металлов. Пропитывая жидким кислородом горючие вещества: древесные опилки, угольный порошок и пр., получают взрывчатые смеси, называемые оксиликвитами.
■ 25. Начертите таблицу в тетради и заполните её. (См. Ответ)
| Свойства кислорода | Примечание кислорода |
Озон О3
Как уже говорилось, элемент кислород может образовывать еще одно аллотропное видоизменение — озон О3. Озон кипит при —111°, а затвердевает при —250°. В газообразном состоянии он голубого цвета, в жидком — синего. Растворимость озона в воде гораздо выше, чем кислорода: в 100 объемах воды растворяется 45 объемов озона.

Озон отличается от кислорода тем, что его молекула состоит из трех, а не двух атомов. В связи с этим молекула кислорода намного более стойкая, чем молекула озона. Озон легко распадается по уравнению: О3 = О2 + [O]
Выделение атомарного кислорода при распаде озона делает его гораздо более сильным окислителем, чем кислород. Озон имеет запах-свежести («озон» в переводе значит «пахучий»). В природе он образуется под действием тихого электрического разряда и в сосновых лесах. Больным с заболеванием легких рекомендуется больше бывать в сосновых лесах. Однако продолжительное пребывание в атмосфере, сильно обогащенной озоном, может оказать отравляющее действие на организм. Отравление сопровождается головокружением, тошнотой, кровотечением из носа. При хрони-ческих отравлениях могут возникнуть сердечные заболевания. В лаборатории озон получают из кислорода в озонаторах (рис. 44). В стеклянную трубку 1, обмотанную сна- ружи проволокой 2, пропускают кислород. Внутри трубки проходит проволока 3. Обе эти проволоки: соединены с полюсами источника тока, создающего на указанных электродах высокое напряжение. Между электродами происходит тихий электрический разряд, благодаря чему из кислорода образуется озон.

Рис 44; Озонатор. 1 — стеклянный баллон; 2 — наружная обмотка; 3 —проволока внутри трубки; 4 — раствор йодида калия с крахмалом
3О2 = 2О3 Озон является очень сильным окислителем. Он значительно энергичнее, чем кислород, вступает в реакции и вообще намного активнее кислорода. Например, в отличие от кислорода он может вытеснить йод из йодистого водорода или йодистых солей: 2KI + О3 + Н2О = 2КОН + I2 + O2
Озона в атмосфере очень мало (около одной миллионной доли процента), но он играет существенную, роль в поглощении ультрафиолетовых солнечных лучей, по-этому они попадают на землю в меньшем количестве и не оказывают губительного действия на живые организмы. Применяется озон в небольшом количестве главным образом для кондиционирования воздуха, а также в химии.
■ 26. Что такое аллотропные видоизменения? (См. Ответ) 27. Почему йодкрахмальная бумага синеет под действием озона? Дайте обоснованный ответ. 28. Почему молекула кислорода значительно устойчивее молекулы озона? Обоснуйте свой ответ с точки зрения внутримолекулярной структуры. 29. Как объяснить, почему озон проявляет более сильное окислительное действие, чем кислород? (См. Ответ)
18
17 19
znaesh-kak.com
Кислород свойства - Справочник химика 21
По физико-химическим свойствам получаемая ири перегонке сланцев смола отличается от природной нефти большей вязкостью, плотностью, высоким содержанием азота и кислорода. Свойства смолы в определенной мере зависят и от способа ее получения (табл. 3.13) [123]. Так как первичная сланцевая смола имеет высокую температуру застывания, обычно превышающую 20 °С, для получения из нее моторных топлив требуется предварительная переработка смолы, например коксование пли гидрирование. Смола, не прошедшая предварительную обработку, транспортируется до перерабатывающих предприятий ио специальным трубопроводам с обогревом. Определенную трудность при гидроочистке смолы может представлять наличие в ней твердых взвешенных частиц, которые должны удаляться центрифугированием или отгонкой тяжелого остатка. Гидроочистку смолы можно проводить без ее предварительного фракционирования с применением технологии гидрообессеривания нефтяных остатков. При этом для полного удаления азота потребуется от 260 до 350 м водорода на 1 м смолы (в зависимости от ее качества). Однако более целесообразно гидроочистку проводить до содержания азота в смоле л 0,15% (масс.), а затем после фракционирования подвергать гидроочистке бензин, средние дистилляты и газойль раздельно. В таком варианте общий расход водорода на очистку 1 м смолы составит в среднем 280 м [c.112]
Цикл Свойства веществ в свете атомно-молекулярной теории включает передачи Химия вокруг нас , Свойства жидкого кислорода , Свойства водорода , Свойства воды , М. В. Ломоносов — основоположник атомно-молекулярной теории , Анализ и синтез воды , Очистка воды . В этих передачах актуализированы понятия о многообразии свойств веществ (молекулярного и немолекулярного строения), зависимости их свойств от состава и строения. Рассматриваются свойства и получение в лаборатории впервые изучаемых учащимися простых веществ — кислорода и водорода. Основная цель этого цикла — пробудить у учащихся интерес к изучению предмета. Поэтому передачи цикла насыщены эффектными опытами, недоступными или малодоступными для учителя средней щколы. [c.91]
Как уже отмечалось, некоторые свойства сернистых соединений определяются тем, что сера является ближайшим аналогом кислорода. Свойства некоторых органических соединений серы вполне сходны со свойствами соединений кислорода того же строения. Так, меркаптаны — ближайшие аналоги спиртов, сульфиды — аналоги простых эфиров и т. д. [c.25]
При использовании температурного фактора как средства повышения скорости коррозии при испытании необходимо учитывать характер протекающего процесса. Известно, что скорость электродных реакций с повышением температуры повышается, но одновременно температура влияет и на ряд других факторов — растворимость кислорода, свойства защитных пленок на металлах и т. п. Необходимо иметь в виду, что при повышении температуры скорость кислородной деполяризации возрастает лишь до определенного предела (около 60 °С). При дальнейшем повышении температуры резко уменьшается растворимость кислорода, что приводит к снижению скорости коррозии. [c.19]
К этой группе веществ относятся, во-первых, многочисленные соединения типа солей или алкоголятов, в которых металл соединен с атомом кислорода. Свойства этих веществ были уже рассмотрены в соответствующих главах и потому останавливаться на них здесь мы не будем. [c.301]
Это одна из наиболее важных проблем химии определить, из каких атомов состоит данное вещество. Насколько важна эта проблема, видно из сравнения трех веществ воды, кислорода и водорода. Как вода, так и кислород содержат атомы кислорода, но свойства этих веществ соверщенно различны. Вода и водород содержат атомы водорода, но их свойства не более сходны, чем свойства воды и кислорода. Свойства воды, определяемые сочетанием двух видов атомов, весьма специфичны. [c.47]
Влияние наложения э.д.с. Уже было показано, что поведение металла, погруженного в водный раствор электролита, определяется поступлением кислорода, свойствами окисной пленки и проводимостью раствора. Поведение металла можно кроме того видоизменить путем наложения э.д.с. Рассмотрим два случая в одном потенциал металла становится более отрицательным, в другом — более положительным. Коррозия металла в обоих случаях может быть предотвращена. [c.473]
Под действием кислорода свойства натрий-дивиниловых каучуков значительно изменяются—каучуки становятся более жесткими, прочность их повышается, а относительное удлинение уменьшается. Одновременно ухудшается растворимость каучука, что является показателем структурирования. [c.349]
МОЖНО заметить, что все атомы водорода в метане равноценны они мало активны (см. стр. 63). В метиловом же спирте три атома водорода связаны с углеродом, а четвертый с атомом кислорода. Свойства этого последнего атома резко отличаются от свойств остальных атомов водорода. Он довольно легко замещается на щелочные металлы, на спиртовые и кислотные остатки. Остальные атомы водорода (см. стр. 17) не способны к таким взаимодействиям. В результате присутствия гидроксильной группы в метиловом спирте атомы углерода и водорода приобретают способность легче окисляться, чем атомы метана. [c.23]
Казалось бы, теперь о молекулах воды известно все, и их можно укладывать, как костяшки домино. Однако у отдельно взятой молекулы воды есть качество, которое проявляется только в присутствии других молекул способность образовывать водородные мостики между атомами кислорода двух оказавшихся рядом молекул, так что атом водорода располагается на отрезке, соединяющем атомы кислорода. Свойство образовывать такие мостики обусловлено наличием особого взаимодействия между молекулами, в котором существенную роль играет атом водорода. Это взаимодействие называется водородной- связью и обозначается О—Н...0 (Н-связь). [c.97]
Первое соединение благородного газа было получено Нейлом Бартлеттом в ] 962 г. Его работа вызвала сенсацию, поскольку она означала крушение одного из парадиг-мов-веры в то, что элементы семейства благородных газов совершенно инертны в химическом отношении. Вначале Бартлетту удалось получить соединение ксенона с фтором-наиболее реакционноспособным химическим элементом. Затем было получено еще несколько соединений ксенона с фтором и кислородом. Свойства этих веществ перечислены в табл. 21.2. Три простых фторида, Хер2, ХеЕ и ХеЕ , образуются при непосредственном взаимодействии между составляющими их элементами. Изменяя количества реагентов и условия реакции, можно получать то или иное из этих трех соединений. Кислородсодержащие соединения ксенона получают при взаимодействии фторидов с водой [c.287]
Передачи на урок (телелекции и телевставки) подразделяют на тематически приуроченные ( Свойства жидкого кислорода , Свойства водорода , Производство алюминия и др.) и тематически лабильные (скользящие) передачи ( Окислительно-восстановительные реакции , Классификация химических реакций , Развитие теории строения А. М. Бутлерова в свете современных электронных представлений и др.). Такая классификация чрезвычайно важна для учителя. Тематически приуроченная передача должна быть принята учителем именно на том уроке, к которому она предназначена. Тематически лабильная телепередача может быть принята на различные уроки по данной теме. [c.87]
Оба окисла крайне еустойчивы и уже при слабом накаливании диссоциируют на металл и кислород (свойство, общее всем благородным металлам). [c.557]
Прн использовании температурного фактора как. средства повышения скорости коррозии необходимо учитывать характер протекающего процесса. Скорость электродных реакций с повышением температуры увеличивается, однако температура влияет и на ряд других факторов— растворимость кислорода, свойства защитных пленок на металлах и т. п. Необходимо иметь в виду, что в открытых системах скорость кислородной деполяризации возрастает при увеличении температуры лишь до определенного предела ( 60°С)- Дальнейшее ее повышение резко уменьшает растворимость кислорода, что приводит к обратным результатам, т. е. к уменьшению скорости коррозии.. Для процессов коррозии, протекающих с водородной деполяризаи ией (кислые электролиты), этих ограничений не существует и температуру можно повышать вплоть до температуры кипения. При этом рекомендуется учитывать изменение температурного коэффициента процесса. [c.10]
Приписывая водороду свойство горючести , а кислороду — свойство поддерживать горение как их характерные, а следовательно, как бы неотъемлемые от этих элементов свойства, мы в действительности отвле- [c.200]
Написав вместо слова селитра ее формулу КМОд, современный химик Вкладывает в нее большую сумму знаний о природе этого вещества. Он говорит этой фор-мулой,что селитра состоит из трех элементов калия (К), азота (N) и кислорода (О), причем в каждой молекуле селитры по одному атому азота й калия и по три атома кислорода. Большое количество кислорода говорит о способности селитры служить поставщиком кислорода — свойство, которое много столетий используется для изготовления черного пороха. [c.116]
Гидроперекиси очень неустойчивы. Находясь в равновесии с водным раствором, они теряют часть активного кислорода. Концентрированная серная кислота разлагает их с образованием озонированного кислорода. При действии слабой серной кислоты выделяется перекись водорода. При сушке над концентрирсжанной серной кислртой перекисные соединения теряют воду и часть активного кислорода. При 200° наступает полное отщепление активного кислорода. Свойства и составы гидроперекисных соединений редкоземельных элементов в настоящее время еще мало изучены. [c.139]
Допустим, атомы кислорода успевают таким образом прореагировать с атомами титана, что после присоединения каждой новой порции кислорода успевает установиться химическое равновесие. Оказывается, пока отношение числа атомов кислорода к числу атомов титана не превысит 0,5, твердое тело остается внешне однородным. Это будет одна и та же твердая фаза независимо от количества поглощенного кислорода. Свойства такого твердого тела будут изменяться непрерывно от состава Т1 (чистый титан) до состава Т120 (низший окисел титана). Такнм образом, эту фазу можно считать твердым раствором кислорода в металлическом титане или твердым раствором Т1 0 в титане. [c.57]
Это уравнение по фирме совпадает с уравнениями, ош сывающими тепло- и массообмеи в химически инертно среде. Оно показывает, что при равенстве коэффициентов диффузии топлива п кислорода свойство [c.110]
Неорганическая химия (1987) -- [ c.376 ]Пособие по химии для поступающих в вузы 1972 (1972) -- [ c.220 , c.221 ]
Современная общая химия Том 3 (1975) -- [ c.2 , c.8 ]
Общая химия (1964) -- [ c.100 ]
Курс неорганической химии (1963) -- [ c.741 , c.743 ]
Основы неорганической химии (1979) -- [ c.357 , c.361 ]
Современная неорганическая химия Часть 3 (1969) -- [ c.2 , c.203 ]
Неорганическая химия (1950) -- [ c.65 ]
Общая и неорганическая химия (1981) -- [ c.112 , c.436 ]
Учебник общей химии 1963 (0) -- [ c.223 ]
Современная общая химия (1975) -- [ c.2 , c.8 ]
Технология серной кислоты Издание 2 (1983) -- [ c.347 , c.348 ]
Курс технологии минеральных веществ Издание 2 (1950) -- [ c.171 ]
Получение кислорода Издание 4 (1965) -- [ c.9 ]
Получение кислорода Издание 5 1972 (1972) -- [ c.11 ]
Справочник сернокислотчика 1952 (1952) -- [ c.32 ]
Технология серной кислоты (1983) -- [ c.347 , c.348 ]
Технология связанного азота (1966) -- [ c.67 , c.471 , c.472 ]
получение кислорода Издание 4 (1965) -- [ c.9 ]
Неорганическая химия (1994) -- [ c.299 , c.515 ]
Технология азотной кислоты 1949 (1949) -- [ c.362 , c.365 , c.366 ]
Техника лабораторной работы в органической химии Издание 3 (1973) -- [ c.271 ]
Основы общей химии Т 1 (1965) -- [ c.48 , c.349 ]
Основы общей химии Том 3 (1970) -- [ c.262 ]
Курс неорганической химии (1972) -- [ c.664 , c.665 ]
Практикум по общей химии (1948) -- [ c.152 ]
Основы общей химии том №1 (1965) -- [ c.48 , c.349 ]
chem21.info
Кислород | Химия свойства элементов
Общие сведения и методы получения
Кислород (О) —бесцветный газ, не имеющий запаха. Открыт в 1772— 1774 гг. Шееле при сильном прокаливании селитры, а затем при воздействии серной кислоты на пиролюзит (диоксид марганца). Независимо от Шееле в 1774 г. кислород получил Пристли, нагревая оксид ртути и сурик. Современное название элементу дал создатель теории горения Лавуазье, который считал, что кислород является составной частью кислот, и потому назвал этот газ «Oxygene» (кислый).
Содержание кислорода в сухом воздухе 20,9 % (по объему), или 23 % (по массе). В земной коре в форме различных соединений содержится 47,3 % кислорода Общее содержание кислорода в литосфере, гидросфере и атмосфере составляет ~50 % по отношению к содержанию всех остальных элементов.
В промышленности кислород получают путем фракционной перегонки жидкого воздуха или фракционным сжижением воздуха. Значительные количества кислорода получают электролизом воды. Кислород, полученный при сжижении воздуха, содержит до 3 % Аг, температура кит нпя которого близка к температуре кипения кислорода. В лабораторных условиях кислород можно получить при термическом разложении богатых этим элементом веществ. Кислород поставляют потребителям в случае его ограниченного расхода в стальных баллонах, давление газа в которых достигает 15 МПа. Технический кислород первого
сорта содержит не менее 99,7% 02, второго — не менее 99,5% 02,
третьего — не менее 99,2 % 02.
Физические свойства
Атомные характеристики. Атомный номер 8, атомная масса 15,9994 а е м, атомный объем 10,89-10—3 м3/моль. Атомный радиус кислорода (ковалептный) 0,066 нм. Конфигурация внешних электронных оболочек атома кислорода 2s22p4. Кислород состоит из трех стабильных изотопов 160, 170 и 180, процентное содержание которых соответственно равно 99,759; 0,037 и 0,204 %• Известны три искусственных радиоактивных изотопа >Ю, 150, 190 с периодами полураспада 72,1; 126 и 29,4 с соответственно. Ниже 23,85 К при атмосферном давлении стабильна ромбическая а-фаза с периодами о=0,5403 нм, 6 = 0,3429 нм, с=0,5086 нм, 6 = 132,53°. В интервале (—249,15)•+(—229,23) °С стабильна fl -фаза, имеющая ромбоэдрическую структуру с периодами о= =0,3307 нм, с= 1,1256 нм. Выше —229,23 °С существует кубическая модификация y с периодом а— 0,683 нм. Потенциалы ионизации атома кислорода J (эВ): 18,614; 35,15; 54,93. Электроотрицательность 3,5.
Химические свойства
Во всех соединениях, за исключением соединения со фтором, степень окисления кислорода равна —2. В соединении со фтором (OF2) степень окисления кислорода положительна и равна +2.
Кислород — элемент очень активный в химическом отношении. Ои вступает во взаимодействие практически со всеми элементами Периодической системы, за исключением инертных газов. При таком взаимодействии образуются химические соединения, которые принято называть оксидами. Оксиды получают двумя методами, непосредственным соединением элементов с кислородом или нагреванием гидроксидов или других кислородных соединений.
Непосредственное соединение элемента с кислородом гораздо более интенсивно происходит при нагреве, в процессе реакции выделяется большое количество тепла, которое может привести к самовозгоранию вещества,
Образующиеся оксиды, как правило, термически устойчивы, за исключением оксидов благородных металлов. Соединения большинства переходных металлов с кислородом устойчивы до 1250—1750 °С. Большой термической стабильностью и стойкостью к действию различных агрессивных сред отличаются оксид алюминия AI2O3, оксид кремния Si02, оксид циркония Zr02 и др.
Многие оксиды при нагреве с водородом или углем восстанавливаются, при этом получаются чистые металлы.
Технологические свойства и области применения
Кислород играет определяющую роль в существовании жизни на Земле. С ним связано возникновение природы и последующее ее эволюционное развитие.
В технике и промышленности кислород применяется для интенсификации различных технологических процессов (доменное и сталеплавильное производство, получение серной и азотной кислот). Кислород обеспечивает получение высоких температур сгорания различных газов, что находит широкое применение в высокотемпературной технологии (газовая сварка, резка).
ibrain.kz