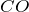Углекислый газ. Молярная масса углекислого газа
Углекислый газ – формула, молярная масса, физические свойства (8 класс, химия)
Диоксид углерода, оксид углерода, углекислота – все эти названия одного вещества, известного нам, как углекислый газ. Так какими же свойствами обладает этот газ, и каковы области его применения?

Углекислый газ и его физические свойства
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.

Рис. 1. Молекула углекислого газа.
Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».

Рис. 2. Сухой снег – углекислый газ.
Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44. Это число формируется из суммы относительных атомных масс атомов, входящих в состав молекулы. Значения относительных атомных масс берутся из таблицы Д.И. Менделеева и округляются до целых чисел. Соответственно, молярная масса CO₂ = 12+2*16.
Чтобы вычислить массовые доли элементов в углекислом газе необходимо следовать формулерасчета массовых долей каждого химического элемента в веществе.w = n * Ar / Mr
n – число атомов или молекул.Ar – относительная атомная масса химического элемента.Mr – относительная молекулярная масса вещества.Рассчитаем относительную молекулярную массу углекислого газа.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 или 27 % Так как в формулу углекислого газа входит два атома кислорода, то n = 2 w(O) = 2 * 16 / 44 = 0,73 или 73 %
Ответ: w(C) = 0,27 или 27 %; w(O) = 0,73 или 73 %
Химические и биологические свойства углекислого газа
Углекислый газ обладает кислотными свойствами, так как является кислотным оксидом, и при растворении в воде образует угольную кислоту:
CO₂+H₂O=H₂CO₃
Вступает в реакцию со щелочами, в результате чего образуются карбонаты и гидрокарбонаты. Этот газ не подвержен горению. В нем горят только некоторые активные металлы, например, магний.
При нагревании углекислый газ распадается на угарный газ и кислород:
2CO₃=2CO+O₃.
Как и другие кислотные оксиды, данный газ легко вступает в реакцию с другими оксидами:
СaO+Co₃=CaCO₃.
Углекислый газ входит в состав всех органических веществ. Круговорот этого газа в природе осуществляется с помощью продуцентов, консументов и редуцентов. В процессе жизнедеятельности человек вырабатывает примерно 1 кг углекислого газа в сутки. При вдохе мы получаем кислород, однако в этот момент в альвеолах образуется углекислый газ. В этот момент происходит обмен: кислород попадает в кровь, а углекислый газ выходит наружу.
Получение углекислого газа происходит при производстве алкоголя. Также этот газ является побочным продуктом при получении азота, кислорода и аргона. Применение углекислого газа необходимо в пищевой промышленности, где углекислый газ выступает в качестве консерванта, а также углекислый газ в виде жидкости содержится в огнетушителях.

Рис. 3. Огнетушитель.
Что мы узнали?
Углекислый газ – вещество, которое в нормальных условиях не имеет цвета и запаха. помимо своего обычного названия – углекислый газ, его также называют оксидом углерода или диоксидом углерода.
Тест по теме
obrazovaka.ru
Какова масса 50 молей углекислого газа?
Слушай, уже третий вопрос про моли задаёшь. Лень в учебник глянуть? Там просто всё. Есть такая величина - молярная масса. Для любого вещества её вычисляют так. Находим в таблице Менделеева атомы, составляющие это вещество. Суммируем их атомные массы (с учётом коэффициентов, разумеется) . Всё. Полученная цифирь - это молярная масса в единицах грамм/моль. А дальше во всех задачах надо её с лёгкостью применить. Успехов!!!
2 200г/м, т. к. 1моль - 44г))))))))))))
Я с вами 2200г/моль
масса равна 2200г
Из формулы количества вещества: v=m / M (v-количество вещества=50моль, m-масса, М-молярная масса, для углекислого газа=0,044кг/моль) , выразим массу m=v*M. m=50*0,044=2,2кг. m=2,2кг.
touch.otvet.mail.ru
Выразить в граммах массу одной молекулы СО2. -
Молекулярная масса углекислого газа равна 44. Следовательно, мольная масса СО2 равна 44 г/моль. В 1 моле углекислого газа содержится 6,02 ·1023 молекул.
Отсюда находим массу одной молекулы:
m = 44/ (6,02 ·1023) = 7,31 · 10-23 г.
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод формул химических соединений, составляют раздел химии, называемый стехиометрией. Стехиометрия включает в себя законы Авогадро, постоянства состава, кратных отношений, Гей-Люссака, эквивалентов и сохранения массы.
Состояние газа характеризуется его температурой, давлением и объемом. Если температура равна 273 К, а давление равно нормальному атмосферному (760 мм ртутного столба или 101, 325 кПа), то условия, при которых находится газ, называются нормальными.
Закон простых объемных отношений (Ж. Гей-Люссак): При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов как небольшие целые числа.
Закон Гей-Люссака: при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре Т:
V1 / T1 = V2 /T2 или V/ T = const.
Закон Бойля-Мариотта:
При постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа:
P V = const или P2 / P1 = V1 / V2 .
Зависимость между объемом газа, давлением и температурой можно выразить общим уравнением, объединяющим законы Бойля- Мариотта и Гей-Люссака:
PV/ T = P0V0/ T0.
В уравнении буквенные обозначения с индексом «0» относятся к нормальным условиям существования газа, а без индексов — к любым условиям.
Закон Авогадро: В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул.
Из закона Авогадро вытекают два следствия:
1) Одинаковое число молекул любых газов при одинаковых условиях занимают одинаковый объем.
2) Относительная плотность одного газа по другому равна отношению их молярных масс.
Молярный объем – объем моля любого газа при нормальных условиях; равен 22,4 л∙моль–1.
einsteins.ru
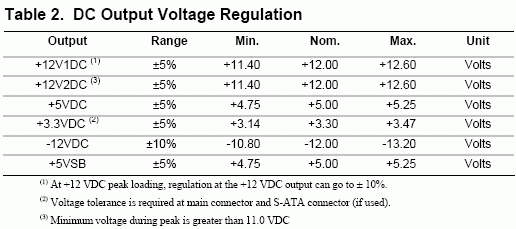
Определение молярной массы углекислого газа
Определение молярной массы углекислого газа
Цель работы: 1. Научиться пользоваться аппаратом Киппа для получения газов.
2.Освоить метод нахождения молярной массы газообразного вещества весовым методом.
Оборудование и реактивы: Аппарат Киппа, две промывные склянки, колба на 250 мл, химические весы, мерный цилиндр 250 ¸ 300 мл, мрамор, раствор соляной кислоты с концентрацией 10 %, концентрированная серная кислота.
Ход опыта.
1) Собирают прибор для определения молярной массы газа весовым методом (Рис. 4.2).
Прибор состоит из аппарата Киппа (1), в котором получают диоксид углерода действием 10 %-ной соляной кислоты на кусочки мрамора.
Так как для работы необходим сухой чистый газ, то получаемый в аппарате Киппа 
 . В склянке (3), наполненной концентрированной серной кислотой, поглощаются пары воды.
. В склянке (3), наполненной концентрированной серной кислотой, поглощаются пары воды. 2) Сухую колбу емкостью 250 мл (4) плотно закрывают каучуковой пробкой (отмечают нижний край пробки стеклографом) и взвешивают на технохимических весах с точностью до 0,01 г.
3) Открыв пробку, опускают газоотводную трубку (до дна!) от аппарата Киппа и в течение 5 мин пропускают  с такой скоростью, чтобы можно было считать отдельные пузырьки в промывных склянках.
с такой скоростью, чтобы можно было считать отдельные пузырьки в промывных склянках.
4) Проверить полноту наполнения колбы углекислым газом. (Как это сделать?)

21
5) Закрыть колбу пробкой до метки и взвесить.
6) Определить объем  в условиях опыта. Для этого заполнить колбу водой до метки, вылить воду в мерный цилиндр, записать объем.
в условиях опыта. Для этого заполнить колбу водой до метки, вылить воду в мерный цилиндр, записать объем.
7) Отметить показания барометра и термометра.
8) Записать результаты эксперимента:
1. Масса колбы с пробкой и воздухом............... г.
2. Масса колбы с пробкой и  ....................... г.
....................... г.
3. Объем колбы.................................................... л
4. Абсолютная температура опыта (273+T)........ К
5. Атмосферное давление.................................... мм. рт. ст.
6. Объем воздуха, приведенного к нормальным условиям л
7. Масса воздуха в объеме колбы....................... г
8. Масса 
9. Плотность  по воздуху............................
по воздуху............................
10.Молярная масса  ..................................... г/моль
..................................... г/моль
Внимание! При расчете массы  в объеме колбы следует учесть массу воздуха, вытесненного из колбы. Ее нужно прибавить к разности масс с
в объеме колбы следует учесть массу воздуха, вытесненного из колбы. Ее нужно прибавить к разности масс с 
Проведя необходимые расчеты, необходимо вычислить относительную погрешность опыта:

Проанализировать причины ошибки.
3. Приложение
Табл.3.1. Давление насыщенного водяного пара при разных температурах
|
Температура, Т0 , С |
Давление, Р, Мм рт. ст. |
Температура, Т0, С |
Давление, Р, Мм рт. Ст. |
|
10 |
9,21 |
20 |
17,54 |
|
11 |
9,84 |
21 |
18,65 |
|
12 |
10,52 |
22 |
19,83 |
|
13 |
11,23 |
23 |
21,07 |
|
14 |
11,99 |
24 |
22,38 |
|
15 |
12,79 |
25 |
23,76 |
|
16 |
13,63 |
26 |
25,21 |
|
17 |
14,53 |
27 |
26,74 |
|
18 |
15,48 |
28 |
28,35 |
|
19 |
16,48 |
29 |
30,04 |
po-teme.com.ua