Большая Энциклопедия Нефти и Газа. Растворимость углекислого газа в воде
Углекислый газ - Большая Энциклопедия Нефти и Газа, статья, страница 3
Углекислый газ
Cтраница 3
Углекислый газ находится в природе как в свободном состоянии, так и разнообразнейших соединениях. [31]
Углекислый газ представляет один из примеров газообразных веществ, давно превращенных во все три состояния. Для получения жидкого угольного ангидрида углекислый газ нужно подвергнуть давлению 36 атм. Жидкий СО2 бесцветен, не смешивается с водою, но растворяется в спирте, эфире и маслах при 0 ( давление около 3 5 атм. При обыкновенном давлении, жидкая СО2 сохраняется некоторое время ( имея t выше - 50), вследствие того, что для испарения требует значительного количества тепла ( скрытое тепло при 0 55 ед. Если же испарение совершается быстро с большой поверхности ( или при выкачивании), напр. Вода и ртуть, равно как и многие другие жидкости, замерзают от прикосновения со снегоподобною углекислотою. [32]
Углекислый газ, легко сгущаясь в жидкость, способен и довольно значительно растворяться в воде, спирте и других жидкостях. В спирте углекислый газ растворяется еще в большей мере, чем в воде, а именно, при 0 1 объем спирта растворяет 4 3 объема этого газа, а при 20 2 9 объема. Водные растворы углекислого газа, под давлением нескольких атмосфер, приготовляют в аптеках и на заводах искусственно, потому что вода, насыщенная углекислым газом, представляет средство, усиливающее пищеварение и утоляющее жажду. Для этой цели углекислый газ накачивают посредством нагнетательного насоса в закрытый сосуд, содержащий воду, а отсюда - распределяют в бутылки, употребляя особые приемы для быстрого и герметического их запирания. Так приготовляют разные шипучие напитки и искусственные шипучие вина. Содержание углекислого газа в воде имеет весьма важное значение в природе, потому что вода приобретает от СО2 свойство разрушать и растворять многие вещества, не изменяемые чистою водою; так, напр. Углекислая вода способствует разрушению многих каменных пород, извлекая из них известь, щелочи и др. Такой процесс совершался и продолжает итти в природе в огромных размерах. Каменистые породы содержат в себе окислы разных металлов, между прочим, окислы кремния и глиния, кальция и натрия. Углекислая вода растворяет оба последние, превращая в угольные соли. Собирающаяся в океане вода должна, по мере испарения углекислого газа, выделять осадки углеизвестковой соли, какие, действительно, и находятся всюду на поверхности земли в тех местностях, которые были некогда на дне моря. Содержание угольной кислоты в водном растворе дает возможность питания я произрастания водяным растениям. [33]
Углекислый газ, как вода, образовавшись с большим выделением тепла, очень прочен. Поэтому только немногие вещества способны отнимать кислород от СО2 - Однако, магний, калий и тому подобные металлы горят в - углекислом газе, выделяя уголь и образуя окиси. Хотя, как вода, углекислый газ весьма прочен, но все же при накаливании отчасти разлагается на окись углерода и кислород. [34]
Углекислый газ, при действии восстановителей, поглощая тепло ( или расходуя соответственное количество электричества), дает разные менее окисленные соединения ( особенно СО и соединения муравьиной кислоты, которая по составу СО НЮ), и в конце уголь ( чему отвечают гидраты углерода, напр. Металлы, подобные Na, № и Mg, при накаливании в СО2 горят и прямо дают уголь. [35]
Углекислый газ при комнатной температуре вызывает слабую коррозию только в присутствии влаги с образованием основных карбонатов меди; при высоких температурах образуется пленка окиси цинка. [36]
Углекислый газ при высоких температурах оказывает слегка окисляющее действие, но значительно более слабое, чем воздух. [37]
Углекислый газ при растворении в воде увеличивает ее вязкость, а при растворении в нефти - снижает. Такая особенность С02 способствует уменьшению фактора подвижности, росту коэффициента охвата пласта. [38]
Углекислый газ обильнее всего выделяется в начале процесса, а наиболее чистый горючий газ - при завершении его. [39]
Углекислый газ был первым между всеми другими газами противопоставлен воздуху под названием дикого газа алхимиком XVI в. [40]
Углекислый газ расходуется на синтез сложных органических веществ ( белков, углеводов, жиров), из которых состоят различные органы растений. Растения не только очищают воздух от углекислого газа и поддерживают постоянное количество кислорода в воздухе, но дают человеку и животным соединения углерода - органические вещества. Весь углерод в организмах животных и человека получен ими от растений в виде пищи. Растительные вещества ( древесина, крахмал и др.) обладают запасом скрытой химической энергии, могут взаимодействовать с кислородом, выделяя тепло и свет. Всю эту энергию растения получают от Солнца; энергия пищи и топлива - это энергия Солнца. Задача растениеводства - накопить возможно больше солнечной энергии в виде органического вещества. [41]
Углекислый газ удаляется дегазацией, поэтому процесс гидролиза можно довести до конца. [42]
Углекислый газ, очищенный от кислорода. [43]
Углекислый газ играет определенную роль в поглощении длинноволнового излучения и поддержании оранжерейного эффекта, повышающего температуру у поверхности Земли. Наблюдения и теоретические расчеты свидетельствуют о глобальном накоплении углекислого газа в связи со все увеличивающимися объемами сжигаемого топлива. [44]
Углекислый газ не токсичен, но относительно большая концентрация его в воздухе ( 10 - 15 %) снижает содержание кислорода в нем и вызывает обморочное состояние. [45]
Страницы: 1 2 3 4
Растворимость - углекислота - Большая Энциклопедия Нефти и Газа, статья, страница 1
Растворимость - углекислота
Cтраница 1
Растворимость углекислоты в воде при 25 ат и при температуре 12 С равна 21 6 объемам газа на 1 объем воды. Углекислота может быть почти полностью удалена в правильно сконструированных скрубберах при применении противотока. Остающийся один или меньше процент углекислоты удаляется одновременно с окисью углерода, как описано ниже. [1]
Растворимость углекислоты в воде быстро падает по мере повышения температуры воды. [2]
Растворимость углекислоты в воде под давлением, Журн. [3]
Приведена растворимость углекислоты при атмосферном давлении и достаточно длительном контакте воды с воздухом. [5]
Наиболее существенно снизить растворимость углекислоты во время опыта сжигания газа, когда парциальное давление углекислоты в бюретке велико. Мы успешно достигали этого, применяя раствор кислоты в воде. [6]
При низких значениях рН растворимость углекислоты, являющейся основным или даже единственным источником углерода для автотрофных прокариот, понижается, а растворимость некоторых ионов ( Cu2, Mo2, Mg2, Al3) возрастает и достигает уровней, токсичных для многих прокариот. Наоборот, при высоких значениях рН растворимость многих катионов ( Fe2, Ca2, Mg2, Мп2), необходимых клетке, резко понижается, они выпадают в осадок и, таким образом, становятся недоступными для организмов. [7]
Теоретически область применения рекарбонизации ограничена растворимостью углекислоты в воде, однако практически она ограничена в еще большей мере вследствие того, что затраты на перекачивание воды через насыщающее устройство ( эжектор, скруббер) значительно возрастают с увеличением необходимой концентрации углекислоты, так что этот метод по технико-экономическим соображениям может быть конкурентоспособным с подкислением лишь при небольшой щелочности добавочной воды и невысоком коэффициенте концентрирования солей. [8]
Из данных таблицы следует, что с повышением давления растворимость углекислоты в воде повышается, а с повышением температуры - падает. Это значит, что при очистке газа от углекислоты промывкой ее водой необходимо стремиться к снижению температуры процесса и повышению давления. [9]
Как это следует из табл. 5.2, влияние различных солей и кислот на растворимость углекислоты хотя и более заметно, чем в случае кислорода, но все же крайне незначительно. [10]
Равновесие между углекислотой, находящейся в водной фазе, и углекислотой воздуха зависит от величины коэффициента растворимости углекислоты. [11]
Изменение состава нефти при появлении второй жидкой фазы трансформирует ее свойства как растворителя, что сказывается не только на растворимости углекислоты но и на других свойствах нефтяной фазы. Меняется ход зависимости вязкости и давления насыщения нефтяной фазы от содержания углекислоты в омеси. Эти точки соответствуют массовому содержанию в смеси 19 4 углекислоты. [12]
Так как одна молекула метана при сгорании дает одну молекулу углекислого газа, то по количеству поглотившейся углекислоты определяют количество метана, пренебрегая растворимостью углекислоты в воде. [13]
При гниении и горении часть С02, поглощенного растениями, возвращается обратно в атмосферу. Растворимость углекислоты в воде зависит от температуры и давления. Летом, когда температура воды повышается, растворимость СО2 падает и часть ее улетучивается в воздух. Напротив, зимой при понижении температуры воды некоторое количество углекислого газа снова перемещается в водные бассейны. Но для растений как раз и важно повышение содержания С02 в воздухе в период вегетации. [15]
Страницы: 1 2 3
www.ngpedia.ru
Растворимость - углекислый газ - Большая Энциклопедия Нефти и Газа, статья, страница 4
Растворимость - углекислый газ
Cтраница 4
Растворимость в масле водорода, азота, воздуха с повышением температуры ( от 20 до 80 С) возрастает, растворимость кислорода слегка снижается, растворимость углекислого газа резко снижается. [46]
Учитывая, что скорость распространения звуковой волны в затрубном пространстве скважины обратно пропорциональна квадратному корню плотности газа, можно считать, что уменьшение плотности, обусловленное увеличением растворимости углекислого газа, в свою очередь вызывает увеличение скорости звука по мере восстановления уровня. [48]
Снижение скорости разложения амальгамы калия в 10 раз при повышении температуры метилового спирта от 20 до 64 - 65 С и менее резкое, но также ясно выраженное снижение скорости разложения амальгамы калия в этиловом и н-пропиловом спиртах при соответствующем повышении температуры связано со значительным уменьшением растворимости углекислого газа при приближении к температурам кипения спиртов. Для более высоко кипящих н-бу-тилового и н-октилового спиртов, по-видимому, повышение скорости процесса, связанное с ростом температуры, превышает снижение скорости в результате уменьшения растворимости углекислого газа. [50]
Могучим регулятором содержания в воздухе углекислого газа является вода океанов, морей, рек и озер, в которых его имеется во много раз больше, чем во всей атмосфере. Растворимость углекислого газа в воде зависит от температуры и давления: чем ниже температура и чем выше давление, тем больше может раствориться газа в воде. В летний период, когда температура воды повышается, заметное количество углекислого газа уходит в воздух. [52]
Могучим регулятором содержания в воздухе углекислого газа является вода океанов, морей, рек и озер, в которых его имеется в 4 раза больше, чем во всей атмосфере. Растворимость углекислого газа в воде зависит от температуры и давления: чем ниже температура и чем выше давление, тем больше может раствориться газа в воде. [53]
Измененные значения растворимости углекислого газа определены на основании этих величин, полученных экспериментально для этих фракций и характерных венгерских нефтей. [54]
Растворимость углеводородных газов в трансформаторном масле снижается с повышением температуры тем больше, чем выше растворимость данного газа в масле. При увеличении температуры снижается также растворимость углекислого газа в масле. [55]
При постоянном давлении по мере повышения температуры растворимость азота, кислорода и воздуха в топливе уменьшается. При повышении температуры до 204 С растворимость углекислого газа уменьшается, при температурах выше 204 С она несколько увеличивается. Растворимость кислорода в топливах была изучена до температуры 150 С. [57]
В дальнейшем закон Генри неоднократно подвергался проверке. Сеченова, который изучал, в частности, растворимость углекислого газа в воде и водных растворах солей. Ниже приведены данные о растворимости кислорода в воде при 25 С и сероводорода в анилине при 22 С. [59]
Растворимость углекислого газа в воде несопоставима с растворимостью аммиака. Однако в щелочной среде, которую приобретает вода при растворении аммиака, растворимость углекислого газа возрастает. Таким образом создаются благоприятные условия для взаимодействия этих газов. [60]
Страницы: 1 2 3 4 5
www.ngpedia.ru
Растворимость углекислого газа в воде
В широком диапазоне парциальных давлений (от 0,0005 до нескольких атмосфер) растворимость углекислого газа в воде подчиняется закону Генри, т. е. концентрация растворенного газа пропорциональна парциальному давлению углекислого газа над раствором. [c.353]
ЗАВИСИМОСТЬ РАСТВОРИМОСТИ УГЛЕКИСЛОГО ГАЗА В ВОДЕ ОТ ТЕМПЕРАТУРЫ [c.353]
ГТ.7.4. Растворимость углекислого газа в воде при низких парциальных давлениях газа [c.356]
Как было указано ранее, растворимость углекислого газа в воде при давлениях ниже 0,0005 ат не подчиняется закону Генри. Это обусловливается тем, что при таких давлениях часть растворенного газа, находящаяся в форме ионов бикарбоната, становится ощутимой, что следует учитывать при определении значения растворимости. [c.356]Данные о растворимости углекислого газа в воде при парциальном давлении 0,0003 ат (т. е. для обычного воздуха) представлены в табл. П.14. [c.357]
Коррозионная агрессивность водонефтяной эмульсии меняется в широких пределах в зависимости от состава водной фазы, ее соотношения с углеводородной фазой, состава и количества газообразных веществ. В пластовых условиях в нефти и пластовой воде растворено значительное количество газообразных предельных углеводородов, углекислого газа, сероводорода, кислорода. Коэффициент растворимости некоторых газов в воде при 20 ° С и давлении 0,1 МПа имеет, по М. Маскету, следующие значения [c.124]
На основании этих данных можно сделать общий вывод состав воды изменяется мало, изменения эти находятся в пределах точности проведенных анализов, качество воды при удовлетворительном сгорании природного газа в котлах, к которым подключены экономайзеры, не ухудшается вода не меняет цвета, не приобретает запаха, прозрачность ее не меняется. Содержание кислорода в воде, как и при любом другом методе нагрева, уменьшается, т. е. происходит частичная деаэрация воды, степень которой зависит от температуры воды и коэффициента избытка воздуха, определяющего парциальное давление кислорода в дымовых газах. Содержание свободного углекислого газа на выходе из контактного экономайзера, как правило, выше, чем в исходной воде. Соотношение содержания углекислого газа в воде на выходе и входе в значительной степени зависит от коэффициента избытка воздуха в дымовых газах, определяющего парциальное давление углекислого газа, и температуры воды, с увеличением которой растворимость углекислого газа уменьшается. [c.129]
Растворимость карбоната кальция в чистой воде определяется рядом факторов, но главным образом присутствием растворенного углекислого газа. В воде углекислый газ может быть в следующих формах [c.22]
Растворимость бикарбонатов зависит от наличия в воде углекислого газа, количество которого прямо пропорционально его парциальному давлению над раствором. При высоких парциальных давлениях углекислого газа в воде может содержаться значительное количество бикарбонатов. Снижение давления вызывает выделение углекислого газа, что в свою очередь может привести к выпадению осадков. [c.8]
В сточных водах имеются растворимые газы сероводород, углекислый газ, кислород, азот и др., общее содержание которых может достигать 0,09 mVm воды. Растворенные в воде газы влияют на физико-химические свойства воды. Кислые газы оказывают влияние на величину pH, которая может понижаться от 6,9 до 4,0. При транспортировке и хранении воды, которая содержит h3S и СО2, pH увеличивается вследствие выделения сероводорода и углекислого газа в железосодержащих водах pH уменьшается в результате окисления и гидролиза солей железа. [c.149]
Если эту воду довести до кипения, то вследствие падения растворимости газа происходит практически полное удаление углекислого газа, а pH воды становится примерно равным pH исходной воды. Результаты этих испытаний (четыре опыта) приведены в табл. V-4. Таким образом, при дальнейшем нагреве воды после контактного экономайзера, например в термических деаэраторах, возможно полное удаление углекислого газа из воды. [c.129]
V Кислород является коррозионным агентом, поэтому возможно полное удаление его из воды, — одна из центральных задач водно-химического режима любого энергообъекта. Дзот — инертный газ, не участвующий в каких-либо процессах, вредных для энергетического оборудования. Углекислый газ, в отличие от кислорода и азота, химически взаимодействует с водой с образованием угольной кислоты. Последняя частично диссоциирует на ионы Н+ и НСО , которые в свою очередь вступают в химическое взаимодействие с ионами других веществ, растворенных в воде. В связи с этим углекислый газ обладает весьма высоким коэффициентом растворимости концентрация его в природных водах колеблется в довольно широких пределах. [c.34]
Температура в "С Концентрация диссоциированного углекислого газа в мг/л Растворимость в см в 1 л воды [c.356]
П.9.2. Растворимость карбоната кальция в воде и водных растворах углекислого газа [c.361]
Рис. п.6. График зависимости растворимости карбоната кальция в воде при 25° С от величины давления углекислого газа [c.363]
Данные о растворимости карбоната кальция в воде при 25° С и различных парциальных давлениях углекислого газа представлены в табл. П. 17. [c.363]
Данные настоящего раздела показывают, что растворимость карбоната кальция в воде при 10° С в равновесии с воздухом составляет примерно 75 мг/л. Однако природные воды имеют большую величину карбонатной жесткости. Вода рек и артезианских скважин имеет карбонатную жесткость 150 мг/л и более, но они не ведут себя как пересыщенные растворы. Очевидно, что такая вода содержит большее количество углекислого газа. [c.363]
Наибольший интерес в технологии обработки воды представляют вопрос о растворимости гидроокиси магния в воде при температурах от 0° до точки кипения и влияние углекислого газа на растворимость гидроокиси и карбоната магния в воде. [c.367]
Скорость коррозии цинка в дистиллированной воде составляет 2,0—2,2 г/ (м сутки) после более длительной выдержки она уменьшается примерно вдвое. Из-за незначительной растворимости гидроокиси цинка возможно образование защитных пленок, допускающих диффузию углекислого газа (в противоположность коррозии свинца в дистиллированной воде, когда образование карбонатов происходит в растворе, а не на поверхности металла). [c.229]
Наиболее распространенными в природных водах газами являются азот, кислород и углекислый газ, из которых последние два являются коррозионно агрессивными. Растворимость газов в воде зависит от температуры воды и парциального давления данного газа над нею. [c.25]
Наибольшая растворимость кислорода воздуха в воде не превышает 0,001%, а растворимость углекислого газа и сероводорода значительно выше. Поэтому целесообразно дегазацию воды производить аэрацией. [c.109]
В книге, выпущенной N. А. С. Е. и А. Р. Г [1], отмечается, что важными факторами, влияющими на растворимость углекислого газа, являются давление, температура и состав воды. Растворимость увеличивается с давлением и уменьшается с температурой, а многие растворенные минеральные соли могут поддерживать pH водных растворов постоянным. [c.190]
Мочевина (карбамид). Мочевина получается при взаимодействии аммиака и углекислого газа в виде крупных, бесцветных, тонких кристаллов плавится при 132—133° Мочевина хорошо растворима в воде и спиртах (метиловом и этиловом) и в жидком аммиаке. Растворы мочевины в воде имеют нейтральную реакцию. [c.26]
Растворимость газов в нефти в 10 раз выше, чем в воде. Наиболее агрессивные составляющие водонефтяных эмульсий — это сероводород и углекислый газ. Поэтому введена классификация нефтяных скважин содержащие и не содержащие HjS и Oj. [c.124]
Для очистки газа от сероводорода используют моноэтаноламин (МЭА), ди-этаноламин (ДЭА) и триэтаноламин (ТЭА). Они хорошо растворимы в воде, и поэтому их применяют в виде водных растворов. При температурах 40—80 °С они хорошо поглощают сероводород, а при температурах 110—140 °С выделяют его. Наиболее распространена очистка от кислых компонентов МЭА и ДЭА. Растворы эти имеют pH =12,7, сами по себе они не агрессивны. Коррозионная агрессивность увеличивается по мере насыщения кислыми компонентами, повышения температуры и соответствующего снижения pH. Наиболее сильная коррозия как углеродистых, так и нержавеющих сталей, особенно в местах сварки, наблюдается при температуре, близкой к 100 °С. Наличие чистого сероводорода в растворах этаноламинов делает коррозионную агрессивность их ниже, чем в совокупности с углекислым газом. При этом общее содержание кислых газов в растворах этаноламинов не должно превышать 0,3—0,4 моля газа на 1 моль амина, особенно, если используют оборудование из углеродистых сталей. Превышение содержания кислых компонентов может привести к пересыщению раствора этаноламина, выделению их и, соответственно, резкому усилению коррозионных процессов. [c.174]
Важным методом защиты является обработка среды с целью снижения ее агрессивности. В водных средах одним из основных окислителей является растворенный кислород. Снижение его концентрации проводят путем нагрева воды при пониженных давлениях, барботирования воды инертным газом, введения восстановителей (гидразин, сульфит натрия), пропускания воды через железные стружки и т. д. [471. В ряде случаев увеличение концентрации кислорода позволяет перевести металл в пассивное состояние. Этот прием применяется при защите теплообменной аппаратуры на атомных станциях [19 ]. Углекислый газ, растворимый в воде, понижает pH раствора и увеличивает агрессивность среды. Его концентрацию также снижают путем кипячения воды. [c.48]
Анализ растворимости отдельных газов, входящих в состав продуктов сгорания, свидетельствует о том, что хорошо растворяется в воде лишь углекислый газ, а все остальные газы растворяются весьма слабо. Как известно, согласно закону Генри, справедливому и для реальных газов, особенно при низких концентрациях растворенных газов и при малой их растворимости, количество растворенного газа пропорционально его парциальному давлению. [c.82]
Растворенными в природной воде газами являются кислород, азот и углекислый газ. Их растворимость в воде определяется ее температурой и парциальным давлением газа в атмосфере над поверхностью воды. Источником появления в природных водах углекислого газа также являются биохимические процессы окисления органических веществ в водоемах и в почве, через которую вода поступает в водоем. [c.92]
Состав воды в результате магнитной обработки не меняется. Изменяется структура воды, ее свойства (вязкость, поверхностное натяжение, магнитная восприимчивость, диэлектрическая проницаемость, растворимость в воде углекислого газа, кислорода, теплоты растворения веществ и др.), возникают многочисленные зародыши кристаллов, поверхность которых намного превышает площадь поверхностей нагрева. Эти зародыши кристаллов затем при нагреве, в связи с понижением растворимости накипеобразователей, служат центрами кристаллизации и предопределяют выделение накипеобразователей в виде шлама. [c.410]
На практике обычно вода соприкасается не с каким-либо газом, а со смесью газов. При этом растворимость каждого газа в воде будет зависеть от парциального давления P его в смеси. Если над водой имеется смесь водяных паров PhjOi азота Pn , кислорода Ро и углекислого газа Рсо , то, используя закон Дальтона, уравнение (4.37) можно записать для растворимости, например, О2 в воде [c.143]
Практически в большинстве случаев приходится иметь дело не с одним каким-либо газом, а со смесью нескольких газов и прежде всего с воздухом, представляющим собой смесь азота, кислорода, углекислого газа, паров воды и в незначительных количествах других газов. Вероятность проникновения молекул кислорода в воду будет в этих условиях, как и прежде, тем больше, чем больше этих молекул будет в единице объема пространства над водой, независимо от количества молекул других газов, т. е. опять будет действовать тот же закон Г енри — Дальтона. Но давление смеси газов слагается из давлений отдельных газов, определяемых соответственно числом молекул каждого газа. При этом доля общего давления такой смеси газов, приходящаяся на отдельный газ, называется его парциальным давлением. Таким образом, обобщая закон Генри — Дальтона и для смеси газов, следует сказать, что растворимость газов пропорциональна их парциальному давлению. [c.19]
Минерализация грунтовых вод. Общая минерализация грунтовых вод может изменяться в широких пределах от 10 мг/л до 349 г/л [И]. При минерализа1щи до 1 г/л солей (до ОД %) грунтовые воды относятся к пресным, минерализация от 1 до 10 г/л (от 0,1 до 1 %) характеризует солоноватые, от 10 до 50 г/л — соленые воды, а при содержании солей от 50 до 400 г/л (от 5 до 40 %) воды относятся к рассолам. В почвенной воде растворены газы - СО2, Ог- Наибольшую растворимость, превышающую растворимость кислорода, при прочих равных условиях имеет углекислый газ. [c.43]
Считается, что причиной такой высокой коррозионной активности Oj может быть по сравнению с другими газами (например, кислородом, азотом) растворимость в воде. Растворяясь в воде в значительных количествах, углекислый газ понижает ее pH, в результате чего коррозионная активность раствора резко растет. Установлено также резкое повышение коррозионной активности сырьевого газа с повышением парциального давления СО2, что может ыть объяснено повышением концентрации его в воде. Некоррозионно-активным считается газ при парциальном давлении p o2= S-10 Па. [c.143]
При полном сгорании бессернистого газа дымовые газы состоят из углекислого газа СО2, азота N2, кислорода О2, водяных паров Н2О. При наличии в газе серы, что весьма нежелательно, продукты сгорания содержат сернистый SO2 и серный SO3 ангидриды. При неполном сгорании газа образуются продукты химического недожога оксид углерода СО, водород Нд и метан СН4. При серьезных нарушениях режима горения и неудовлетворительной конструкции горелочного устройства могут образовываться сажа, формальдегиды, а также канцерогенное вещество 3,4-бенз (а) пирен. В продуктах сгорания любого вида топлива, в том числе и природного газа, всегда имеется небольшое количество оксидов азота. Естественно, что при контакте с водой возможно растворение в ней какой-то части газов, входящих в состав продуктов сгорания. Количество этих газов зависит от степени растворимости их в воде, в свою очередь зависящей от парциального давления соответствующего газа у водяной пленки и температуры воды. [c.126]
mash-xxl.info
Углекислый газ, растворимость - Справочник химика 21
При нагревании водного раствора углекислого газа растворимость газа понижается, СО2 выделяется из раствора, и равновесие смещается влево. [c.284]
При прокаливании карбоната кальция образуются твердый оксид кальция, который растворяется в воде и образует с избытком углекислого газа растворимый гидрокарбонат кальция [c.167]Важным методом защиты является обработка среды с целью снижения ее агрессивности. В водных средах одним из основных окислителей является растворенный кислород. Снижение его концентрации проводят путем нагрева воды при пониженных давлениях, барботирования воды инертным газом, введения восстановителей (гидразин, сульфит натрия), пропускания воды через железные стружки и т. д. [471. В ряде случаев увеличение концентрации кислорода позволяет перевести металл в пассивное состояние. Этот прием применяется при защите теплообменной аппаратуры на атомных станциях [19 ]. Углекислый газ, растворимый в воде, понижает pH раствора и увеличивает агрессивность среды. Его концентрацию также снижают путем кипячения воды. [c.48]
Применение диметилформамида для извлечения ацетилена из газовой смеси, содержащей значительные количества этилена, представлялось особенно целесообразным, так как разница в растворимости этилена и ацетилена значительно больше у диметилформамида, чем у воды. По этой же причине целесообразно применять диметил-формамид и при выделении ацетилена из газов окислительного пиролиза, содержащих углекислый газ, растворимость которого в воде велика. [c.208]
Газы играют при флотации, как известно, двоякую роль, вынося подготовленные частицы минералов на поверхность и взаимодействуя с минералами и реагентами. Состав атмосферных газов — 78,1% азота, 20,96% кислорода и 0,04% углекислого газа. Растворимость в воде кислорода (при 15° Си нормальном атмосферном давлении) составляет 10,4 мг/л, а углекислоты при ее обычном парциальном давлении в атмосфере - 0,8 мг/л. Растворимость газов в воде уменьшается с повышением температуры. увеличивается с повышением давления. Повторные изменения последнего во флотируемой пульпе в процессе ее перемешивания приводят к перемежающемуся растворению газов и выделению их из раствора непрерывному обогащению пузырьков углекислотой и до определенного предела кислородом за счет азота [17]. В табл. 3 приведены расчетные результаты применения содержащих воду газов при их многократном растворении в воде и выделении из раствора, подтверждающие это положение. [c.16]
При нагревании карбонат кальция разлагается без плавления па окись кальция и углекислый газ Растворимость его в воде незначительна кальцита Имг/л, арагонита 15лгг/л (18° С). В присутствии углекислого газа растворимость карбоната кальция резко увеличивается вследствие образования растворилгого в воде бикарбоната кальция. Карбонат кальция легко растворяется в кислотах с выделением углекислого газа. В органических растворителях нерастворим. [c.13]
Гидроокись магния М (0Н)2 выделяется при действии щелочей на растворы солей магния в виде объемистого студенистого осадка. Гидроокись магния — слабое основание, легко растворяется в кислотах, из воздуха поглощает углекислый газ. Растворимость ее в воде зависит от степени старения, для свеже-осажденной гидроокиси магния составляет 7,0-10 моль л, для подвергшейся сильному старению 1,61-10 молъ1л при 18 С [735]. Произведение растворимости М (0Н)2 составляет 0,55 Ю при 25 С [854]. При прокаливании М (0Н)2 постепенно переходит в МдО последние следы воды из М (0Н)2 удаляются с большим трудом. При 1000° С Мд (0Н)2 обезвоживается полностью в течение 1 часа [709]. [c.10]
Так как ПФС не растворяются в воде, для использования их в качестве искусственной крови готовят эмульсию. Важной особенностью ПФС является крайне высокая по сравнению с другими органическими соединениями растворимость в них газов В табл. 5.2 приведены растворимости кислорода и углекислого газа растворимость кислорода составляет 40 - 50 об.%, что почти в 20 раз выше его растворимости в воде и сыворотке крови. Растворимость кислорода в эмуль сиях, используемых в качестве искусственной крови, которые будут описаны ниже, составляет 8—9 об,%, что в 4 раза выше его растворимости в воде и сыворотке крови. [c.450]
Реактив представляет собой белые игольчатые кристол ш или кристаллический порошок, без запаха. При осторожном нагревании выше 80° сублимируется при более сильном нагревании выше температуры плавления - разлагается на (Ьенол и углекислый газ. Растворимость в 100 г воды 0,16 г (4°) 2,6 г (78°) 6.6 г (98 ) абс.спирта 49,6 г (15°) эфира 50,5 г (15°). Малорастворим в бензоле. Летуч о пара . воды. [c.42]
chem21.info
Растворимость - углекислота - Большая Энциклопедия Нефти и Газа, статья, страница 3
Растворимость - углекислота
Cтраница 3
При рекарбонизации щелочность добавочной воды не снижается, поэтому концентрации равновесной углекислоты, пропорциональные ( Сад и / JK. C, могут достигать значительных величин. При высоких значениях Щл, Сад и kK c концентрации углекислоты, необходимые для равновесия, достигают даже предела растворимости углекислоты в оборотной воде при данной температуре. Значения kK с, соответствующие этому состоянию, обусловливают теоретический предел применимости метода рекарбонизации. При больших значениях коэффициента концентрирования уже не представляется возможным растворить в оборотной воде необходимое для равновесия количество углекислоты, и в системе будет наблюдаться распад бикарбонатов. [31]
Обогащение природных вод свободной углекислотой происходит в основном за счет биохимических процессов, протекающих в воде и в грунтах, с которыми эта вода приходит в соприкосновение. Что касается свободной углекислоты, находящейся в поверхностных водах, то только в чистой воде концентрация ее соответствует равновесию с атмосферой, в; большинстве же случаев она значительно выше. Концентрация свободной углекислоты в подземных водах обычно во много раз больше количества, отвечающего равновесию с атмосферой. Растворимость углекислоты в воде при парциальном давлении СОг, равном 105 Па ( 1 кгс / см2) при / 25 С, равна около 1450 мг / кг. [32]
Ежегодно на всей поверхности земного шара ( 150 млн. км2 суши и 360 млн. км2 океанов и морей) растения синтезируют около 400 млрд. т органических веществ. Если бы не было пополнения углекислого газа в атмосфере, то примерно за четыре года он бы полностью связался зелеными растениями. При гниении и горении часть С02, поглощенного растениями, возвращается обратно в атмосферу. Растворимость углекислоты в воде зависит от температуры и давления. Летом, когда температура воды повышается, растворимость С02 падает и часть ее улетучивается в воздух. Напротив, зимой при понижении температуры воды некоторое количество углекислого газа снова перемещается в водные бассейны. Но для растений как раз и важно повышение содержания С02 в воздухе в период вегетации. [33]
Записывают положение уровня LU по шкале бюретки и после этого, открыв кран 10, снижают уровень в кольцевом пространстве до нижних делений бюретки; уровень в бюретке в это время будет располагаться выше. Эта операция необходима для того, чтобы при выделении углекислоты давление в системе не превышало атмосферное, благодаря чему уменьшается растворимость углекислоты в воде. Затем вращательным движением реакционной колбы опрокидывают находящийся в ней тигелек, кислота вступает в реакцию с содержащимися в породе карбонатами, выделяется углекислый газ. Последний вытесняет воду из бюретки, вследствие чего уровень в ней снижается. Для того чтобы вся порода прореагировала с кислотой, необходимо периодически взбалтывать реакционную колбу. [34]
Прибор его состоит из маленькой колбочки, с притертой пробкой, сквозь которую проходят две трубки. Одна из них припаяна к маленькой капелькой воронке, другая при помощи капиллярной трубки соединена с бюреткой, наполненной водой. Ход анализа следующий: в колбочку вливается 25 см3 насы-щенног о раствора хамелеона, затем весь прибор соединяется с бюреткой, и в капельную воронку вводится определенное количество исследуемой кислотной смолы. При этом часть воздуха, конечно, вытесняется в бюретку. Быстро смыв небольшим количеством воды воронку, кран закрывают и приводят уровень воды в бюретке к нулю. При встряхивании и нагревании колбочки окисление совершается довольно быстро, причем образующаяся углекислота попадает в бюретку. Последние количества ее вытесняют, наполняя колбочку и часть капилляра водой, для чего пользуются капельной воронкой. Снова приведя уровень к 0 и 760 мм, отсчитывают объем углекислоты, из которого выводят вес содержащегося в ней углерода. Принято считать, что 75 г углерода соогветствует 100 г органического вещества в кислотной смоле. В такой форме анализ не может претендовать на большую точность, как вследствие растворимости углекислоты в воде, так и вследствие неодинаковой скорости окисления органических веществ. [35]
Страницы: 1 2 3
www.ngpedia.ru
Дегазация углекислого газа / О. Г. Сорохтин: «Развитие Земли» / Земля
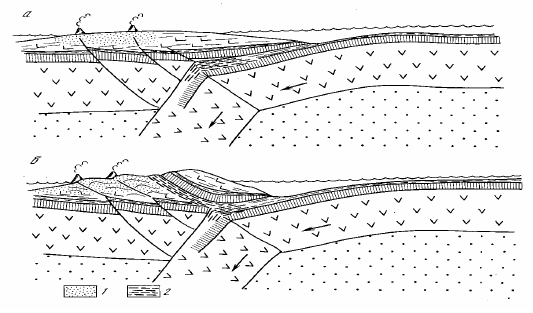
Рисунок 94. Происхождение офиолитовых покровов и парных поясов метаморфизма в островных дугах:1 — область высокотемпературного метаморфизма низкого давления; 2 — глаукофановые сланцы — продукты низкотемпературного метаморфизма высокого давления.
В качестве одного из граничных условий примем, по А. Б. Ронову и А. А. Ярошевскому (1978), что в карбонатах земной коры связано около 3,91×1023 г CO2, кроме того, в коре содержится ещё около 1,95×1022 г органического углерода (Cорг). С этим количеством Cорг до его восстановления биологическими процессами было связано 5,2×1022 г кислорода. Следовательно, общая масса дегазированного из мантии CO2 составляет m(CO2) ≈ (3,91 + 0,72)×1023 = 4,63×1023 г.
Значительно сложнее определить содержание углерода (или CO2) в мантии Земли. По имеющимся экспериментальным данным, в высокотемпературных фракциях отгонки летучих компонентов в кислородной атмосфере из закалочных стёкол толеитовых базальтов океанических рифтовых зон обычно содержится от 20 до 170 г/т углерода мантийного происхождения с изотопными сдвигами около — 5 ‰, (Watanabe et al., 1983; Sakal et al., 1984; Exiey et а1., 1986). К сожалению значительный разброс эмпирических определений не позволяет уверенно оценить среднее содержание углерода и CO2 в мантии. Однако следует учитывать, что часть мантийного углерода находится в атомарном состоянии, рассеяна по кристаллическим решёткам силикатов (Watanabe et а1., 1983) и поэтому не является летучим компонентом базальтовых расплавов. Следовательно, содержание углерода в газовой фазе CO2 базальтовых выплавок может оказаться заметно меньшим приведённых здесь значений суммарных концентраций углерода. Для определённости примем содержание подвижного углерода в мантии около 30 г/т, или в пересчёте на углекислый газ 110 г/т (1,1×10-4). В этом случае в мантии содержится около m(CO2) ≈ 4,48×1023 г CO2.
Теперь можно оценить суммарную массу CO2 в Земле (с пересчётом Cорг в CO2), что составит m(CO2) ≈ 9,11×1023 г. В этом случае по уравнению (30) находим χ(CO2) ≈ 0,71. По уравнениям (29) и (30) легко построить кривые скорости дегазации углекислого газа из мантии (рис. 118) и накопления CO2 во внешних геосферах Земли — в атмосфере, гидросфере и земной коре (рис. 119).
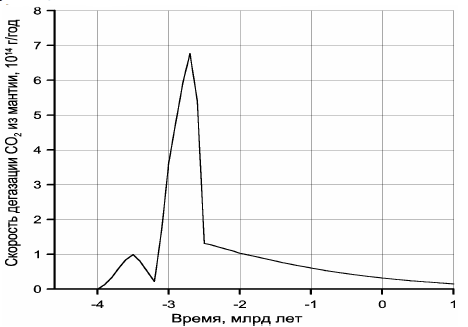
Рисунок 118. Скорость дегазации углекислого газа из мантии
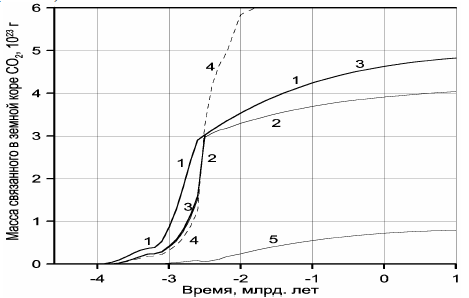
Рисунок 119. Масса углекислого газа связанная в земной коре:1 — масса дегазированного из мантии CO2; 2 -накопление массы углекислого газа к карбонатном резервуаре земной коры; 3 — суммарная масса связанного углекислого газа (в карбонатном и биогенном резервуарах), в масштабе графиков кривые 1 и 3 в протерозое и фанерозое сливаются воедино; 4 — масса связанной в земной коре воды; 5 — масса органического углерода в пересчёте на CO2.
Обращает на себя внимание резкое отличие кривой дегазации углекислого газа от дегазации воды (см. рис. 113). Это связано с меньшей теплотой образования воды и её диссоциацией на металлическом железе в процессе зонной дифференциации земного вещества в архее. Пик скорости дегазации CO2 приходится на время максимальной тектонической активности Земли, около 2,7 млрд лет назад, тогда как с максимальной скоростью дегазация воды происходила около 2,5 млрд лет назад, т.е. только после образования у Земли плотного ядра и перехода процесса дифференциации земного вещества от механизма зонной плавки к более спокойному бародиффузионному механизму дифференциации мантийного вещества.
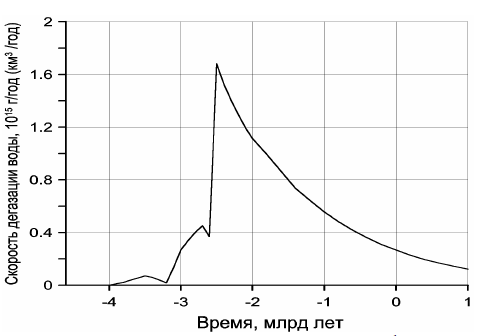
Рисунок 113. Скорость дегазации воды из мантии в гидросферу Земли
Если бы весь дегазированный углекислый газ сохранялся в атмосфере, то его парциальное давление сейчас достигало бы 90-100 атм, т.е. было бы таким же, как и на Венере. К счастью для жизни на Земле, одновременно с поступлением CO2 в атмосферу происходило его связывание в карбонатах. Но для протекания этой реакции необходима вода в жидкой фазе, так как только в этом случае гидратация силикатов сопровождается поглощением CO2 с образованием карбонатов:
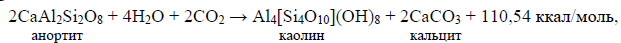
Формула 47. Связывание углекислого газа в карбонатах: анортит — каолин — кальцит
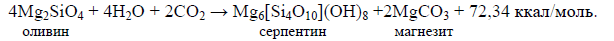
Формула 48. Связывание углекислого газа в карбонатах: оливин — серпентин — магнезит
По этой причине существенное влияние на эволюцию парциального давления углекислого газа в атмосфере оказала история развития океанов на Земле (см. рис. 112).
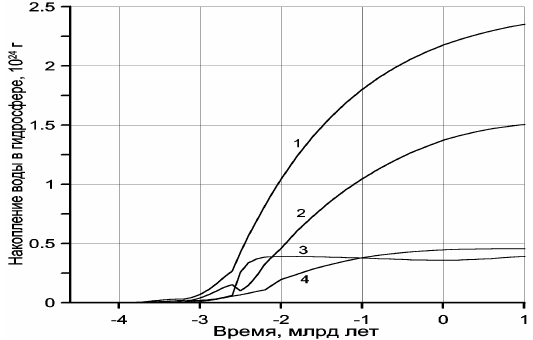
Рисунок 112. Накопление воды в гидросфере Земли:1 — суммарная масса дегазированной из мантии воды; 2 — масса воды в океане; 3 — масса воды, связанная в океанической коре; 4 — масса воды, связанная в континентальной коре.
Как видно из типовых реакций (47) и (48), на каждые две молекулы CO2, связываемые в карбонатах, расходуются четыре молекулы воды на гидратацию породообразующих минералов океанической или континентальной коры. Отсюда следует, что при избытке углекислого газа в атмосфере и гидросфере практически все реакции гидратации горных пород будут сопровождаться связыванием CO2 в карбонатах, причём на единицу массы связанной в породах воды будет приходиться приблизительно 1,22 массы углекислого газа. При недостатке CO2 гидратация части силикатов будет протекать без связывания углекислого газа, например, по реакциям типа (38).
Суммарная масса воды, связанная в породах земной коры, нами была оценена выше — это сумма кривых 3 и 4 на рис. 112, частично воспроизведённая и на рис. 119 (кривая 4). Отсюда можно рассчитать и массу углекислого газа, который мог быть связан в карбонатах. Поскольку жизнь в океане лимитируется содержанием фосфора в океанической воде, а растворимость фосфора сравнительно невелика (Шопф, 1982), то можно предполагать, что абсолютная масса органических веществ в океане пропорциональна его массе. Поэтому массу органического углерода в пересчёте на CO2 в архее и протерозое можно оценить, считая, что она в первом приближении пропорциональна массе воды в Мировом океане, изображённой на рис. 112 кривой 2.
На рис. 119 приведено сравнение массы дегазированного из мантии углекислого газа (кривая 1) с массой CO2, связанного в карбонатах (кривая 2), а также с суммарной массой CO2 в карбонатном и биогенном резервуарах (кривая 3). Отдельно воспроизведена кривая накопления органического углерода в океанических осадках, пересчитанная на массу CO2 (кривая 5). Как видно из рис. 119, в протерозое и фанерозое почти весь дегазированный из мантии углекислый газ оказался связанным в карбонатном или биогенном (в форме Cорг) резервуарах, тогда как массу CO2, находящуюся в атмосфере и растворенную в гидросфере этих эпох, в масштабе приведённых на рисунке графиков показать не удаётся. Иная ситуация существовала в архее. Из-за малого количества воды в архейских океанах масса связанного CO2 в то время была существенно меньшей, чем масса дегазированного из мантии углекислого газа. Отсюда следует, что в архее заметная часть углекислого газа должна была находиться в атмосфере и быть растворенной в водах океана.
Помимо связанного в породах CO2 часть углекислого газа (в форме анионов HCO3-) всегда оказывается растворенной в водах океана. Учёт этой части CO2 проведём по методике, предложенной Н. О. Сорохтиным (2001). Для этого учтём, что растворимость углекислого газа в воде, согласно закону Генри, прямо пропорциональна его парциальному давлению в атмосфере:
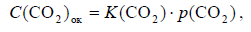
Формула 49. Растворимость углекислого газа в воде, согласно закона Генри
где C(CO2)ок — концентрация углекислого газа в океанических водах; K(CO2) — константа Генри; p(CO2) — парциальное давление углекислого газа в атмосфере. Но растворимость газов в воде экспоненциально зависит от её температуры Т:
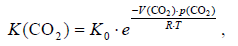
Формула 50. Растворимость газов в воде в зависимости от температуры
где V(CO2) — парциальный мольный объем растворенного в воде CO2 в бесконечно разбавленном растворе; R = 1,987 кал/моль град; K0 — нормировочный коэффициент. Эмпирическая зависимость показателя константы Генри от температуры приведена в Справочнике термодинамических величин (Наумов и др., 1971). Для нахождения нормировочного коэффициента K0, предварительно надо найти эффективное значение константы Генри для современного океана. Учитывая, что в современном океане растворено приблизительно 1,4×1020 г CO2, тогда как парциальное давление этого газа в атмосфере составляет 0,46 мбар, по выражению (49) можно оценить эффективное значение коэффициента Генри для океана Kok ≈ 0,213. Учитывая, что средняя температура современной Земли равна 288 К (14,8 °С), находим значение нормировочного коэффициента в выражении (50) K0 = 0,803.
Теперь легко найти и массу углекислого газа, растворенного в водах океана:
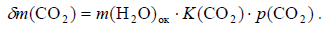
Формула 51. Масса углекислого газа, растворённого в водах океана
В позднем архее около 2,7 млрд лет назад масса растворенного в океане углекислого газа, судя по расчётам (разность кривых 1 и 3 на рис. 119), достигала 10 г при массе воды в океане того времени около 1,32×1023 г (см. кривую 2 на рис. 112). Отсюда видно, что концентрация растворенного углекислого газа в океанических водах тогда достигала 40 %! Это означает, что при средней температуре океанов около 55 °С (см. ниже), океанические воды в позднем архее были горячими и кислыми, а следовательно, весьма агрессивными растворителями многих веществ.
На рис. 120 приведён рассчитанный Н. О. Сорохтиным (2001) график эволюции парциального давления углекислого газа в атмосфере с учётом его частичного растворения в океанических водах. Подчеркнём, что условия для возникновения углекислотной атмосферы существовали только в архее. В протерозое и фанерозое подавляющая часть углекислого газа оказалась связанной в карбонатах и органическом веществе, а в атмосфере и гидросфере сохранилась лишь его малая часть, определяемая законом действующих масс реакций связывания CO2 в горных породах и биосфере.
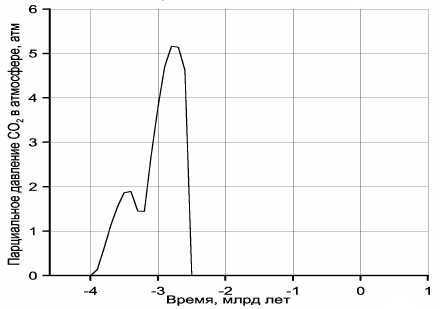
Рисунок 120. Эволюция парциального давления углекислого газа в земной атмосфере(в протерозое и фанерозое парциальное давление CO2 не превышало 1 мбар и в масштабе графика неразличимо).
www.gemp.ru