Растворимость углекислого газа в воде и другие вопросы. Растворяется углекислый газ в воде
Растворимость углекислого газа в воде и другие вопросы
Уважаемый Олег Мосин! Прочитал Вашу статью «Вода без воздуха (газов)» в www.o8ode.ru/article/answer/voda_bez_vozduha_gazov.htm. Разрешите задать Вам вопрос лично. Я биолог с некоторым знанием основ химии. Вопрос касается растворимости углекислого газа в воде. Сущности этого процесса. Часть растворенного газа взаимодействует с водой с образование угольной кислоты, которая диссоциирует на гидрокарбонат и ионы водорода. Зная константу диссоциации, содержание растворенного диоксида углерода, мы можем рассчитать показатель кислотности и содержание самой угольной кислоты – оно ничтожно.
Вопрос: что удерживает остальную часть диоксида углерода в воде, ведь он не находится газовой фазе, иначе бы сразу улетучился? Нигде не могу найти ответа на этот вопрос: что удерживает собственно диоксид в воде? Может он образует с молекулами воды водородные связи? Поскольку водородные связи могут образовываться между атомом водорода, связанным с атомом электроотрицательного элемента, и электроотрицательным элементом, имеющим свободную пару электронов (О,F,N)?
И еще один вопрос. При рН=3 реакция диссоциации смещается влево, угольная кислота разлагается на углекислый газ и воду. А растворенный диоксид? Все эти вопросы связаны с процессом дыхания у насекомых и взрывообразным выделением углекислого газа из жидкости трахеол. С этими вопросами напрямую связано действие карбоангидразы катализирующей процесс связывания диоксида с водой и образования гидрокарбоната. Но мне не известно, чтобы одна из многочисленных изоформ карбоангидразы катализировала обратный процесс. В случае с карбогемоглобином все ясно – эффект Бора. Но гидрокарбонат поступающий в альвеолы из плазмы крови, что индуцирует процесс связывания с протоном? Какова кинетика этого процесса?
Буду очень Вам признателен, если Вы внесете ясность в эти вопросы или уточните направление поиска ответов.
С уважением, Владимир.
_________________
Здравствуйте, Владимир.
Вообще, насколько я знаю, растворимость углекислого газа в воде выше для всех газов, она примерно в 70 раз выше растворимости кислорода и в 150 раз выше растворимости азота при коэффициенте адсорбции углекислого газа водой 12.8, что соответствует растворимости 87 мл газа в 100 мг воды. Конечное, можно было бы предположить, например, что СО2 каким-то образом встраивается внутрь замкнутых кластеров воды и удерживается в них, как это имеет место в ….. Но вряд ли такой процесс может иметь место. Растворимость газов в воде различна и зависит как от внешних факторов - температуры и давления, так и от природы самого газа и его способности вступать в химическую реакцию с водой (как это происходит в случае с углекислым газом, который растворяется в воде за счёт химической реакции с образованием угольной кислоты, в свою очередь диссоциирующей на ионы Н+ и НСО-3). Но с другой стороны только 1% СО2, находящегося в водном растворе, присутствует в нём в виде Н2СО3. На это несоответствие обратили внимание многие исследователи. Поэтому для удобства расчётов химических уравнений, рКа и рН принято считать, что весь СО2 реагирует с водой.
С точки зрения химической кинетики процесс растворения углекислого газа в воде достаточно сложен. Когда СО2 растворяется в воде, то устанавливается равновесие между угольной кислотой Н2СО3, бикарбонатом НСО3- и карбонатом СО3-.
h3O + CO2 ↔* h3CO3 ↔ H+ + HCO3- ↔ H+ + CO32-
Расчёт константы ионизации в данном случае проводится по нижеследующей схеме:
1) h3CO3 ↔ H+ + HCO3-
2) HCO3- ↔ H+ + CO32-
Константа первой стадии ионизации равна рКа1 = 4,4 x 10-7,
Константа второй стадии ионизации равна рКа2= 5,6 x 10-11,
Поскольку в растворе угольной кислоты обе стадии ионизации находятся в состоянии равновесия, можно скомбенировать первую и вторую константы ионизации рКа1 и рКа2, умножив их:
рКа1 x pКа2 = 4,4 x 10-7 x 5,6 x 10-11 = 2,46 x10-17
Баланс между углекислым газом, бикарбонатом и карбонатом зависит от pH: здесь действует принцип Ле Шателье - наличие в растворе ионов водорода сдвигает щелочную реакцию среды и кислую сторону (рН до 5,5). И наоборот удаление протонов из системы смещает равновесие реакции влево, когда углекислый газ восполняется из карбоната и бикарбоната. Таким образом, при низком значении pH, в системе преобладает углекислый газ, и фактически ни бикарбоната, ни карбоната не образуется, тогда как при нейтральном значении pH, бикарбонат доминирует над СО2 и Н2CO3. И только при высоком pH, преобладает карбонат.
Карбоангидраза катализирует процесс гидратации СО2 и дегидратации СО2 (примерно в 100 раз).
Насчёт эффекта Бора, там если я не ошибаюсь, иной механизм - уменьшение значения рН вызывает уменьшение связывания кислорода с гемоглобином, в результате чего происходит выделение кислорода. Насколько я помню из институтского курса биохимии эффект Бора объясняется тем, что в молекуле гемоглобина имеются сайты связывания протонов в виде остатков гистидина и аспарагиновой кислоты. Как там всё происходит я точно не сказать не могу, но главная суть заключается в способности этих аминокислотных остатков взаимодействовать друг с другом в виде оксии дезокси-формы. В дезокси-форме остаток аспарагиновой кислоты способен формировать связь между протонированным остатком гистидина. Этот остаток гистидина имеет высокое значение pKa, поскольку связь гистидина с остатком аспарагиновой кислоты удерживает протон от диссоциации. Но в виде окси-форме образование такой связи невозможно и поэтому значение pKa для окси-формы гистидина возвращается к нормальному значению pKa. Поэтому, при рН крови 7,4 гистидин существует в оксигемоглобине в непротонированном виде. Высокие концентрации протонов способствуют образованию деокси-формы гистидина и как следствие этого освобождению кислорода. Освобождение СО2 в свою очередь уменьшает сродство гемоглобина с кислородом двумя путями. Во-первых, некоторое количество СО2 превращается в бикарбонат, освобождая протоны, ответственные за эффект Бора. Другая часть этого бикарбоната высвобождается эритроцитами, оставшаяся же часть бикарбоната взаимодействует непосредственно с гемоглобином, связываясь с N-группой аминокислотного остатка и формируя эфир неустойчивой карбаминовой кислоты уретан. В этом процессе снова происходит освобождение протонов, что в свою очередь приводит к высвобождению О2 и связыванию СО2. Таким образом происходит цикл дыхания.
С уважением,
О. В. Мосин
www.o8ode.ru
Растворимость газов в воде
Растворимость газов в воде
Нам известно, что газы могут растворяться в воде. Рыбы дышат растворенным в воде кислородом, морским водорослям растворенный в воде углекислый газ необходим для реакции фотосинтеза – а нам нравится, когда в напитках присутствует шипучий CO2. В данной таблице приводятся коэффициенты растворимости (в литрах газа на литр вода при давлении 1 бар и температуре 20 °C), которые являются критерием растворимости отдельных газов в воде:
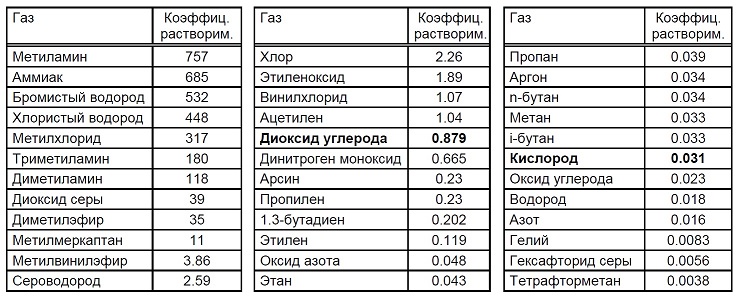
Растворимость – это такой баланс, при котором количество растворенного газа пропорционально парциальному давлению в газообразной фазе над поверхностью воды. Если нам известно атмосферное давление и соответствующая концентрация газа, то можно вычислить максимальную концентрацию растворенного в воде газа, умножив значение парциального давления газа на указанный в таблице коэффициент растворимости:
Прим?ер:
20.9 объемн. % кислорода с атмосферным давлением 1000 мбар создают парциальное давление 0.209 бар O2, таким образом, 1 литр воды содержит 0.031 ? 0.209 = 0.00648 литра или 6.5 мл кислорода. Азот (парциальное давление 0.791 бар N2) растворяется хуже, 1 л воды содержит 0.016 ? 0.791 = 0.01266 л или 12.7 мл азота. В воде у нас 34 объемн. % кислорода. Рыбы этим довольны.
Газированная вода производится посредством растворением в воде CO2 под давлением 2 бара. Можно вычислить содержание CO2, оно составляет 0.879 ? 2 = 1.75 л CO2, растворенных в 1 л воды.
Как вы видите, некоторые газы растворяются в воде очень быстро и очень эффективно. Именно поэтому в качестве мер безопасности широко распространено использование водяных распылителей и “водяных завес”, например, для снижения угрозы здоровью при выбросах значительных объемов аммиака или HCl.
Помните, что растворимость зависит от температуры. Чем выше температура воды, тем меньше газа можно в ней растворить.
По этой причине для растворения загрязняющих газов в воздухе их пропускают сквозь холодную воду, тогда как при нагревании происходит десорбция и высвобождение растворенных в воде газов (часто этому способствует падение давления).
Тонкий слой водяного конденсата на входном отверстии электрохимического сенсора может создать определенные проблемы, растворяя, например, h3S или Nh4, в результате этого уменьшаются показания сенсора.
Отсюда вывод: избегайте образования конденсата!
Растворение в воде углекислого газа
Они взаимодействуют с растворенным в воде углекислым газом или карбонат-ионами [c.380]
Учителю нужно учесть, что в случаях переходов 1 и 4 учащиеся должны применять к выяснению условий указанных превращений знания о химическом равновесии, а в случае перехода 6 не должны этого делать. Превращение карбоната кальция в хлорид кальция нельзя рассматривать как практически обратимый процесс. Карбонат кальция превращается в хлорид кальция под действием соляной кислоты, а угольная кислота (растворенный в воде углекислый газ) не может вытеснить (при обычных условиях) из хлорида кальция соляную кислоту. Превращение хлорида кальция в карбонат осуществляется при взаимодействии растворов хлорида кальция и карбоната щелочного металла. [c.142]
При растворении в воде углекислый газ взаимодействует с нею, образуя непрочную угольную кислоту [c.267]Молекулярно растворенный в воде углекислый газ, взаимодействуя с водой, образует угольную кислоту [c.38]
Приготовьте 100 мл 0,1 М или 0,1 н. раствора тиосульфата натрия ЫагЗгОз-ЗНгО. Для приготовления раствора следует пользоваться овежепрокипяченой водой, так как иначе растворенный в воде углекислый газ образует кислый сульфат натрия [c.323]
Концентрация угольной кислоты, как уже указывалось, может считаться равной количеству растворенного в воде углекислого газа. Поэтому [c.252]
Конечная точка титрования не является истинной точкой эквивалентности, потому что растворенный в воде углекислый газ окрашивает метиловый оранжевый до оттенка, который углубляется присутствием соли, образовавшейся во время титрования. Это не имеет значения в обычных работах. В работах высокой точности перед концом титрования нужно удалить СОг, а конечный оттенок сравнить с оттенком раствора, имеющего тот же самый объем и те же концентрации индикатора и соли, и вычесть количество кислоты, требуемое для доведения этого последнего раствора до того же конечного оттенка. [c.189]
Кроме того, в условиях гидразинно-аммиачного режима на блоках с частичным обессоливанием конденсата растворенный в воде углекислый газ (углекислота) способствует повышению удельной электрической проводимости Н-катионированной пробы всей рабочей среды второго контура. [c.314]
Общая формула силикатов — х8Ю2 Ме20. Действие силикатов (рис. 10.5) состоит в нейтрализации растворенного в воде углекислого газа и в образовании защитной пленки на поверхности металла. [c.302]
В другом интересном методе определения растворенного в воде углекислого газа Гитон де Морво описывает прибор для измерения количества газа, называя его га- [c.138]
Растворенный в воде углекислый газ увеличивает скорость коррозии железа. С этим явлением часто сталкиваются при трактовке механизма котельной коррозии. Основная причина ускоряющего влияния СО2 на коррозию железа в том, что при повышенном содержании в воде СО2 обычно находящиеся в воде ионы кальция не выделяются на поверхности железа в виде плотных и защитных слоев малорастворимых карбонатов (СаСОз), а остаются в растворе в виде бикарбонатов Са(НСОз)2, более растворимых и не оказывающих защитного действия. [c.139]
Наряду с рассмотренными выше солями для химии Са, 5г и Ва весьма важны их известные только в растворе кислые карбонаты Э(НСОз)г. Они образуются при взаимодействии растворенного в воде углекислого газа с нормальными карбонатами по схеме [c.368]
Однако угольная кислота — соединение крайне непрочное. Она может присутствовать лишь в водном растворе при всякой же попытке выделить угольную кислоту из раствора она опять разлагается на СОз и Н.2О. Какая часть растворенного в воде углекислого газа содержится в растворе в виде простых молекул СОз, а какая в виде молекул НдСОд (и существуют ли эти молекулы вообще), пока установить не удалось [c.557]
Впрочем, если бы сколько-нибудь значительная часть растворенного в воде углекислого газа содержалась в растворе не в виде молекул СО2, а в виде молекуле НзСОд, то растворимость углекислого газа в соответствии с изостерией молекул СО3 и МзО (см. стр. 555) значительно превышала бы растворимость закиси азота, в действительности же растворимость того и другого газа в воде практически одна и та же, а именно 0,9 при 20°. Угольная кислота очень слабая. Концентрация ионов гидроксония в насыщенной углекислым газом воде достаточна, чтобы окрасился в красный цвет лакмус, но недостаточна, чтобы окрасился в розовый цвет метилоранж. [c.557]
chem21.info
Растворимость - углекислый газ - Большая Энциклопедия Нефти и Газа, статья, страница 1
Растворимость - углекислый газ
Cтраница 1
Растворимость углекислого газа в воде при давлении 1 атм равна: 1 7 объема и 0 9 объема на один объем воды при 0 С и 20 С соответственно. [1]
Растворимость углекислого газа в воде1 с увеличением давления возрастает. Обращает на себя внимание изменение хода изотерм сростом температуры. [3]
Растворимость углекислого газа в воде с увеличением давления быстро возрастает ( рис. VIII. [5]
Растворимость углекислого газа в силикатных расплавах зависит прежде всего от содержания окислов, способных образовывать более или менее устойчивые карбонаты ( К2О, Na2O, BaO) в условиях варки стекла. Как известно, температуры раз - ложения К2СО3, Na2CO3, BaCO3 более высоки, чем любых других карбонатов. [7]
Растворимость углекислого газа в воде при 0 и 50 С составляет соответственно 7 99 10 - 2 и 2 04 - 10 - 2 моль / л при давлении СО2 1 атм. [8]
Растворимость углекислого газа в воде несопоставима с растворимостью аммиака. Однако в щелочной среде, которую приобретает вода при растворении аммиака, растворимость углекислого газа возрастает. Таким образом создаются благоприятные условия для взаимодействия этих газов. [9]
Растворимость углекислого газа при 20 С составляет 0 88 объемов в 1 объеме воды. Рассчитайте максимально возможную массовую долю угольной кислоты в растворе исходя из предположения, что весь оксид углерода ( IV) взаимодействует с водой. [10]
Растворимость углекислого газа в растворах зтаноламинов под давлением, Журн. [11]
Значения растворимости углекислого газа в пластовых водах Арланского и Туймазинского месторождений ложатся на кривую, полученную для растворов Nad в дистиллированной воде. Это, по-видимому, объясняется тем, что в указанных водах NaCl занимает доминирующее положение. [13]
При постоянной температуре растворимость углекислого газа с повышением давления увеличивается, а при постоянном давлении изменяется в зависимости от температуры. При низких давлениях с возрастанием температур от 20 до 120 С растворимость С02 монотонно уменьшается. В таких условиях углекислый газ в воде растворяется в большей степени, чем углеводородные газы и смеси газов. Это объясняется качественными различиями, а также тем, что углекислый газ вступает и в химическую реакцию с водой. [14]
Страницы: 1 2 3 4 5
www.ngpedia.ru
Растворимость некоторых газов в воде (аргона, метана, этилена, этанола, углекислого газа, диоксида углерода, хлорина, водорода, сероводорода , гелия, азота, аммиака, кислорода, диоксида серы).
Растворимость некоторых газов в воде (аргона, метана, этилена, этанола, углекислого газа, диоксида углерода, хлорина, водорода, сероводорода , гелия, азота, аммиака, кислорода, диоксида серы).
Зависимость растворимости в воде при давлении в одну атмосферу (101.325 кПа) и разных значениях температур показана на графиках ниже:
Растворимость Аргона -Ar- в воде (г газа на кг воды).
Растворимость Метана -Ch5- в воде (г газа на кг воды).
Растворимость Этилена -C2h5- в воде (г газа на кг воды).
Растворимость Этанола -C2H6- в воде (г газа на кг воды).
Растворимость Монооксида углерода (Углекислого газа) -CO- в воде (г газа на кг воды).
Растворимость Диоксида углерода -CO2- в воде (г газа на кг воды).
Растворимость Хлорина -Cl2- в воде (г газа на кг воды).
Растворимость Водорода -h3- в воде (г газа на кг воды).
Растворимость Сероводорода -h3S- в воде (г газа на кг воды).
Растворимость Гелия -He- в воде (г газа на кг воды).
Растворимость Азота -N2- в воде (г газа на кг воды).
Растворимость Аммиака -Nh4- в воде (г газа на кг воды).
Растворимость Кислорода -O2- в воде (г газа на кг воды).
Растворимость Диоксида серы -SO2- в воде (г газа на кг воды).
tehtab.ru
Растворимость углекислого газа - Справочник химика 21
Что касается газов, содержащихся в обычных условиях в воздухе, то углекислый газ растворяется в воде приблизительно в 60 раз больше, чем азот, и приблизительно в 30 раз больше, чем кислород. Примерно такой же растворимостью в воде, как и углекислый газ, обладает ацетилен растворимость сероводорода в воде в 3 раза больше, чем растворимость углекислого газа (табл. 22). [c.53]
Скорость коррозии увеличивается при повышении температуры (рис. VI. 11) и величины растягивающих напряжений. Уменьшение скорости коррозии стали Д в углекислотной среде за областью максимума связано с уменьшением растворимости углекислого газа в оде при росте температуры, вследствие чего снижается агрессивность среды. [c.213]
Растворимость углекислого газа при 20 °С составляет 0,88 объемов в 1 объеме воды. Рассчитайте максимально возможную массовую долю угольной кислоты в растворе исходя из предположения, что весь оксид углерода (IV) взаимодействует с водой. [c.141]
С хорошей растворимостью углекислого газа связано его использование прн изготовлении искусственных минеральных вод. Из них обычная газированная вода представляет собой просто насыщенный водный раствор СОз, а в состав других входят, кроме того, примеси некоторых солей. Подобным же образом готовят и прохладительные напитки (лимонад и др.) с той лишь разницей, что вместо солей добавляют небольшие количества сахара и различных эссенций . [c.508]
Подобное соотношение, определяющее влияние третьего компонента на растворимость второго, было впервые установлено И. М. Сеченовым, изучавшим зависимость растворимости углекислого газа в крови от концентрации в ней солей. Он указал на явление высаливания , т. е. на понижение растворимости газов в воде при увеличении содержания в ней третьего вещества. [c.100]
На рис. 102 приведена растворимость углекислого газа, воздуха, водорода и углеводородных газов в нефти при различном давлении. [c.208]
Растворимость углекислого газа в водно-спиртовых смесях при температуре 15—20 С (по Миллеру) [c.112]
Растворимость углекислого газа в воде при давлении [c.100]
Это уравнение получено путем сочетания выражений закона действия масс для кислотной диссоциации угольной кислоты и растворимости углекислого газа. [c.357]
Растворимость окиси углерода в 1 см воды Растворимость углекислого газа в I см воды [c.386]
В дальнейшем закон Генри неоднократно подвергался проверке. Упомянем исследования И. М. Сеченова, который из чал, в частности, растворимость углекислого газа в воде и водных растворах солей. Ниже приведены данные о растворимости кислорода в воде при 25° С и сероводорода в анилине при 22° С. [c.256]
Смещение равновесия происходит за счет понижения растворимости углекислого газа, вызываемого повышением температуры. Кипячением можно полностью удалить углекислый газ и, следовательно, намного снизить карбонатную кальциевую жесткость. Однако полностью устранить указанную жесткость не удается, так как карбонат кальция, хотя и незначительно (13 мг/л при температуре 18°), но все же растворим в воде. [c.419]
При постоянном давлении но мере повышения температуры растворимость азота, кислорода и воздуха в топливе уменьшается. При повышении температуры до 204° С растворимость углекислого газа уменьшается, при температурах выше 204° С она несколько увеличивается. Растворимость кислорода в топливах была изучена до температуры 150° С. При температурах выше 150° С кислород начинает [c.72]
В связи с незначительной растворимостью углекислого газа в воде при атмосферном давлении водную абсорбцию проводят под давлением 16—25 ати. Растворимость газов обычно измеряется объемами газа, приведенными к нормальным условиям (0° и 760 мм рт. ст.), на объем поглотителя. [c.42]
Растворимость углекислого газа в воде при различных температурах и величины коэффициента Генри (Я) приведены в табл. 23, а растворимость при различных давлениях—в табл. 24. [c.42]
Опыт 5. Большую толстостенную склянку емкостью 1 Уг —2 л заполнить углекислым газом и закрыть пробкой. Склянку погрузить в сосуд с холодной водой и открыть под водой пробку вода постепенно входит в склянку. При встряхивании склянки (держать горло под водой ) вода входит в нее более энергично и заполняет почти до половины. Этот опыт показывает растворимость углекислого газа в воде. [c.229]
Растворимость углекислого газа в воде [c.224]
Пример 6. При 22° С и атмосферном давлении растворимость углекислого газа в воде составляет 82,9 см Og в 100 мл воды. Подсчитать для той же температуры концентрацию углекислого газа в молях и в граммах на 1 л раствора, если через воду пропускают углекислый газ под давлением 2 ата. [c.332]
II. Растворимость углекислого газа в воде и растворах хлористого натрия [c.317]
Смещая углекислотное равновесие в сторону образования средних карбонатов, понижая растворимость углекислого газа и повышая относительную активность ионов ОН , магнитная обработка дает возможность ускорить выделение гидроокиси магния и карбоната кальция, повышает глубину умягчения воды и способствует повышению производительности установок известково-содового умягчения воды. [c.114]
Снижение скорости разложения амальгамы калия в 10 раз при повышении температуры метилового спирта от 20 до 64—65° С и менее резкое, но также ясно выраженное снижение скорости разложения амальгамы калия в этиловом и н-пропиловом спиртах при соответствующем повышении температуры связано со значительным уменьшением растворимости углекислого газа при приближении к температурам кипения спиртов. Для более высоко кипящих н-бу-тилового и н-октилового спиртов, по-видимому, повышение скорости процесса, связанное с ростом температуры, превышает снижение скорости в результате уменьшения растворимости углекислого газа. [c.243]
В третьей группе способов получения чистой газообразной двуокиси углерода из источников со средним ее содержанием используется более высокая растворимость углекислого газа в воде, чем других газов. Так, при 20° С его растворяется в воде в 30 раз больше, чем метана, и в 50 раз больше, чем водорода. Однако этот [c.359]
В третьей группе способов получения чистой газообразной углекислоты из источников со средним ее содержанием используется более высокая растворимость углекислого газа в воде, чем других газов. Так, при 20° С он растворяется в воде в 30 раз больше, чем метан, и в 50 раз больше, чем водород. Однако этот способ целесообразно применять там, где по ходу основного технологического процесса смесь газов уже находится под относительно высоким давлением (например, при синтезе аммиака) и.яи где основным продуктом является газ, конденсирующийся также при высоком давлении (например, при получении жидкого метана). В таких случаях возможно использовать свойство газов увеличивать свою растворимость в жидкостях, примерно пропорционально давлению газа над жидкостью. Это важно потому, что [c.393]
Углекислый газ (СОг). Для хранения продуктов углекислый газ применяется в сочетании с низкими положительными температурами. Он обладает высокой растворимостью и легко проникает через оболочки клеток. Растворимость углекислого газа в клетках с повышением температуры понижается, поэтому при применении углекислотной среды температура хранения должна быть не выше 8—10 . [c.37]
Решение. Растворимость углекислого газа в 0,01 н, НС1 близка к растворимости в чистой воде. Поэтому, пользуясь только что выведен ным соотношение. г, получи.м ц = о,01 и / = 0,89. [c.130]
Объемный эффект. Связан с заметным ростом объема нефти при смешивании ее с углекислотой. Увеличение объема нефти при растворении в ней СО2 способствует более эффективному первичному вытеснению, а также доотмыву остаточной нефти. Хотя точное вычисление прироста нефтеотдачи невозможно, эффект растет с ростом количества растворенного в нефти СО2. Объемный эффект будет сказываться при большой кратности объемов фильтруемой через зоны остаточной нефти углекислого газа в чистом виде или растворенном в воде состоянии. Величина прироста нефтеотдачи зависит от степени растворимости углекислого газа в водной и углеводородной среде. Одновременно с ростом объема раствора углекислоты в нефти происходит его уплотнение, что объясняется снижением суммарного объема составляющих (нефти и СО2) при их взаимном растворении. Это увеличение плотности также способствует более равномерному вытеснению нефти вследствие уменьшения разности плотностей нефти и воды. [c.150]
В водно-спиртовых смесях растворяются некоторые газы. Растворимость углекислого газа показана в табл. 86. В этой таблице коэффициент абсорбции соответствует объему газа при парциальном дав-лмии 0,1 МПа (760 мм рт. ст.), который поглощается одним объёмом жидкости при нормальных условиях. [c.108]
При увеличении давления растворимость углекислого газа в воде (соответственно, в растворе кислоты) увеличивается и, таким образом, из сферы реакции удаляется меньщее количество его. Концентрация продуктов реакции в кислотном растворе повышается, что приводит к уменьшению скорости растворения породы в кислоте. Следовательно, в условиях, при которых из реакции удаляется газообразная двуокись углерода (СО2), скорость растворения карбонатной породы в кислоте зависит от давления. Зависимость эта, однако, не проста. При температуре выше критической двуокись углерода будет выделяться в газообразном состоянии при любом давлении, поэтому повышение давления будет приводить к уменьшению скорости растворения породы в кислоте. Если температура ниже критической, любая заданная температ ра соответствует давлению, при превышении которого СО2—жидкость. В этих условиях скорость растворения породы в кислоте уменьшается с ростом давления и перестает зависеть от него в точке, соответствующей переходу СО2 из газообразного в жидкое состояние. Таким образом, скорость реакции растворения карбонатной породы в кислоте зависит от давления в условиях, когда продуктом реакции является газообразный СО2, и не зависит от давления, если он не выделяется. [c.210]
Увеличение температуры (рис. 1—3) также ускоряет процесс, в том числе газовыделение и кристаллизацию основного карбоната магния. Поэтому при 100° исчезает максимум даже увеличенная скорость разложения тригидрокарбоната во все периоды остается ниже скорости кристаллизации основного карбоната магния. Это связано, по-видимому, с уменьшением растворимости углекислого газа, образующегося по реакции (2), и растворимости основного карбоната магния. [c.27]
V го в воде углекислого газа содержалась в р.астворе яе в виде молекул СО2, а в виде молекул Н2СО3, то растворимость углекислого газа в соответствии с изостерией молекул СОз и ЫзО (см. стр. 405) значительно превышала бы растворимость закиси азота, в действительности же растворимость того и другого газа й воде практически одна и та же. [c.406]
Сосуд емкостью 10 л напо.чнен углекислым газо.м при давлении 720 мм рт. ст. и температуре P . Сколько требуется воды для поглощения СО5, чтобы понизить его давление в сосуде до 50U. им рт. ст., если коэффициент растворимости углекислого газа при 1°С равен 0,712. [c.340]
Впрочем, если бы сколько-нибудь значительная часть растворенного в воде углекислого газа содержалась в растворе не в виде молекул СО2, а в виде молекуле НзСОд, то растворимость углекислого газа в соответствии с изостерией молекул СО3 и МзО (см. стр. 555) значительно превышала бы растворимость закиси азота, в действительности же растворимость того и другого газа в воде практически одна и та же, а именно 0,9 при 20°. Угольная кислота очень слабая. Концентрация ионов гидроксония в насыщенной углекислым газом воде достаточна, чтобы окрасился в красный цвет лакмус, но недостаточна, чтобы окрасился в розовый цвет метилоранж. [c.557]
Эти обратимые процессы можно почти целиком сместить вправо за счет кипячения воды, так как при высоких температурах растворимость углекислого газа понижается. Однако полностью устранить карбонатную жесткость нельзя, так как углекислый кальций хотя и незиачптельно (около 9,95 лгг/л при 15° С), но раствори М [c.204]
Для уменьшения погрешности при расчете растворимости углекислого газа целесообгазно использовать коэффициенты уравнения Сеченова в следующем варианте [c.317]
Из уравнения (4.76) следует, что скорость разложения амальгамы должна быть тем больше, чем больше константа скорости разложения амальгамы /Св, чем выше давление двуокиси углерода и концентрации амальгамы и чем ниже концентрация ионов щелочного металла в растворе. Для одной и той же амальгамы, например, амальгамы натрия, накопление в растворе формиата и бикарбоната натрия должно приводить к снижению скорости разложения амальгамы. Так как при разложении этой амальгамы в токе углекислого газа накапливается формиат натрия 9,0 моль л, а бикарбонат натрия только до 1,0 моль1л, то практически разложение амальгамы происходит в насыщенном бикарбонатном растворе. С повышением концентрации формиата скорость разложения амальгамы должна меняться как вследствие повышения концентрации ионов щелочного металла в растворе, а также из-за снижения растворимости углекислого газа в более концентрированных растворах. С повышением давления углекислого газа скорость разложения амальгамы должна увеличиваться, причем, если п меньше 1, то скорость разложения амальгамы с повышением давления будет увеличиваться не прямо пропорционально давлению, а несколько медленнее. Не трудно показать, что доля тока т]ф (в %), отвечающая процессу образования фомиата может быть определена по уравнению [c.148]
Растворимость углекислого газа в 0,01 н. НС1 близка к растворимости в чистой воде, поэтому Сн2СОз = 0,034 MOAbjA. При вычислении ионной силы раствора учитывается только 0,01 моль/л НС1, так как концентрация ионов O3 очень мала. Ионная сила [c.150]
chem21.info
Растворимость газов в воде, см3/л
| Газы | Температура, °С | ||
| 5 | 20 | 30 | |
| Воздух | 0,25 | 0,19 | 0,16 |
| С02 | 14,24 | 8,78 | 6,65 |
| О2 | 0,43 | 0,31 | 0,26 |
Подчеркнем особую значимость растворенного в воде углекислого газа. При высокой растворимости СО2 велика его роль в создании кислотности, в почвах при отсутствии карбонатов (СаСО3 и др.) происходит подкисление среды:
СО2 + Н2О > + 2Н+ + СО32-
В нейтральных и щелочных почвах СО2, растворенный в воде, - главное условие миграции карбонатов.
1.7.2. Состав почвенного воздуха
Из всех компонентов почвы воздушная фаза - наиболее динамичная по объему и соотношению формирующих ее газов. Главные по массе - это N2, O2 и СО2, а также вода. Примерное их содержание в сравнении с атмосферой (% от объема):
| Газы | Атмосфера | Газовая фаза почвы |
| N2 | 78 | 78-86 |
| о2 | 21 | 10-20 |
| со2 | 0,03 | 0,1-15 |
| Н2О относительная | Менее 95 | Более 95 |
| влажность |
Почвенный воздух имеет почти такое же количество азота, как и атмосфера Земли, кислорода обычно в два раза меньше, а двуокиси углерода - в десятки и сотни раз больше. Установлено, атмосфера Земли на 90% обеспечивается углекислым газом, т. е. основным источником углеродного питания растений, за счет его диффузии из почвенного воздуха. Вода, как неизменный компонент в почвенном воздухе всегда находится на грани конденсации и ее переход в капельно-жидкое состояние возможен при относительно небольших снижениях температур. Это часто служит источником свободной воды, например, в песках пустыни, в глубоких горизонтах черноземов при градиенте температур воздуха почвы в верхних слоях 30 °С, в нижних 10 °С. Общеизвестно зимняя конденсация Н2О в промерзающих слоях сельских и городских почв (появление мокрой почвы в крытых токах, увлажнение почв под асфальтом городских улиц и т. д.).
Высокую динамичность содержания в воздухе кислорода и диоксида углерода иллюстрирует табл. 21.
Таблица 21
Пределы изменения содержания Oz и С02 в почвенном воздухе в течении года
(по 3 бори щук)
| Почва | О2 | С02,% |
| Иловато-болотная | 11,9-19,4 | 1,1-8,0 |
| Торфяно-глеевая | 13,5-19,5 | 03-4,5 |
| Дерново-подзолистая | 18.9-20Л | 0,2-1,0 |
| Серая лесная | 19,2-21,0 | 0,2-0,6 |
| Чернозем обыкновенный | 19,5-20,8 | 0,3-0,8 |
| Чернозем южный | 19,5-20,9 | 0,05-0,6 |
| Каштановая | 19,8-20,9 | 0,05-0,5 |
| Серозем | 20,1-21,0 | 0,05-0,3 |
В незначительных количествах в почвенном воздухе присутствуют такие компоненты, как N2O, NO2, CO, различные углеводороды (этилен, ацетилен, метан), сероводород, аммиак, эфиры и др. Происхождения микрогазов связывается с жизнедеятельностью организмов, особенно в анаэробных условиях. Болота часто выделяют самовозгорающиеся и психотропные газы. Обязательно присутствие инертных газов, в том числе и радиоактивных. Источником последних является распад радионуклидов минеральной части почвы. Естественная радиоактивность почвенного воздуха намного выше атмосферного.
1.7.3. Свойства воздушной фазы
Главные свойства воздушной фазы почв: воздухоемкость, воздухопроницаемость и высокая динамичность воздухообмена и химического состава.
Воздухоемкость - это та часть объема почвы, которая занята воздухом при данной влажности. Выделяют полную, или потенциальную, воздухоемкость, которая свойственна сухим почвам. Она соответствует пористости (порозности) почв и напрямую зависит от их плотности. Актуальная воздухоемкость - это содержание воздуха в почве в каждый конкретный момент при том или ином уровне увлажнения. Таким образом, воздухосодержание (Рв) определяется:
Рв = Робщ - PW
где Р общ- порозность почвы, Pw - влажность почвы. Все величины выражаются в процентах от объема.
Вода и воздух в почвах антагонисты: чем больше воды в почве, тем меньше воздуха. Оптимальная экологическая гармония для большинства растений - вода и воздух должны содержаться в равных по объему количествах, что соответствует влажности почвы 60% от НВ.
Воздухопроницаемость - способность почвы пропускать через себя воздух. Воздухопроницаемость - непременное условие газообмена между почвой и атмосферным воздухом. Чем она выше, тем лучше газообмен, тем больше в почвенном воздухе содержится кислорода и меньше углекислого газа. Воздух в почве передвигается по порам, не заполненным водой и не изолированным друг от друга. Чем крупнее поры аэрации, тем лучше воздухопроницаемость. В структурных почвах, где наряду с капиллярными порами имеется достаточное количество крупных некапиллярных пор, создаются наиболее благоприятные условия для воздухопроницаемости.
Динамика почвенного воздуха зависит от многих факторов. Постоянно протекающий процесс обмена почвенного воздуха с атмосферным называется аэрацией почвы.
При постоянной влажности почвы аэрация зависит от интенсивности диффузии и изменения температуры и барометрического давления.
Диффузия - перемещение газов в соответствии с их парциальным давлением. Поскольку в почвенном воздухе кислорода меньше, а углекислого газа больше, чем в атмосфере, то под влиянием диффузии создаются условия для непрерывного поступления кислорода в почву и выделения СО2 в атмосферу.
Изменение температуры и барометрического давления также обусловливает газообмен, потому что происходит сжатие или расширение почвенного воздуха.
При известной значимости в аэрации почвы диффузии и физического изменения объема воздушной массы важным фактором аэрации следует признать постоянную изменяемость воздухоемкости почвы, а это в первую очередь связано с динамикой влажности. Увлажнение
почвы осадками или орошением, испарение воды, транспирация ее растениями - факторы постоянного газообмена почвы и атмосферы. С влажностью почвы также связано изменение поровых пространств при набухании и усадке твердой фазы почвы.
При аэрации почвы постоянна тенденция уравнивания вещественного состава воздуха почвы и атмосферы. Но равновесие всегда нарушается в сторону накопления продуктов жизнедеятельности организмов и тем в большей степени, чем выше биологическая активность. В связи с этим различают суточную и сезонную динамику почвенного воздуха.
Суточная динамика определяется суточным ходом атмосферного давления, температур, освещенности, изменениями скорости фотосинтеза. Эти параметры контролируют интенсивность диффузии, дыхания корней, микробиологической активности.
Суточные колебания состава почвенного воздуха затрагивают лишь верхнюю полуметровую толщу почвы. Амплитуда этих изменений для кислорода и диоксида углерода не велика. Наиболее существенно в течение суток изменяется интенсивность почвенного дыхания.
Сезонная (годовая) динамика определяется годовым ходом атмосферного давления, температур и осадков и тесно связанными с ними вегетационными ритмами развития растений и микробиологической деятельности. Годовой воздушный режим включает в себя динамику тидухозапасов, воздухопроницаемости, состава почвенного воздуха, растворения и сорбции газов, почвенного дыхания.
Сезонная динамика состава почвенного воздуха отражает биологические ритмы. Концентрация диоксида углерода имеет в верхней толще четко выраженный максимум в период наивысшей биологической активности. В это время происходит насыщение почвенной толщи углекислотой. По мере затухания биологической деятельности происходит отток СО2 за пределы почвенного профиля. Динамика концентрации кислорода имеет обратную зависимость.
1.7.4. Экологическая значимость почвенного воздуха
Воздушная фаза - важная и наиболее мобильная составная часть почв, изменчивость которой отражает биологические и биохимические ритмы почвенных процессов. Количество и состав почвенного воздуха оказывают существенное влияние на развитие и функционирование растений и микроорганизмов, на растворимость и миграцию химических соединений в почвенном профиле, на интенсивность и направленность почвенных процессов. Кроме того, почва является поглотителем, сорбирующим токсичные промышленные выбросы газов и очищающим атмосферу от техногенного загрязнения.
Воздействие кислорода на жизнь растений проявляется в актах дыхания. При недостатке О2 дыхание ослабляется, что уменьшает метаболическую активность и в конечном итоге снижает урожай. Повышение аэрации почвы способствует лучшему развитию корней, более интенсивному поглощению питательных веществ растениями, усилению их роста и увеличению урожая при достаточном количестве почвенной воды. При отсутствии свободного кислорода в почве развитие растений прекращается. Оптимальные условия для них создаются при содержании кислорода в почвенном воздухе около 20%.
При недостатке О2 в почве создается низкий окислительно-восстановительный потенциал, развиваются анаэробные процессы с образованием токсичных для растений соединений, снижается содержание доступных питательных веществ, ухудшаются физические свойства, что в совокупности снижает плодородие почвы.
Большая часть углекислого газа почвенного воздуха образуется в процессах работы макро- и микроорганизмов, причем около 30% за счет дыхания корней высших растений и около 65% - при разложении органических остатков микроорганизмами. Избыток углекислоты угнетает развитие корней и прорастание семян. Однако современная концентрация СО2 в атмосферном воздухе не вполне достаточна для потенциальной возможности биологической продуктивности зеленого листа. Приземное повышение концентрации углекислого газа может увеличивать урожай зеленой массы, что практикуется в тепличных хозяйствах. Однако следует помнить, СО2 в высоких концентрациях - быстродействующий яд, и при почвенных исследованиях разрезы, особенно в болотных почвах, должны быть хорошо проветриваемые, так как СО2, являясь тяжелым газом воздуха, склонен к накоплению в понижениях.
Велика почвенно-химическая и геохимическая роль диоксида углерода. Вода, насыщенная СО2, растворяет многие труднорастворимые соединения - кальцит СаСО3, доломит СаСО3 u MgCO3, магнезит MgCO3, сидерит FeCO3. Это вызывает миграцию карбонатов в по
темном профиле и в сопряженных геохимических ландшафтах. Вынос (выщелачивание) карбонатов под действием увеличивающейся концентрации СО2 в почвенном воздухе и в почвенном растворе называется процессом декарбонизации, который обусловлен сдвигом равновесия влево:
Са(НСО3)2 <-> СаСО3 + Н2О + СО2.
Обратная картина этого явления - выпадение СаСО3 в осадок и формирование в почвах горизонтов скопления карбонатных почвообразований (белоглазка, журавчики, карбонатная плесень).
Существует высокоинформативный показатель биологической активности почв, так называемое «дыхание почв», которое характеризуется скоростью выделения СО2 за единицу времени с единицы поверхности. Интенсивность «дыхания почв» колеблется от 0,01 до 1,5 г/(на м2 в час) и зависит не только от почвенных и погодных условий, но и от физиологических особенностей растительных и микробиологических ассоциаций, фенофазы, густоты растительного покроил «Почвенное дыхание» характеризует биологическую активность экосистемы в каждый конкретный период времени. Сравнительный уровень плодородия почв, фиксируемый при определении «дыхания» по выделению СО2, производят в оптимально насыщенной влагой почвенной массе (60% от наименьшей влагоемкости). Различия в уровнях могут изменяться и широких пределах при анализе генетически отдаленных п антропогенно измененных почв.
Оценивать воздухоемкость почв и ее экологическую значимость необходимо всегда в комплексе с другими характеристиками почвы, от которых напрямую зависит объем воздуха.
1.8. БИОЛОГИЧЕСКАЯ ФАЗА ПОЧВ
Уже в начале XX века была известна огромная роль живого вещества почв. Бертло показал, что почва представляет из себя «нечто живое». Признание значительного влияния организмов на свойства почвы В.И. Вернадский выразил во фразе: «... все процессы в почве связаны с участием живого вещества или продуктов его изменения. В широком понимании слова все эти явления можно считать биохимическими».
Изучение биологии почв позволило установить закономерности распределения и активности организмов и их метаболитов в зависимости от свойств почв и почвенных процессов, что послужило теоретической базой для их применения в диагностике и мониторинге почв.
studfiles.net