Определение и классификация коррозионных процессов. Химическая и электрохимическая коррозия. Условия протекания электрохимической коррозии
13. Электрохимическая коррозия металлов. Общая характеристика электрохимического коррозионного процесса и явление поляризации. Коррозионный процесс с водородной деполяризацией
Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии.
В простейшем случае коррозии металлов с образованием их растворимых продуктов (т.е. ионов Меn+) коррозионные процессы принято называть процессами растворения металлов. Образование ионов металла из его атомов, например, в кислом растворе электролита можно представить совокупностью реакций в которой электроны освобождаются, и в которой электроны, освободившиеся в реакции (4.IV), присоединяются к ионам водорода. В результате на металле одновременно протекают две реакции — анодная (4.IV) и катодная (4.V).
Перенос электронов осуществляется на поверхности металла, а перемещение ионов — в электролите
При протекании электрохимического процесса анодный и катодный потенциалы Еа и Ек выравниваются и принимают значение потенциала ЕСТ. Этот потенциал называют потенциалом свободной коррозии.
При ЕСТ соблюдается равенство катодного и анодного токов, т.е.
ia = iк = iкор
где iкор — скорость коррозии или саморастворения металла.
Скорость электрохимической коррозии металлов в агрессивных средах ограничивается явлением поляризации.
Причина поляризации электрода, возникновение перенапряжения состоит в том, что при протекании на электроде электрохимической реакции (окисления или восстановления) могут возникнуть того или иного рода затруднения. Поскольку в стационарных условиях скорость процесса определяется самой медленной стадией, то для ее ускорения требуется определенные энергетические затраты, вызывающие перенапряжение.
Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией.
Коррозия металлов с водородной деполяризацией имеет место:
, т.е. в растворах кислот, например, кислотное растворение железа, цинка и других металлов;
при достаточно отрицательных значениях потенциала ионизации металла, например, коррозия магния в воде или растворах солей.
На практике с такими явлениями сталкиваются при хранении и перевозке кислот, при кислотном травлении металлов, при получении кислот на стадии абсорбции.
Главными причинами катодной поляризации является замедленная стадия электрохимического разряда или концентрационная поляризация по молекулярному водороду, связанная с отводом газообразного продукта.
являются большим и самостоятельным вопросом, в изучение и развитие которого значительный вклад внесли работы ученых научной школы академика А.Н. Фрумкина. Эти работы широко освещаются в учебниках по электрохимии. Мы приведем только краткие, основные сведения.
зависимость изменения потенциала от плотности тока является линейной.
равен
118 мВ, что отвечает механизму замедленной стадии разряда с переносом одного электрона, хотя не исключены и другие механизмы.
Константа а в уравнении Тафеля (4.22) зависит от материала катода или материала инородных катодных включений в составе сплавов и численно определяется как величина перенапряжения при плотности тока, равной 1 А/см2. Наиболее высокое перенапряжение наблюдается на свинце, ртути, кадмии, цинке.
Поляризация вследствие замедленной диффузии молекулярного водорода носит название газовой концентрационной поляризации. Она сопровождает процесс водородной деполяризации, начиная с самых низких плотностей катодного тока.
имеет вид, изображенный на рис. 4.6 (участки АВ и ВС).
. Давление внутри металла увеличивается и происходит разрыв сплошности металла.
Таким образом, коррозия металлов с водородной деполяризацией характеризуется:
большой зависимостью скорости коррозии металла от рН раствора;
большой зависимостью коррозионной стойкости сплавов от их природы и содержания в них катодных примесей;
увеличением скорости коррозии во времени, что связано с ростом посторонних примесей на поверхности металла в результате его расторения;
возможностью появления водородной хрупкости металлов.
.14. Электрохимическая коррозия металлов. Общая характеристика электрохимического коррозионного процесса и явление поляризации. Коррозионный процесс с кислородной деполяризацией
При наличии в растворе газообразного кислорода и не возможностью протекания процесса кор-розии с водородной деполяризацией основную роль деполяризатора исполняет кислород. кор-розионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяриза-цией. Это наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха. Общая схема кислородной деполяризации сводится к восстановлению молекулярного кислорода до иона гидроокисла: O + 4e +2HO -> 4OH
Термодинамические возможности кислородной деполяризации.
Протекание процесса коррозии металла с кислородной деполяризацией согласно уравнения возможно при условии:
где ( ) - обратимый потенциал кислородного электрода, равный:
где ( ) - стандартный потенциал кислородного электрода, т.е. (обратимый) потенциал кислород-
ного электрода при 25 С.
a =1 P =101 Па (1 атм)
Схема кислородной деполяризации.
Каждый процесс с кислородной деполяризацией включает следующие последовательные ста-
дии:
1) Растворение кислорода воздуха в растворе электролита.
2) Транспортировка растворенного кислорода в растворе электролита (за счет диффузии или
перемешивания) к слою Прандтля.
3) Перенос кислорода в части слоя Прандтля ( ) в результате движения электролита.
4) Перенос кислорода в диффузионном слое электролита толщиной или в пленке продуктов
коррозии металла к катодным участкам поверхности.
5) Ионизация кислорода:
а) в нейтральных и щелочных растворах
б) в кислых растворах
6) Диффузионный или конвектный перенос ионов ОН от катодных участков поверхности корро-
дирующего металла в глубь электролита.
В реальных условиях коррозии металла наиболее затрудненными стадиями процесса являют-
ся:
а) реакция ионизации кислорода на катоде. Возникающую при этом поляризацию называют
перенапряжением кислорода. Говорят, что процесс идет с кинетическим контролем.
б) Диффузия кислорода к катоду, либо перенапряжение диффузии. В этом случае, говорят, что
процесс идет с диффузионным контролем.
studfiles.net
Условия протекания коррозионных процессов - Справочник химика 21
УСЛОВИЯ ПРОТЕКАНИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ и ХАРАКТЕР РАЗРУШЕНИЯ ГАЗОНЕФТЕПРОМЫСЛОВОГО ОБОРУДОВАНИЯ [c.3]
УСЛОВИЯ ПРОТЕКАНИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ [c.5]
Условием протекания коррозионного процесса в отсутствие внешнего тока является равенство скоростей а и г . Из этого равенства следует [c.100]
В присутствии ингибиторов могут существенно меняться условия протекания коррозионных процессов. Уменьшается доля свободной для реакции поверхности в связи с покрытием части ее адсорбированным ингибитором. Степень ингибирования процесса оказывается при этом пропорциональной Доле закрытой поверхности металла в, которая в свою очередь возрастает с увеличением концентрации добавок. Ингибиторы катионного типа изменяют [c.76]
Выбранные методы и режимы испытания должны обеспечивать условия протекания коррозионного процесса с большой скоростью в течение почти всего испытания. [c.18]
Однако многообразие условий протекания коррозионных процессов выдвигают наряду с общими требованиями, свои специфические требования, вытекающие из особенностей того или иного производства. Так, например, при травлении проката необходимо, чтобы применяемый ингибитор имел высокую эффективность в -определенном температурном интервале (50—95 "С), не тормозил скорость растворения окалины, был устойчив к окислителям, стабильным в присутствии солей железа, совмещался с пенообразователями, не изменял механические характеристики металла, улучшал качество поверхности (препятствовал растравливанию поверхности), обладал последействием. [c.96]
Для медных сплавов характерны те же основные условия протекания коррозионного процесса, что и для чистой меди они достаточно устойчивы в солевых растворах и в разбавленных неокислительных кислотах. Медь может применяться в промышленности в производстве формалина в колоннах дистилляции, если формалиновые смеси не содержат муравьиной кислоты и в аппараты не попадает воздух. В кипящей смеси формальдегида, воды и метилового спирта скорость коррозии меди не превышает 0,05 мм/год. [c.205]
Для медных сплавов характерны те же основные условия протекания коррозионных процессов, что и для чистой меди. Они достаточно устойчивы в солевых растворах и разбавленных неокислительных кислотах. Более сильная коррозия медных сплавов отмечена при большем доступе кислорода, в частности, увеличение коррозии происходит в зоне усиленного перемешивания. Менее устойчивы медные сплавы в окислительных условиях и, в частности, в окислительных кислотах. [c.282]
Торможение анодных процессов при коррозии возможно не только за счет воздействия на металл, но также путем изменения коррозионной среды или условий протекания коррозионного процесса. Здесь рассматриваются возможности торможения анодного процесса только за счет изменения состоя- [c.15]
При проведении коррозионных испытаний необходимо учитывать, что реальные условия протекания коррозионных процессов воспроизвести в лаборатории невозможно. Поэтому проведение испытаний в производственных аппаратах или на опытно-промыщленных установках всегда предпочтительнее лабораторных и при проверке выбранных материалов их следует подвергать именно таким испытаниям. [c.50]
Выбор варианта должен основываться в первую очередь на анализе условий протекания коррозионных процессов вплоть до появления неисправностей и отказов из-за коррозионных или коррозионно-механических повреждений и на обоснованном прогнозе изменения долговечности, затрат на изготовление и ремонт при освоении нового метода или средства предотвращения коррозионных повреждений. [c.192]
Введение ингибитора приводит к изменению условий протекания коррозионного процесса. [c.81]
Метод и режимы испытаний должны обеспечивать условия протекания коррозионного процесса в течение значительной части времени с большой скоростью. Существует несколько методов повышения скорости коррозии. Применительно к атмосферной коррозии или случаям периодического воздействия электролита на металл наиболее простым является увеличение времени воздействия электролита на металл. Известно, что в атмосферных условиях время воздействия электролита на металл ограничено и поэтому увеличение времени контакта металлической поверхности с электролитом может уже само по себе увеличить суммарный эффект и тем самым сократить время испытания. Поэтому простой путь ускорения испытаний, имитирующих атмосферные условия, заключается в том, чтобы электролит возможно дольше действовал на металлическую поверхность. [c.10]
Многообразие реальных условий протекания коррозионного процесса, который зависит от природы металла, химического состава, структуры и состояния его поверхности, состава и концентраций электролита, условий диффузии и температуры, неизбежно приводит к разным формам зависимости скорости ра- [c.19]
По условиям протекания коррозионного процесса разли чают атмосферную коррозию, протекающую под действием атмосферных, а также влажных газов, газовую, обусловленную взаимодействием металла с различными газами — кислородом, хлором и т, д. — при высоких температурах, коррозию в электролитах, в большинстве случаев протекающую в водных растворах и в зависимости от их состава подразделяющуюся на кислотную, щелочную и солевую. При контакте металлов, имеющих разные стационарные потенциалы в данном электролите, возникает контактная коррозия, а при одновременном воздействии коррозионной среды и постоянных или переменных механических напряжений — коррозия под напряжением. Понижение предела усталости металла, возникающее при одновременном воздействии переменных растягивающих напряжений и коррозионной среды, называют коррозионной усталостью. Кроме того, различают еще коррозионное растрескивание металла,, возникающее при одновременном воздействии коррозионной среды и внешних или внутренних механических растягивающих напряжений. Этот вид разрушений характеризуется образованием транскристаллитных или межкристал-литных трещин. Под влиянием жизнедеятельности микроорганизмов возникает также биокоррозия. Разрушение металла от коррозии при одновременном ударном действии внешней среды называют кавитационной эрозией. Без участия коррозионного воздействия среды эрозия протекает как процесс только механического износа металла. Многие из перечисленных условий возникновения и развития коррозионных процессов встречаются и в пароводяных трактах ТЭС. [c.26]
Естественно, что термодинамические данные не позволяют оценить реальную опасность коррозии, которая определяется конкретными условиями протекания коррозионного процесса. Поэтому необходимо рассмотреть кинетику этого процесса, состоящего, как указано в гл. V, п. 2, из двух сопряженно протекающих реакций — анодной и катодной. Каждая из этих реакций протекает в соответствии с различными кинетическими закономерностями. Обе реакции связаны тем, что количество электронов, освободившихся при ионизации металла, должно быть одинаковым с количеством электронов, взаимодействующих с деполяризатором [реакции (П) и [c.40]
Обычно металлическое изделие, деталь в машине, приборе, установке или конструкции контактирует, по крайней мере, еще с одной деталью. Возникающий контакт между двумя деталями, которые могут быть изготовлены из различных металлов, существенно изменяет условия протекания коррозионного процесса. Контакт при этом может быть анодным и катодным. В первом случае железо является катодом и на его поверхности протекает катодный процесс. Во втором случае железо — анод и активно растворяется, так как на его поверхности протекает анодный процесс. [c.60]
Графический метод расчета скорости коррозии позволяет в отличие от аналитического рассчитать величину коррозии для весьма сложных случаев, соответствующих реальным условиям протекания коррозионного процесса. [c.417]
В зависимости от условий протекания коррозионного процесса различают следующие виды разрушений материалов [c.7]
По условиям протекания коррозионного процесса электрохимическая коррозия подразделяется на следующие типы [c.22]
По условиям протекания коррозионного процесса различают следующие виды коррозии [c.218]
Как указывалось выше, необходимое условие протекания коррозионных процессов — наличие электролита. [c.133]
Основными структурными составляющими железоуглеродистых сплавов являются феррит (твердый раствор углерода в а-железе) и аустенит (твердый раствор углерода в у-железе). Помимо этих составляющих, в стали присутствует цементит, а в чугуне — несвязанный углерод (графит). Все эти составляющие различаются величиной электродных потенциалов, и коррозионные микроэлементы в некоторых случаях могут работать весьма интенсивно, в особенности в условиях протекания коррозионного процесса с водородной деполяризацией. [c.198]
По условиям протекания коррозионного процесса различают следующие виды электрохимической коррозии 1) коррозия при полном, частичном и переменном погружении в электролит 2) щелевая 1[ контактная коррозия 3) коррозия под действием механических напряжений. [c.63]
Под коррозией понимают физико-химическое или химическое взаимодействие между металлом и средой, приводящее к ухудшению функциональных свойств металла, среды или включающей их технической системы. Химическое взаимодействие определяет, главным образом, химическую коррозию, характеризующуюся непосредственным взаимодействием реагирующих частиц металла и среды без возникновения электрического тока. Физикохимическое взаимодействие характерно для электрохимической и механо-химической коррозии, сопровождающейся возникновением электрического тока (ток коррозии). При механо-химической коррозии (коррозионно-меха-ническом изнашивании) электрохимические процессы накладываются на механическое взаимодействие трение, напряжение, циклическое давление и др. В зависимости от вида коррозийной среды и условий протекания коррозионного процесса различают около 40 видов коррозии атмосферная, газовая, подземная, биокоррозия, контактная, коррозия при трении, щелевая и др. [c.365]
Несмотря на то, что доступ кислорода из Bosfljxa через значительный слой нефти весьма затруднителен, частая смена нефтепродукта и подтоварной воды, обогащенных кислородом воздуха, создает условия протекания коррозионному процессу с кислородной деполяризацией. [c.224]
Графический метод расчета скорости коррозии (икорр= /тах) позволяет в отличие от аналитического оценить величину коррозии для сложных случаев, соответствующих близким к реальным условиям протекания коррозионного процесса. Знание потенциала фж позволяет вычислить величину катодной и анодной поляризации [c.466]
Из сказанного можно сделать заключение, что многообразие требований и условий протекания коррозионных процессов не позволяют создать ингибитор, лригодный для защиты во всех условиях, для всех металлов. [c.96]
Итак, введение структурно-морфологического аспекта процесса селективной коррозии позволяет с единых кинетических позиций объяснить не только появление коидентради-онных границ коррозионной устойчивости твердых растворов, содержащих благородный металл, но и изменение указанных границ в зависимости от условий протекания коррозионного процесса. [c.168]
Таким образом, диффузионный механизм переноса кислорода через тонкие слои электролитов будет наблюдаться лишь в весьма тонких слоях порядка 30-10" см и ниже. Следует заметить, что наши результаты получены в опытах, проведенных в термостатированных условиях. В естественных условиях протекания коррозионных процессов эффективная толщина диффузионного слоя будет значительно меньше. Заслуживает внимания также то обстоятельство, что при переносе кислорода через тонкие слои эффективная толщина диффузионного слоя вследствие саморазмешивания пленок значительно ниже тех значений, которые принимаются для неразмешиваемых электролитов с естественной конвекцией, и составляет всего (30ч-150) . 10" см. [c.115]
Обобщение результатов поиска позволило в ряде случаев сделать важные выводы относ1гтел1.но зависимости ингибирующего эффекта от состава коррозионной среды и условий протекания коррозионного процесса. В связи с этим следует отметить, нанример, наблюдение [c.235]
chem21.info
Определение и классификация коррозионных процессов. Химическая и электрохимическая коррозия
При эксплуатации изделий из металлов и их сплавов приходится сталкиваться с явлением разрушения их под действием внешней среды. Разрушение металлов и сплавов вследствие взаимодействия их с окружающей средой называется коррозией.
Коррозия металлов наносит большой экономический ущерб. В результате коррозии выходят из строя оборудование, машины, механизмы, разрушаются металлические конструкции. Особенно сильно подвёргается коррозии оборудованиё, которое контактирует с агрессивными средами, например, растворами кислот, солей.
Коррозионное разрушение может затрагивать всю поверхность металла - сплошная (общая) коррозия, или отдельные участки - местная (локальная) коррозия. В зависимости от механизма процесса различают химическую и электрохимическую химическую коррозию.
Химическая коррозия — это разрушение металла из-за окисления его окислителями, находящимися в коррозионной среде.
Химическая коррозия протекает без возникновения электрического тока в системе. Такой вид коррозии возникает при контакте металлов с неэлектролитами или в газовой среде при высоких температурах (газовая коррозия).
Газовая коррозия встречается довольно часто. С ней мы сталкиваемся при коррозии металлов в печах, выхлопных трубах и т.п. Наиболее опасными для металлов компонентами газовой среды являются кислород, пары воды, оксид углерода (IV), оксид серы (IV). Коррозионное разрушение железа и его сплавов на воздухе обусловлено окислением его кислородом воздуха.
С повышением температуры скорость газовой коррозии возрастает. Наибольший вред приносит электрохимическая коррозия.
Электрохимической коррозией называется разрушение металла при контакте с электролитами с возникновением в системе электрического тока.
Коррозия - это разрушение металлов в результате химической и электрохимической реакции.
Разрушение (порча), происходящие по физическим причинам не называются коррозией, а известно как эрозия или истирание или износ.
Термин "коррозия" относится только к химическому воздействию на металлы и не распространяется на неметаллические материалы. Пластмассы могут набухать, трескаться; дерево - расслаиваться или гнить.
Ржавление - коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из оксидов железа (гидратированных).
Цветные металлы, следовательно, корродируют, но не ржавеют.
Коррозионная наука.
Так как коррозия включает химическое превращение, для лучшего понимания коррозионных реакций необходимо знать основы химии и особенно электрохимии, так как коррозионные процессы по большой части являются электрохимическими.
Так как структура и состав металла зачастую определяют коррозионное поведение, надо быть знакомым с основами металлургии. Следовательно, химия и металлургия составляют фундамент при изучении коррозии, так же как биология и химия - при изучении медицины.
Коррозионная проблема.
Значение коррозионных исследований определяется тремя аспектами:
1 . Экономический.
Имеет целью уменьшение материальных потерь в результате коррозии трубопроводов, котлов, судов, мостов.
2. Повышение надежности оборудования.
Оборудование в результате коррозии разрушается с катастрофическими последствиями, например: сосуд высокого давления, паровые котлы, контейнера для токсичных материалов.
3. Сохранность металлического фонда.
Мировые ресурсы металла ограниченны, а потери в результате коррозии ведут к дополнительным затратам энергии и воды. И человеческий труд, затрачиваемый на проектирование и реконструкцию.
Причины коррозии металлов:
В природе все металлы (за исключением золота, серебра, металлов платиновой группы и в меньшей степени медь и ртуть) в основном встречаются в виде минералов, таких как сульфиды, силикаты, карбонаты. Для извлечения металла минерал необходимо подвергнуть реакции восстановления, используя в качестве восстановителя какое-либо вещество
 |
.
Химическое восстановление
Коррозия
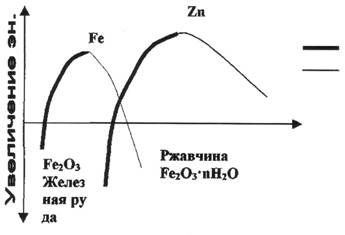
Рис 1. Изменение во времени химической энергии при восстановлении оксидов в металлы и в ходе обратной реакции коррозии
2Fе2О3 + ЗС  4Fе + ЗСО2 (гематит)
4Fе + ЗСО2 (гематит)
2ZnО + С  2Zn + СО2
2Zn + СО2
Из графика (рис.1) видно, что металлический Zn энергетически менее стабилен, чем Fе и в атмосферных условиях имеет тенденцию превращаться в сложную смесь из гидроксида и основного карбоната и т.п. Однако, если ржавчина, образующаяся на стали представляет собой рыхлую массу, почти не защищает поверхность металла от проникновения Н2О и О2, то продукты коррозии Zn обладают существенными защитными свойствами, благодаря чему Zn коррозирует медленнее, чем Fе. По этой причине мягкие стали защищают Zn покрытием.
Типы коррозионных разрушений:
I. По характеру изменения поверхности металла или степени изменения физико-механических свойств.
Различают 5 основных типов коррозии:
1. Равномерная (общая или сплошная) - ржавление железа или потускнение серебра, высокотемпературное окисление металлов.
Скорость равномерной коррозии выражают в разных единицах мм/год или г/м2сутки. Например, сталь в морской воде коррозирует с постоянной скоростью ~ 0,13 мм/год, т.е. 2,5 г/м2сутки.
2. Местная коррозия - разрушение отдельных участков поверхности металла. Она имеет неодинаковую степень разрушения. Наиболее характерными видами местной коррозии являются коррозия в виде пятен, язв, точечная, межкристаллическая. Местная коррозия бывает трех типов:
а) точечная (питинг) - разрушает металл в виде отдельных точечных поражений, перерастающих в сквозные (коррозия нержавеющей стали в морской воде).
 |
 б) межкристаллическая коррозия (МКК) - это разрушение на границах зерен, приводящие к потери прочности и пластичности
б) межкристаллическая коррозия (МКК) - это разрушение на границах зерен, приводящие к потери прочности и пластичности
Межзеренное вещество, действующее как анод, контактирующее с большой поверхностью самих зерен, являющейся катодом. Коррозия протекает быстро, глубоко проникая в металл и приводя иногда к катастрофическим разрушениям. Нержавеющие стали или дюраль подвергнутые неправильной термообработке, склонны к (МКК) в зонах сварки.
в) транскристаллитная - рассекающая металл трещиной прямо через зерна. Растрескивание металла под действием периодических или растягивающих напряжений в коррозионной среде называют коррозионной усталостью.
3. Избирательная - коррозия, которой подвержены сплавы, содержащие несколько структурных составляющих.
4. Обесцинкование - это вид разрушения цинковых сплавов, например латуни, при котором преимущественно корродирует цинк, а медь остается на поверхности в виде пористого слоя. Прокорродировавшее, таким образом, изделие нередко сохраняет исходную форму и может показаться не поврежденными, но его прочность и особенно пластичность значительно снижены.
Подвергшаяся обесцинкованию латунная труба способна выдерживать внутреннее давление воды, однако разрушиться при гидравлическом ударе или проведении ремонтных работ.
5. Разрушение окисных пленок на поверхности металлов. При повреждении пленки А12Оз на алюминиевом изделии, находящемся в морской воде, возникает электролит 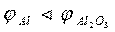 .
.
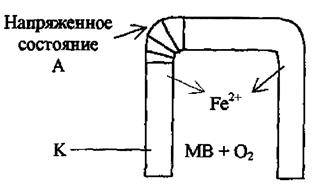 |
Различные внутренние механические напряжения  напр. <
напр. <  ненапр. Поэтому в первую очередь будут растворяться напряженные участки металла. Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
ненапр. Поэтому в первую очередь будут растворяться напряженные участки металла. Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
II. По механизму реакции взаимодействия с окружающей средой различают:
1. Химическую.
2. Электрохимическую.
Особо выделяют биологическую коррозию идущую под влиянием продуктов жизнедеятельности бактерий и микроорганизмов и радиационную коррозию, протекающую под воздействием радиоактивного излучения.
Электрохимическая коррозия - это разрушение металлов и сплавов под действием жидкостей электролита. Электрохимическая коррозия осуществляется как гальванический процесс за счет разности электрохимических потенциалов различных частей изделия, если оно сделано из разных металлов или за счет разности потенциалов различных участков поверхности одного и того же металла, если он находится в различных концентрациях электролита.
В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому). При этом в результате взаимодействия металла с молекулами воды из коррозионной среды на нем протекают два процесса: окисление металла Ме (анодный процесс) и восстановление окислителей — компонентов среды (катодный процесс). Как правило, в качестве окислителей выступают ионы водорода (коррозия с водородной деполяризацией) или растворенный в воде кислород (коррозия с кислородной деполяризацией). В первом случае при катодном процессе выделяется водород, а во втором образуются гидроксид ионы. Участки поверхности металла, на которых протекают процессы окисления и восстановления, называют соответственно, анодными и катодными. Далее рассмотрим условия, при которых возможно протекание электрохимической коррозии.
Условия возникновения электрохимической коррозии:
1. Контакт двух металлов в электролите.
 |
А: Ме1° - 2е  Ме
Ме 
К: 1) 2Н++ 2е  Н2, если рН < 7 (среда кислая)
Н2, если рН < 7 (среда кислая)
2) О2 + 2Н2О + 4е  4ОН
4ОН 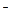 (среда нейтральная)
(среда нейтральная)
При контакте двух разнородных металлов образуется гальванопара в которой разрушается более активный металл. Наибольшая коррозия вблизи места контакта и по мере удаления ослабевает. При этом большую роль играет электропроводность среды. Интенсивность коррозии зависит от разности потенциалов между металлами более активный разрушается тем быстрее, чем больше разность потенциалов контактирующих металлов. Большое влияние оказывает соотношение площадей контактирующих поверхностей. Это связано с тем, что V коррозии определяется не только силой тока, но и плотностью тока (i) i=I/S. Поэтому опасно такое сочетание металла, при котором анод имеет малую площадь, а катод большую (Sан< Sкат). В этом случае анод малой площадью корродирует очень интенсивно.
Для разработки мероприятий по защите конструкций от контактной коррозии необходимо руководствоваться ГОСТ 9.005-92 "Машины, приборы и другие технические изделия. Допустимые и недопустимые контакты металлов"
При выборе металла должны учитывать:
1. Потенциал, площадь поверхности;
2. Между деталями из разнородных металлов нужно использовать, где это возможно изолирующие прокладки, мастики, герметики;
3. На контакт сопрягаемых деталей следует наносить изолирующее покрытие.
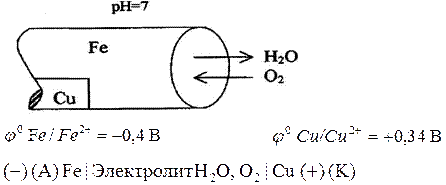
Анод: Fе° - 2е  Fе2+
Fе2+
Катод: О2 + 4е + 2Н2О  4ОН
4ОН 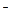
2Fе + О2 + 2Н20  2Fе(ОН)2
2Fе(ОН)2
4Fе(ОН)2 + О2 + 2Н2О  4Fе(ОН)3
4Fе(ОН)3
ржавчина Fе(ОН)2 Fе(ОН)3 FеООН 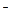
2. Различная аэрация (омывание газами).
То есть это различный доступ кислорода к одной и той же детали, такая коррозия встречается по ватерлинии судов.
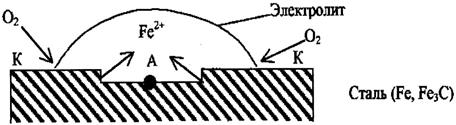 |
А: Fе° - 2е  FеC
FеC
К: О2 + 4е + 2Н2О  4ОН
4ОН 
В центре капли, куда доступ кислорода мал, разрушается сам металл (становится эта часть поверхности анодом). По периферии, где проникновение О2 будет большим, он адсорбируется на поверхности металла и защищает его от действия электролита.
Вещества, принимающие на катоде электроны, называются деполяризаторами (вещества уменьшающие поляризацию) т.е. в данном случае кислород является деполяризатором. Наличие деполяризаторов усиливает коррозию. В качестве деполяризаторов могут быть и ионы водорода, которые при этом восстанавливаются. Поэтому понижение рН (подкисление) усиливает процесс коррозии.
3. Неоднородность поверхности металла.
Неоднородность поверхности металла возникает в результате:
а) повреждения оксидной пленки при изгибе, прессовании.
А: А1 - Зе  А1
А1  А: Fе - 2е
А: Fе - 2е  Fе2+(кислая среда)
Fе2+(кислая среда)
К: 2Н++ 2е  Н
Н  К: 2Н++ 2е
К: 2Н++ 2е  Н
Н 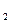
Коррозия с водородной деполяризацией, наличие деполяризатора для коррозии вредно. Оксидная пленка разрушается еще ионами NО3-, SО4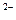 , Сl
, Сl  -ионы активаторы.
-ионы активаторы.
(-)А1 | Морская вода, О2 | А12О3 (+)
(-)А: А1 - Зе  А1
А1 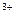
(+)К: О2 + 2Н2О + 4е  4ОН
4ОН 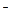
4А1 + ЗО2 + 6Н2О  4А1(ОН)3
4А1(ОН)3
б) Неоднородность металлов и сплавов.
Рассмотрим, контакт двух форм стали, цементита (Fе3С) со
значительным содержанием углерода и перлита с меньшим содержанием углерода. В связи с тем, что потенциал перлита меньше потенциала цементита, в образовавшемся гальваническом элементе протекают реакции. Содержание углерода может уменьшаться в около шовной зоне после сварки.
(-)перлит | морская вода | цементит (+)
(+) анод Fе° - 2е 
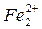
катод О2 + 4е + 2Н2О  4ОН
4ОН 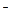
2Fе + О2 + 2Н2О  2Fе(ОН)2
2Fе(ОН)2
в) Неоднородная обработка металла.
Плохо обработанная поверхность металла – анод, хорошо обработанная - катод. Поэтому, изделия находящиеся в агрессивных средах, должны иметь одинаковую обработку поверхности.
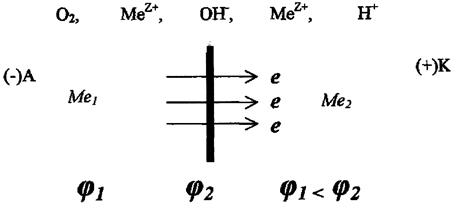
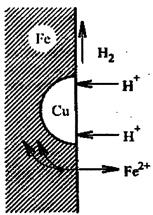 Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ или неметаллические включения. Например, железо загрязнено примесями меди. При этом возникают гальванические микроэлементы (пары), схема действия которой показана на рис. Металл с более отрицательным потенциалом разрушается — ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация) (рис.2).
Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ или неметаллические включения. Например, железо загрязнено примесями меди. При этом возникают гальванические микроэлементы (пары), схема действия которой показана на рис. Металл с более отрицательным потенциалом разрушается — ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация) (рис.2).
|
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и случае образования микрогальванических элементов на поверхности одного металла) поток электронов направлен от более активного металла к менее активному (проводнику), и более активный металл корродирует. Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных электродных потенциалов те металлы, из которых образовался гальванический элемент (гальваническая пара).
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность (т. е. меньше рН), а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с ростом температуры.
Некоторые металлы при соприкосновении с кислородом воздуха или в агрессивной среде переходят в пассивное состояние, при котором резко замедляется коррозия. Например, концентрированная азотная кислота легко делает пассивным железо, и оно практически не реагирует с концентрированной азотной кислотой. В таких случаях на поверхности металла образуется плотная защитная оксидная пленка, которая препятствует контакту металла со средой. Переход металла в пассивное состояние чаще объясняется образованием на его поверхности хемосорбированного слоя атомов кислорода. При этом атомы кислорода могут покрывать как всю поверхность металла, так и часть ее. Пассивации благоприятствуют легирование более легко пассивирующимся металлом, увеличение концентрации пассиваторов около поверхности металла и другие факторы.
Защитная пленка всегда имеется на поверхности алюминия. Подобные пленки в сухом воздухе образуются также на Ве, Сг, Zn, Та, Ni, Сu и других металлах. Кислород является наиболее распространенным пассиватором.
Пассивированием объясняется коррозионная стойкость нержавеющих сталей и сплавов.
В первую очередь будут растворяться напряженные участки металла.
Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
Похожие статьи:
poznayka.org


















