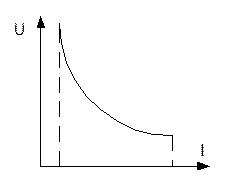Большая Энциклопедия Нефти и Газа. Электрод металлический
Металлический электрод - Большая Энциклопедия Нефти и Газа, статья, страница 1
Металлический электрод
Cтраница 1
Металлические электроды, покрытые труднорастворимой солью, этого же металла, называются электродами второго рода. Например, часто применяют каломелевый электрод, содержащий ртуть, покрытую осадком каломели Hg2Cl2, в растворе К. [1]
Металлические электроды изготовляют из малоуглеродистой стальной проволоки или прутков диаметром от 3 до 12 мм и длиной до 450 мм. Диаметр электрода выбирают в зависимости от толщины свариваемого металла. [2]
Металлические электроды служат присадочным материалом и употребляются в виде стержней длиной 300 - 400 мм, диаметром 1 - 12 мм. [3]
Металлические электроды должны обеспечивать получение сварных соединений с определенными физико-механическими свойствами при достаточно высокой производительности процесса сварки и обладать хорошими технологическими свойствами, позволяющими вести сварку на любом роде тока и в любых пространственных положениях. [4]
Металлические электроды, применяемые для резки под водой, должны иметь толстое водонепроницаемое ( изолирующее) покрытие. Вследствие того что покрытие такого электрода, охлаждаемое снаружи водой, плавится медленнее стержня электрода, на конце электрода образуется козырек, выступающий вперед в форме небольшой чашечки и способствующий устойчивому существованию газового пузыря и дуги. [5]
Металлические электроды улучшают качество резки. [6]
Металлические электроды изготовляются в виде прутков диаметром 1 - 12 мм и длиной до 500 мм для ручной сварки или в виде мотков проволоки для автоматической сварки. Наибольшее применение имеют электроды диаметром 4 - 8 мм. Для ручной сварки применяют обмазанные электроды с качественными и ионизирующими обмазками. Ионизирующие тонкие обмазки электродов применяются для создания устойчивости дуги, не защищая расплавленный металл от воздействия окружающего воздуха. Качественные ( толстые) обмазки, помимо создания устойчивой дуги, защищают расплавленный металл от окисления и насыщения азотом воздуха, а также легируют шов различными элементами, обеспечивая высокую прочность сварного соединения. [7]
Металлические электроды, специально закладываемые в землю для заземления электротехнических установок, называют искусственными за-землителями. Их используют в заземляющих устройствах при отсутствии естественных заземлителей или при слишком высоком сопротивлении последних. [8]
Металлические электроды, залитые в образцах, могут привести к образованию отслоений компаунда или к возникновению микро - и макротрещин в изоляции, которые затем будут способствовать появлению и развитию канала пробоя. [10]
Металлические электроды улучшают качество резки. [11]
Металлические электроды изготовляют из стальной сварочной проволоки диаметром от 2 до 6 мм, длина электрода в зависимости от его диаметра от 300 до 450 мм. [12]
Металлические электроды подразделяются на голые, тонко-обмазанные со стабилизирующим покрытием, толстопокрытые со специальной обмазкой. [13]
Металлические электроды по существующему общесоюзному стандарту делятся на ряд типов. Электроды типов Э-34, Э-42, Э-42 А, Э-46, Э-55 относятся к малоуглеродистым. Каждый тип электродов включает одну или несколько марок. Например, электроды ЦМ-7 и ОММ-5 относятся к типу Э-42, электроды УОНИ-13 / 45 - к типу Э-42 А, а марки ОЗС-4, АНО-3, АНО-4, МР-3 - к типу Э-46. [14]
Металлические электроды должны обеспечивать получение сварных соединений с определенными физико-механическими свойствами при достаточно высокой производительности процесса сварки. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Инертный металлический электрод - Большая Энциклопедия Нефти и Газа, статья, страница 1
Инертный металлический электрод
Cтраница 1
Инертные металлические электроды изготавливают из химически стойких металлов: золота, платины, иридия и др. Они служат переносчиками электронов от восстановленной формы к окисленной, и их потенциалы зависят от соотношения активностей этих форм в растворе. Стандартная конструкция электрода представляет собой металлический стержень, впаянный или вклеенный в нижний конец стеклянной или пластмассовой трубки. С помощью проводника металлический стержень присоединяют к измерительному прибору. Платиновые электроды используют для измерения окислительно-восстановительных потенциалов от - 0 1 до 0 9 В, золотые - от - 1 0 до 0 3 В. [1]
Хотя инертные металлические электроды не требуют особого ухода за ними, тем не менее состояние их поверхности от измерения к измерению меняется. По этой причине потенциометрические датчики с металлическими электродами характеризуются плохой воспроизводимостью и требуют градуировки при каждой чистке или замене электрода перед его использованием. Эти электроды редко применяются для прямых потенциометрических измерений. Обычно они используются для потенциометрического титрования или для обеспечения регулировки редокс-потенциалов в производственных процессах. [2]
Различают активные и инертные металлические электроды. [3]
При погружении инертного металлического электрода, например серебра или платины, в раствор электролита, например разбавленную Серную кислоту, на электроде устанавливается более или менее воспроизводимый начальный потенциал, который можно измерить с помощью чувствительного катодного вольтметра. [4]
Здесь снова требуется инертный металлический электрод, например золото или гладкая платина. Следует отметить, что при написании уравнения электрохимической реакции, протекающей в гальванической цепи с: окислительно-восстановительными электродами, химический символ восстановленной формы вещества должен быть помещен с той же стороны, где изображен на схеме электрод, на котором происходит реакция. [5]
Для измерения окислительно-восстановительного потенциала ( еН) раствора применяются инертные металлические электроды, на поверхности которых не протекают электродные реакции, а осуществляется лишь контакт с раствором. В отечественных еН - мет-рах в качестве рабочего электрода используется тонкослойный платиновый электрод, а в качестве электрода сравнения - хлорсеребряный. Поскольку при одинаковых окислительно-восстановительных свойствах еН зависит от рН раствора, обычно измерение первого показателя ведется параллельно с измерением второго. [6]
При увеличении этого времени возрастает дефектность пленки и поведение окисленного олова приближается к свойствам инертного металлического электрода. [7]
Основным элементом электрохимических преобразователей яв ляется электрохимический диод, представляющий собой герметич ную ячейку с двумя инертными металлическими электродами различ ной поверхности. [8]
Для измерения активностей ионов Ag, Hg2, Cu2 и др., а также окислительно-восстановительных потенциалов применяют активные и инертные металлические электроды. На поверхности таких электродов ( хотя и не всегда) устанавливается потенциал, который является функцией активности соответствующего иона. Однако в присутствии ионов более благородных металлов поверхность электрода покрывается слоем этого металла и приобретает совершенно иные электродно-активные свойства. Потенциал электрода зависит также от образования оксидной пленки на его поверхности. [9]
В первом случае применяют электрод из вещества, ионы которого содержатся в растворе. Во втором случае применяют инертный металлический электрод, чаще всего платиновый, потенциал которого зависит от соотношения концентраций окисленной и восстановленной форм ионов. [10]
В другой работе, опубликованной одновременно с первой, Виллард и Фенвик [25] показали, что действие таких электродов зависит от реакций растворенных газов на их поверхности; металлический электрод функционирует в качестве газового электрода, и потенциал определяется, таким образом, величиной упругости растворения газа, адсорбированного электродом. В системе, состоящей из двух инертных металлических электродов, разность потенциалов, соответствующая конечной точке для окислительно-восстановительных реакций, зависит от различия растворимости газов в обоих металлах. [11]
Хингидронный электрод является примером такого электрода. Эта смесь растворяется в исследуемом растворе, после чего инертный металлический электрод типа платины погружается в раствор, который соединяется посредством соляного мостика с каломельным полуэлементом. В следующей главе мы увидим, почему такой окислительно-восстановительный потенциал реагирует на ионы водорода. Он также неприменим в присутствии окислителей и восстановителей. [12]
В этом случае металл является лишь посредником в обмене электронами между окисленной и восстановленной формами вещества. Хотя в действительности все электроды являются окислительно-восстановительными, термин редокс-электрод обычно применяют только к инертным металлическим электродам, находящимся в контакте с окисленной и восстановленной формами окислительно-восстановительной системы. [13]
Электродные процессы протекают по весьма сложному механизму. Поэтому рассмотрение этих процессов в общем виде невозможно. Однако некоторые основные представления все же удается получить на основе простой модели. Рассмотрим некоторую систему, в которой протекает процесс электролиза. Система состоит из инертного металлического электрода, находящегося в контакте с окисляемой и восстанавливаемой формами ионных частиц. [14]
Страницы: 1
www.ngpedia.ru
Металлический электрод
Металлы и Сварка  Металлический электрод
Металлический электрод
Количество просмотров публикации Металлический электрод - 146
| Наименование параметра | Значение |
| Тема статьи: | Металлический электрод |
| Рубрика (тематическая категория) | Металлы и Сварка |
Электрод, у которого скачок потенциала определяется только активностью участников реакции, протекающей на его поверхности, принято называть обратимым.
Электродом называют электронопроводящую фазу (металл или полупроводник), контактирующую с ионным проводником (электролитом).
Равновесные электродные процессы
Электродные процессы представляют из себяокислительно-восстановительные реакции, протекающие на электродах. В ходе этих реакций происходит переход электрических зарядов из одной фазы в другую, благодаря чему на поверхности обоих фаз сосредотачиваются заряды противоположного знака. А на границе раздела фаз создается двойной электрический слой, которому соответствует определенный скачок потенциала.
В случае если через такой электрод не пропускать электрический ток, то на его поверхности не происходит никаких химических превращений.
Обратимые электроды исходя из свойств и устройства делятся на металлические электроды первого и второго рода, редокс-электроды и мембранные (ионные) электроды.
При опускании металлической пластинки в воду на её поверхности возникает отрицательный электрический заряд. Механизм его появления состоит в следующем. В узлах кристаллической решетки металлов находятся положительно заряженные ионы или нейтральные атомы, между которыми двигаются свободные электроны.
В водной среде катионы, расположенные на поверхности кристаллической решетки, гидратируются полярными молекулами воды и переходят в жидкую фазу, заряжая её положительно. Металл, в котором появился избыток электронов, приобретает отрицательный заряд (рис. 86).
Отрицательный заряд металлической пластинки препятствует дальнейшему переходу ионов металла в раствор и вызывает обратный процесс – переход его катионов из раствора на металл. При равенстве скоростей этих противоположно направленных процессов в системе устанавливается динамическое равновесие, в ходе которого пластинка и прилегающий к ней водный слой приобретают постоянный электрический заряд, одинаковый по величине, но противоположный по знаку. Величина этого заряда в данном случае будет зависеть от природы металла и от температуры жидкости.
Металлический электрод - понятие и виды. Классификация и особенности категории "Металлический электрод" 2014, 2015.
referatwork.ru
Электрод металлические - Справочник химика 21
Стеклянный цилиндр клеем из эпоксидной смолы крепится к большому фланцу 4. Сверху фланца крепятся электроизоляционные штанги 2, по которым перемещаются подвижные штанги /. К нижней части подвижных штанг крепится латунный диск 3 с втулкой и медной трубкой 7. При перемещении трубка уплотняется резиновым манжетом 14. К трубке припаивается круглый заземленный электрод 12, к которому при помощи фторопластовой изоляционной втулки II крепится потенциальный электрод 10. Высота втулки определяет нужное расстояние между электродами. Металлическая оплетка кабеля питания 15, подключаемая к земле , соединяется с заземленным электродом. Токоведущая жила кабеля припаивается к потенциальному электроду. Потенциальный электрод изготовляется в виде круглой решетки, заземленной в виде диска с большим количеством мелких отверстий. Электроды вместе с трубкой, диском и штангами могут вертикально перемещаться вдоль оси дегидратора. Необходимая напряженность электрического поля между электродами достигается регулировкой величины напряжения высоковольтной обмотки трансформатора, к которой через кабель питания подсоединяются электроды. В малом [c.87]
Элемент Даниэля представляет собой сосуд, разделенный пористой перегородкой на два отсека (рис. V. ). В одном из них находится раствор сульфата меди с погруженной в него медной пластиной, которая является положительным электродом элемента. В другом находится раствор сульфата цинка, в который погружена цинковая-пластина, являющаяся отрицательным электродом. Пористая перегородка препятствует смешению растворов, сохраняя при этом ионную электрическую проводимость в элементе. Даниэль наблюдал, что при работе элемента (прн подключении к нему какого-либо приемника электрической энергии или при замыкании электродов металлическим проводником тока) масса цинковой пластины убывает, а масса медной — увеличивается за счет осаждения на ее поверхности металлической медн. [c.234]
На примере элемента Даниэля рассмотрим принцип действия гальванического элемента. Если замкнуть электроды металлическим проводником электрического тока или подключить к нему какой-либо приемник электрической энергии, то под действием его э. д. с. (Е = фсц — ф2п) электроны от более электроотрицательного 2п-электрода начнут перемещаться по металлическому проводнику к менее электроотрицательному Си-электроду. В результате этого на 2п-электроде создастся некоторый недостаток электронов, а на Си — избыток по сравнению с содержанием их на электродах в исходном (неработающем) состоянии. Это приведет к установлению на электродах гальванического элемента неравновесных электростатических потенциалов меньшего, чем равновесный — на цинковом (ф2п фси)- Следовательно, термодинамическое равновесие в системе нарушится. [c.238]
Схема метода. Примесь меди в никеле может составлять от нескольких сотых долей процента до 0,5%. Для определения меди навеску никеля растворяют в азотной кислоте и выделяют медь из кислого раствора на платиновом катоде, применяя в качестве анода (внутреннего электрода) металлический алюминий. [c.210]
Соединение электродов металлическим проводником приводит к [c.255]
Соединение электродов металлическим проводником приводит к возникновению электрического тока. Следовательно, в этой системе возникает электродвижущая сила — ЭДС элемента. 3)та ЭДС способна совершать работу по переносу электрона по металлическому проводнику (а следовательно, и любые виды работы, в которые можно преобразовать энергию электрического тока) за счет химической реакции окисления — восстановления. Таким образом, гальванический элемент представляет собой устройство, в котором уменьшение термодинамического потенциала в результате окислительно-восстановительной реакции преобразуется в энергию электрического тока. [c.294]
Обращение с металлическими электродами. Металлические электроды применяют Б виде пластинок, проволок, сеток, стержней или цилиндрических палочек. [c.61]
Отводные трубки из сосудов / и 2 опущены в сосуд 3 с раствором хлорида калия. Последний служит для устранения так называемого диффузионного потенциала, т. е. потенциала, возникающего на границе двух растворов. Если соединить электроды металлическим проводником, то электроны будут двигаться от цинка к платине, где они поглощаются ионами 11+. Цинковая пластинка при этом заряжена отрицательно, а платиновая — положительно. [c.157]
Потенциалы газовых электродов. Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы. Лучше всего удовлетворяют этому условию платина и платиновые металлы, поэтому они чаще всего используются при создании газовых электродов. [c.199]
Если растворы в сосудах I и II соединить электролитическим III, а платиновые электроды—металлическим IV проводниками, то в результате движения электронов из области с более высоким отрицательным потенциалом [c.147]
В последнее время появились вакуумные дуговые печи (рис. 0-2,6), которые также можно отнести к дуговым печам прямого действия. В вакуумных дуговых печах с нерасходуемым электродом дуга горит между последним и ванной жидкого металла в печах с расходуемым электродом дуга горит между расплавляемым металлом (расходуемый электрод) и жидкой ванной. Камера печи не имеет футеровки стенки ванны (кристаллизатор, тигель гарниссаж-ной печи) охлаждаются водой электрод — металлический вертикальный, поэтому в печах можно получить еще большие объемные мощности, чем в сталеплавильных, и проводить наиболее высокотемпературные процессы (плавка тугоплавких металлов — молибдена, вольфрама, ниобия, тантала). [c.4]Дистиллированная вода Платиновые электроды Металлические аноды. [c.35]
Классические потенциометрические электроды Металлические индикаторные электроды [c.395]
Определение вели следующим образом. В корундовый тигель, куда помещали концы электродов (металлического и коксового), заливали олово для лучшего контакта. Как известно [2], олово имеет ничтожный эффект Холла и потому является пригодным металлом для наших целей. Тигель вставляли в печь (рис. 4) и олово постепенно нагревали до 600—700°. Электрод из кокса присоединяли к милливольтметру медным проводом диаметром 3 мм и длиной 1 м. Металлический электрод одним концом присоединяли непосредственно к милливольтметру. [c.146]
| Рис. 5. Величина т. э. д. с. в пределах 300—700° на контакте электродов металлических и изготовленных из различных коксов (знак полюса — для электродов из коксов). |  |
В гальваническом элементе сами по себе равновесные электроды образуют неравновесную систему. Причиной неравнрвесности является разница плотностей электронов в металлах и, следовательно, стремление их переходить от одного металла к другому по внешней цепи. Одновременно во внутренней цепи происходит перенос ионов. Например, если во внешней цепи (рис. 11.2) электроны перемещаются слева направо, то на левом электроде протекает реакция окисления Mi -> +ze , а на правом — реакция восстановления - -ze -> М2. Катионы во внутренней цепи движутся от М к М2. Перенос катионов происходит до тех пор, пока не создается определенное (равновесное) для каждой температуры соотношение концентраций (активностей) электролитов в двух растворах. В качестве примера может служить цинковый элемент Якоби — Даниэля (рис. 11.3). Разомкнутый элемент находится в затормо женном неравновесном состоянии и может пребывать в этом состоянии как угодно длительно. Замыкание электродов металлическим проводником снимает торможение. На Zn-электроде (электрохимически более активном) протекает термодинамически необратимый процесс [c.168]
Любая электрохимическая цепь в принципе может служить источником электрического тока. При соединении крайних электродов металлическим проводником вследствие наличия э.д.с. по проводнику начинают двигаться электроны от электрода с более отрицательным потенциалом к электроду с менее отрицательным потенциалом. Одновременно на поверхности электродов происходят электрохимические реакции, энергия которых служит источником электрической энергии, выделяющейся во внешней цепи. По разным причинам (малая электрическая емкость, малая скорость и необратимость химических реакций, физические изменения электродов при эксплуатации и т. д.) ббль" шая часть цепей не может быть практически использована для получения электрического тока, и лишь немногие имеют прикладное значение в качестве химических источников тока. [c.598]
Металлические электроды первого рода — это обратимые от носительно катиона металла электрода. Металлические элек троды второго рода состоят из металла, покрытого слоем его труд норастворимой соли и погруженного в раствор какой-нибудь легко растворимой соли с тем же анионом [c.174]
Потенциалы отдельных электродов в расплавленных электролитах измеряются с помощью подбираемых для каждого расплава электродов сравнения. В качестве электродов сравнения могут быть использованы металлические (Pt, Мо, РЬ, Ag и др.), водородный, стеклянный, кислородный и хлорный электроды. Последний представляет собой графитовый стержень, омываемый хлором. В кислородном электроде металлический стержень или расплавленный металл омывается газообразным кислородом. Широко применяется и натриевый электрод сравнения [Na (Sn) Na l], [c.470]
Активным веществом положительного электрода свинцовоцинкового элемента является диоксид свинца, активным веществом отрицательного электрода — металлический амальгамированный цинк. В качестве сепаратора используют кислотостойкие синтетические ткани или нетканый материал. Электролитом служит концентрированная серная кислота. [c.252]
В меркуриодидном электроде металлическая ртуть находится под насыщенным раствором K I (100 мл), в котором растворено 4,2 г иоднда калия н 1,3 г иодида ртутн (И). [c.160]
Сравниваемый со стаидартным водородным электродом металлический электрод должен также находиться при стандартных условиях, т. е. в растворе с концентрацией ионов этого металла. .. г-ион/л и при температуре. .. °С. В этом случае потенциал сравниваемого металла называется. .. электродным потенциалом. [c.100]
Наращивание и перепуск элек тродов осуществляют на печи. Чтобы не увеличивать простоев печи, их стараются производить между плавками. Недостатками такого метода являются тяжелые условия работы персонала на печи и легкость поломки ниппеля при навинчивании секции электрода. Поэтому на крупных печах наращивание и перепуск электродов ведут иначе. В пролете, кран которого проходит над печью, устанавливают специальную стойку (этажерку), в которой стоят заранее наращенные электроды. При смене отработанной электродной свечи ее подхватывает крюк крана за кольцо ввинченного в верхний электрод металлического ниппеля электрододержатель ослабляют, электрод извлекают из печи, переносят к стойке и устанавливают в одно из свободных гнезд. Готовая электродная свеча поднимается на печь и закрепляется в электродо- [c.77]
Окисление 2п И восстановление Сй можно осуществить на электродах гальваническою алелектв (рис. 122), который в данном случае состоит из цинкового и медного электродов, погруженных в растворы соответственно 2п804 и Си304. Сосуды с растворами соединены И-образной трубкой, заполненной каким-либо электролитом. Когда соединяют электроды металлическим проводником, начинается окислительно-восстановительная реакция. На цинковом электроде (аноде) происходит потеря электронов — окисление цинка на медном электроде (катоде) происходит соединение электронов — восстановление ионов меди [c.245]
Величина термоэлектродвнжущей силы иа контакте двух электродов (металлических и изготовлеиных из различных коксов) при нагревании от 300 до 700° [c.147]
Наблюдавшийся на примере серебряной формы цеолпта X мас-соперенос наглядно показывает, что проводимость цеолита связана с перемещением катионов на цинкОвом электроде образовались ионы цинка, а на противоположном золотом электроде — металлическое серебро. Наблюдаемый массоперенос исключает возможность рассмотрения катионных вакансий в качестве носителей заряда. Поскольку зависимость проводимости от размера кристаллитов в цеолите отсутствует, измеренная электропроводность отражает перемещение ионов по всему объему цеолпта, а не только по поверхности. [c.408]
Полярография (предложена в 1922 г. чешским ученым Яросл. Гейровским). Этот метод является одним из важнейших электрохимических методов, в основе которого лежат процессы электроокисления или электровосстанов-лення на ртутном капающем электроде. Ток электрохимической реакции зависит от потенциала и концентрации определяемого вещества, а предельный ток пропорционален концентрации. В качестве электродов сравнения применяют насыщенный каломельный электрод, металлическую ртуть на дне сосуда (донная ртуть). [c.42]
chem21.info
Железный электрод - Большая Энциклопедия Нефти и Газа, статья, страница 3
Железный электрод
Cтраница 3
На железном электроде, хотя его равновесный потенциал мало отличается от равновесного потенциала кадмия, соотношение потенциалов выделения металла и водорода иное: восстановление оксидов железа происходит с большим перенапряжением ( около 0 25 В в начале заряда), а водородное перенапряжение на железе мало. Поэтому одновременно с восстановлением железа почти с самого начала заряда происходит разряд ионов водорода. В ходе заряда доля тока, расходуемая на выделение водорода, растет, а доля тока, идущая на восстановление железа, падает. [31]
Тщательно зачищают железные электроды и устанавливают их в штативе стилоскопа. [32]
Катодом является железный электрод; анодом - графитовый. [33]
Тщательно зачищают железные электроды и устанавливают их в штативе стилоскопа. [34]
Покрытые никелем железные электроды, вследствие их большей магнитной проницаемости удается, естественно, лучше обезгажи-вать токами высокой частоты, чем электроды из чистого никеля. Из этих же соображений необходима осторожность при обезгаживании высокой частотой электродов и экранов, находящихся вблизи стеклянных ножек или имеющих с ними тепловой контакт. [36]
Катодом служит железный электрод; анодом - графитовый. [37]
Катодная поляризация железного электрода в щелочных растворах по существу не отличается от поляризации других металлов, если не считать ранее отмеченной способности активированной поверхности железа окисляться даже при отрицательных потенциалах. В чистом растворе щелочи, не содержащем ионов железа, на железном катоде может протекать только один процесс - выделение водорода. Если в электролите содержатся ионы железа ( или другого металла с более положительным потенциалом осаждения, чем потенциал выделения водорода), то при катодной поляризации на электроде могут одновременно протекать два катодных процесса - выделение водорода и разряд ионов железа ( или другого металла) с осаждением его в виде металлической губки. Растворение катодно заряженных поверхностей железа в этих условиях происходить не должно. [38]
Активная масса железного электрода закладывается в ламели либо в виде восстановленного железного порошка, либо в виде электропроводящего магнетита Fe304; последний применяется чаще. [39]
Для изготовления железного электрода наиболее выгодно применение природной обогащенной магнетитовой руды, поскольку при этом исключается операция термического восстановления оксидов железа. [40]
При погружении железного электрода в раствор серной кислоты ( при фиксированном значении потенциала, лежащем в пассивной области) в первые 3 - 5 мин происходит быстрое падение силы тока, связанное с установлением пассивного состояния металла, близкого к стационарному. В дальнейшем сила тока меняется незначительно. [42]
Стационарный потенциал железного электрода в щелочи, наоборот, отрицательнее потенциала водородного электрода в том же растворе примерно на 40 - 50 мв. Следовательно, железный электрод в отличие от кадмиевого способен к самопроизвольному растворению в щелочах с выделением водорода, что в свою очередь обусловливает наблюдаемый на практике значительный саморазряд. [43]
Скорость саморастворения железного электрода в принципе может быть снижена также путем повышения перенапряжения выделения на нем водорода. Но этот путь встречает еще большие затруднения, объясняющиеся тем, что в данном случае выделение водорода происходит с участием молекул воды, заполняющих жидкостную обкладку двойного электрического слоя. Следовательно, для уменьшения скорости выделения водорода необходимо вытеснить воду из двойного слоя. Практически решение этой задачи в настоящее время невозможно ввиду отсутствия веществ, которые, обладая более высокой, чем вода, диэлектрической постоянной, были бы способны адсорбироваться на железном электроде. [44]
При разряде железного электрода первичным процессом является, по-видимому, адсорбция, а затем разряд ОН - с образованием окислов железа. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Ионно-металлические электроды
Химия  Ионно-металлические электроды
Ионно-металлические электроды
Количество просмотров публикации Ионно-металлические электроды - 361
| Наименование параметра | Значение |
| Тема статьи: | Ионно-металлические электроды |
| Рубрика (тематическая категория) | Химия |
Ионно-металлический электрод – это металл, погруженный в раствор, содержащий собственные катионы (Меz+). Схема ионно-металлического электрода˸ Меº½Меz+ С(Меz+), где вертикальная черта обозначает поверхность раздела фаз металл−раствор; С(Меz+) – молярная концентрация катионов металла в растворе, моль/л.
При погружении металла в раствор катионы поверхностного слоя металла взаимодействуют с ориентированными у поверхности металла полярными молекулами воды. В результате взаимодействия происходит окисление металла, и ᴇᴦο гидратированные ионы переходят в раствор, а электроны остаются в металле˸ Ме – zē → Меz+.
Этому равновесию соответствует равновесный потенциал ионно-металлического электрода φ(Ме), величина которого зависит от свойств металла φº(Ме), молярной концентрации ᴇᴦο ионов в растворе и температуры (Т, К). Эта зависимость выражается уравнением Нернста и при Т = 298 К имеет вид˸
φ(Ме) = φº(Ме) + lg C(Ме ), В (вольт)
где φº(Ме) – стандартный потенциал ионно-металличес-кого электрода в растворе с концентрацией катионов металла (Me2+), равной 1моль/л и Т=298К, φº(Ме) характеризует окислительно-восстановительные свойства металла;
z – число электронов, принимающих участие в электродной реакции.
Ионно-металлические электроды - понятие и виды. Классификация и особенности категории "Ионно-металлические электроды" 2014, 2015-2016.
referatwork.ru
Электрод железный - Справочник химика 21
Условия съемки спектров. Спектрограф ИСП-28, щель 0,010 мм. Фотопластинки спектральные СП-1, чувствительность 0,5—1,2 ед. ГОСТ или СП-2, чувствительность 8—22 ед. ГОСТ. Генератор дуги ДГ-2, сила тока дуги 5—6 а (для искрового генератора ИГ-3 условия приведены в работе 4). Электроды — железные стержни [c.190]
После подготовки спектрографа устанавливают в штативе для электродов железные электроды, проверяют электрическую схему, зажигают на короткое время электрическую дугу и проверяют равномерность освещения щели спектрографа по световому пятну, которое должно совпадать с центром перекрестия на крышке щели спектрографа. При необходимости устанавливают источник света на оптической оси вместе с руководителем занятий. [c.46]
Необходимые приборы и материалы. 1. Спектрограф с кварцевой оптикой ИСП-30, ИСП-28 с трехлинзовой осветительной системой. 2. Генератор дуги переменного тока. 3. Секундомер. 4. Спектропроектор. 5. Электроды железные и угольные стержни диаметром —6 мм. 6. Фотографические пластинки — спектральные, тип I. 7. Контрольные задачи предлагает руководитель занятий. Объекты анализа в учебных и контрольных задачах металлы, сплавы, соли и растворы солей металлов. [c.58]
Кислородно-водородный электрод Железный электрод [c.432]
Порядок работы (при анализе сплавов). Подготовленный к анализу образец сплава должен иметь поверхность, хорошо зачищенную от окислов, следов краски и других загрязнений. Другой электрод—железный, угольный, дисковый или какой-либо иной— также должен быть хорошо зачищен и заточен. Этот электрод зажимают в держатель, а анализируемый образец помещают на столик (если исследуют сплав). Дуговой промежуток между ними устанавливают равным 3 мм по выдвижному шаблону. Зажигают дугу, включая генератор, барабаном со шкалой выводят в поле зрения окуляра нужную часть спектра, фокусируют линии вращением кольца на окуляре и оценивают интенсивности линий при помощи фотометрического клина. Так как барабан 4 имеет равномерную шкалу, не градуированную в длинах волн, то при работе следует использовать дисперсионную кривую для данного прибора или нанести на свободную часть шкалы отметки наиболее важных линий анализируемых элементов. Дисперсионная кривая либо прилагается к паспорту прибора, либо ее нужно построить по интенсивным линиям ряда элементов, например меди, цинка, кадмия, бария и др., или по линиям железа с использованием атласа спектральных линий железа. [c.140]
Для слива карбида из печи пробивают стальными штангами корку застывшего карбида в выпускном отверстии печи или же проплавляют его вспомогательным электродом (железным прутком). [c.126]
Перенапряжение для выделения водорода на железе, как уже сказано, невелико, поэтому скорость саморастворения железа значительная (/ 40% за месяц). Большой саморазряд и быстрая пассивация при низких температурах — основные недостатки железного электрода, препятствующие полной замене им более дорогого кадмиевого электрода. Железный электрод очень чувствителен к примесям. Активирующее действие оказывают окислы никеля, мышьяк, сурьма и сульфидная сера. (Никель облегчает зарядный процесс, а сера — разрядный.) [c.490]Кроме оценок, приведенных на рис. 141, можно определять молибден более точно [306] (таблица 17), при этом силу тока дуги поддерживают 5 а, межэлектродный промежуток устанавливают величиной 1,5 мм, электрод — железный. [c.143]
С этой целью замените в опыте 2 хлорсеребряный электрод железным полуэлементом. Сравните опытные данные с теоретически вычисленной величиной э.д.с. [c.162]
Что произойдет, если вместо меди взять графитовый электрод Железный Электрод из нержавеющей стали Алюминий Прикоснитесь в растворе к цинку алюминиевой прово--локой. [c.381]
Существует очень много способов борьбы против коррозии. Широко используются электрохимические методы защиты стальных конструкций на морских нефтяных промыслах, например на знаменитых Нефтяных Камнях в Каспийском море. При этом используют так называемые протекторы, представляющие собой слитки сплава Mg и А1, т. е. металлов, еще более химически активных, чем железо. Протекторы навешивают на погруженные в морскую воду части стальных эстакад. В результате устансиления разности потенциалов между электродами — железным (эстакада) к магний-алюминиевым (протектор) — Mg и А растворяются, а на железном электроде выделяется молекулярный водород (ион Н+ из воды разряжается на более электропо-ложительггом металле). Например, для магния [c.118]
Использование тока при заряде будет лучше, если процесс вести при большей концентрации ионов НРеОг", т. е. в более концентрированных растворах щелочи. При снижении плотности тока перенапряжение для выделения водорода падает резче, чем для выделения железа, поэтому уменьшается и выход железа по току. Применять при заряде очень большие плотности тока нельзя, так как у поверхности электрода раствор локально обеднеет ионами НРе02". Потенциал железного электрода в щелочи на А5мв отрицательней потенциала водородного электрода в том же растворе. Это является причиной непрерывного самопроизвольного растворения железного электрода в электролите. Перенапряжение для выделения водорода на железе, как уже сказано, невелико, поэтому скорость саморастворения железа получается заметной ( 40°/о за месяц). Большой саморазряд и быстрая пассивация при низких температурах — основные недостатки железного электрода, препятствующие полной замене им более дорогого кадмиевого электрода. Железный электрод очень чувствителен к примесям. Активирующее действие оказывают окислы никеля, мышьяк, сурьма и сульфидная сера. (Никель облегчает зарядный процесс, а сера — разрядный). [c.516]
Сплавы цинка. Из-за легкоплавкости сплавов на цинковой основе при анализе их применять дугу в качестве источника возбуждения затруднительно. Лучше применять искровое возбуждение. Магний в цинковых сплавах можно определять с удовлетворительной точностью с помощью стилометра [455]. Используется искровое возбуждение (многоцуговый режим), постоянный электрод — железный или медный, предварительное обыскривание 60 сек. Аналитические линии Mg 5183,62 — Ге 5202,34 А или Mg 5183,62 — Си 5153,14 А. Определяемые пределы 0,05—0,15%. [c.175]
Спектроскопические признаки для определения концентраций Сг даны в табл. 14.32. Постоянный подставной электрод — железный стержень определение следует начинать спустя минуту после зажигания дуги. Меняющиеся по интенсивности линии (во время горения дуги) надо сравнивать в моменты наибольшей их яркости, но не следует принимать во внимание редкие, очень яркие вспьш1ки линий. [c.412]
Н-образный стеклянный сосуд с двумя электродами, из которых один оловянный (с примесью свинца—в одном случае и (без примеси — в другом) с пр Илегающей к нему стеклянной трубкой с капиллярным концом второй электрод — железный иди медный. 2. Распределительный щиток с рубильником и реостатом. 3. Селеновый выпрямитель. 4. Аккумулятор. 5. Миллиамперметр на 500 ма. 6. Электролитичеокий ключ. 7. Стандартный каломельный электрод. 8. Промежуточный сосуд, 9. Прерыватель. 10. Выключатель тока (2 шт.). 11. Нуль-инструмент. 12. Компенсационная устанавка. 13. Ванна с холодной водой. [c.159]
Визуальные (стилометрические) методы количествен ного анализа используют для определения относительно. малых содержаний марганца,. цинка и натрия [58]. Применяется исмровое возбуждение (многоцуговый разряд). Подставной электрод—железный. Предварительное обыскривание пр И определении марганца и цинка 120 сек, при определении натрия 180 сек. [c.170]
Все схемы расположения электродов могут быть объединены в три группы пристенных электродов, сквозных или полусквоз-ных электродов и донных электродов. В последнее время на большинстве печей устанавливаются сквозные или полусквозные и донные электроды. Железные или стальные электроды, требующие воздушного охлаждения, выполняются только пристенными. Платиновые, молибденовые и графитовые электроды могут быть пристенными, сквозными или полусквозными и донными. [c.41]
Все схемы расположения электродов могут быть объединены в две группы группу пристенных электродов и группу сквозных или полусквозных электродов. В последнее время на большинстве печей устанавливаются сквозные или полусквозные электроды. Железные или стальные электроды, требующие воздушного охлаждения, выполняются только пристенными. Платиновые, молибденовые и графитовые электроды могут быть пристенными, сквозными или полусквозными. Форма электродов пристенных — параллелепипед (коробчатая) для железных или стальных материалов и пластинчатая для остальных материалов сквозных или полусквозных — стержневая. [c.54]
Как видно из рисунка, калориметрическая бомба состоит из двух главных частей нижней (толстостенного металлического стакаиа А) и ерхией (крьишии Б). В гаижнюю часть помещают Б тигеле Т вещество для сжигания, а через верхнюю наполняют из баллона калориметрическую бомбу кислородом под давлением 20 атмосфер. Через ту же крышку пропущены электроды ( 1, аг), по которым в бомбу дают ток и, накаляя им соединяющую электроды железную проволоку Я, поджигают вещество. [c.137]
Стандартные электроды (железные или медные) применяются в форме стержней диаметром от 6 до 12 мл концы их затачиваются на усеченный конус с площадкой диаметром 1—2 мм. Когда требуется большая производительность стилоскопной установки, предпочтительнее пользоваться медным дисковым электродом диаметром 100—120 мм, толщиной 1,5—2 мм. [c.126]
Определение кремния в феррохроме. Прп возбуждении спектра высоковольтной конденсированной искрой (ток 3—4 а, емкость 0,01. мкф, индуктивность около 0,01 мгн, искровой промежуток 3,5 Л1.и, электрод— железный) М. В. Бабаев [303] предложил определять кремни] по пр 1з- 1акам, приведе1 лм в табл це 26. [c.159]
chem21.info