Применение углекислого газа при сварке. Газ углекислотный
Польза, вред углекислого газа: действие на организм человека
От количества углекислого газа в кровяном русле человека зависит нормальное функционирование всех систем жизнедеятельности. Диоксид углерода повышает сопротивляемость организма к бактериальным и вирусным инфекциям, участвует в обмене биологически активных веществ. При физических и интеллектуальных нагрузках углекислый газ помогает поддерживать равновесие организма. Но значительное увеличение этого химического соединения в окружающей атмосфере ухудшает самочувствие человека. Вред и польза углекислого газа для существования жизни на Земле еще не до конца изучены.

Характерные особенности углекислого газа
Двуокись углерода, угольный ангидрид, углекислый газ — газообразное химическое соединение, не обладающее цветом и запахом. Вещество в 1, 5 раза тяжелее воздуха, а его концентрация в атмосфере Земли составляет приблизительно 0,04 %. Отличительной особенностью углекислого газа является отсутствие жидкой формы при увеличении давления — соединение сразу переходит в твердое состояние, известное как «сухой лед». Но при создании определенных искусственных условий двуокись углерода принимает форму жидкости, что широко используется для ее транспортировки и длительного хранения.
Интересный факт
Углекислый газ не становится преградой для ультрафиолетовых лучей, которые поступают в атмосферу от Солнца. А вот инфракрасное излучение Земли абсорбируется углеродным ангидридом. Это и становится причиной глобального потепления с момента образования огромного количества промышленных производств.
В течение суток организм человека поглощает и метаболизирует около 1 кг двуокиси углерода. Она принимает активное участие в обмене веществ, который происходит в мягких, костных, суставных тканях, а затем попадает в венозное русло. С потоком крови углекислый газ поступает в легкие и покидает организм при каждом выдохе.
Химическое вещество находится в теле человека преимущественно в венозной системе. Капиллярная сеть легочных структур и артериальная кровь содержат небольшую концентрацию углекислого газа. В медицине используется термин «парциальное давление», характеризующий концентрационное соотношение соединения по отношению ко всему объему крови.

Терапевтические свойства двуокиси углерода
Проникновение углекислого газа в организм вызывает у человека дыхательный рефлекс. Повышение давления химического соединения провоцирует тонкие нервные окончания посылать импульсы к рецепторам головного или (и) спинного мозга. Именно так происходят процессы вдоха и выдоха. Если уровень углекислоты в крови начинает повышаться, то легкие ускоряют его выделение из тела.
Интересный факт
Ученые доказали, что значительная продолжительность жизни у людей, проживающих в высокогорье, непосредственно связана с большим содержанием углекислого газа в воздухе. Он повышает иммунитет, нормализует обменные процессы, укрепляет сердечно-сосудистую систему.
В организме человека двуокись углерода является одним из важнейших регуляторов, выступая в качестве основного продукта наравне с молекулярным кислородом. Роль углекислого газа в процессе жизнедеятельности человека сложно переоценить. К основным функциональным особенностям вещества можно отнести следующие:
- обладает способностями вызывать стойкое расширение крупных сосудов и капилляров;
- способно оказывать седативное влияние на центральную нервную системы, провоцируя анестезирующее действие;
- принимает участие в продуцировании важнейших аминокислот;
- возбуждает дыхательный центр при увеличении концентрации в кровяном русле.
Если в организме ощущается острый дефицит углекислого газа, то все системы мобилизуются и повышают свою функциональную активность. Все процессы в организме направлены на восполнение запасов двуокиси углерода в тканях и кровяном русле:
- сосуды сужаются, развивается бронхоспазм гладкой мускулатуры верхних и нижних дыхательных путей, а также кровеносных сосудов;
- бронхи, бронхиолы, структурные отделы легких секретируют повышенной количество слизи;
- снижается проницаемость крупных и мелких кровеносных сосудов, капилляров;
- на клеточных мембранах начинает откладываться холестерин, что вызывает их уплотнение и тканевой склероз.
Совокупность всех этих патологических факторов в сочетании с малым поступлением молекулярного кислорода приводит к гипоксии тканей и снижению скорости течения крови в венах. Особенно остро ощущается кислородное голодание в клетках головного мозга, они начинают разрушаться. Нарушается регуляция всех систем жизнедеятельности: отекают мозг и легкие, снижается ритм сердечных сокращений. При отсутствии врачебного вмешательства человек может умереть.

Где используется углекислый газ
Углекислый газ находится не только в теле человека и в окружающей атмосфере. Многие промышленные производства активно используют химическое вещество на различных стадиях технологических процессов. Его применяют в качестве:
- стабилизатора;
- катализатора;
- первичного или вторичного сырья.
Интересный факт
Двуокись кислорода способствует преобразованию винограда во вкусное терпкое домашнее вино. При брожении сахара, содержащегося в ягодах, выделяется углекислый газ. Он придает напитку игристость, позволяет ощутить лопающиеся пузырьки во рту.На упаковке продуктов питания двуокись углерода скрывается под кодом Е290. Как правило, она используется в качестве консерванта для длительного хранения. При выпечке вкусных кексов или пирогов многие хозяйки добавляют в тесто разрыхлитель. В процессе приготовления образуются пузырьки воздуха, делающие сдобу пышной, мягкой. Это и есть углекислый газ — результат химической реакции между гидрокарбонатом натрия и пищевой кислотой. Любители аквариумных рыбок используют бесцветный газ в качестве активатора роста водных растений, а производители автоматических углекислотных установок помещают его в огнетушители.

Вред угольного ангидрида
Дети и взрослые очень любят разнообразные шипучие напитки за содержащиеся в них воздушные пузырьки. Эти скопления воздуха — чистый углекислый газ, выделяющийся при откручивании колпачка бутылки. Используемый в таком качестве, он не приносит организму человека никакой пользы. Попадая в желудочно-кишечный тракт, угольный ангидрид раздражает слизистые оболочки, провоцирует повреждение эпителиальных клеток.
Для человека с заболеваниями желудка крайне нежелательно употребление газированных напитков, так как под их воздействием усиливается воспалительный процесс и изъязвление внутренней стенки органов пищеварительной системы.
Гастроэнтерологи запрещают пить лимонады и минеральную воду пациентам с такими патологиями:
- острый, хронический, катаральный гастрит;
- язва желудка и двенадцатиперстной кишки;
- дуоденит;
- снижение перистальтики кишечника;
- доброкачественные и злокачественные новообразования желудочно-кишечного тракта.
Следует учесть, что по статистическим данным ВОЗ более половины жителей планеты Земля страдают от той или иной формы гастрита. Основные симптомы заболевания желудка: кислая отрыжка, изжога, вздутие живота и боли в эпигастральной области.
Совет
Если человек не в силах отказаться от употребления напитков с углекислым газом, то ему следует остановить выбор на слабогазированной минеральной воде.
Специалисты советуют исключить лимонады из повседневного рациона. После проведенных статистических исследований у людей, которые длительно пили сладкую воду с углекислым газом, были выявлены такие заболевания:
- кариес;
- эндокринные нарушения;
- повышенная хрупкость костной ткани;
- жировая дистрофия печени;
- образование конкрементов в мочевом пузыре и почках;
- нарушения метаболизма углеводов.
Сотрудники офисных помещений, не оборудованных кондиционерами, часто испытывают мучительные головные боли, тошноту, слабость. Это состояние у человека возникает при избыточном скоплении в комнате углекислого газа. Постоянное нахождение в такой обстановке приводит к ацидозу (повышению кислотности крови), провоцирует снижение функциональной активности всех систем жизнедеятельности.

Польза углекислого газа
Оздоровляющее действие двуокиси углерода на организм человека широко используется в медицине в терапии различных заболеваний. Так, в последнее время пользуются огромной популярностью сухие углекислые ванны. Процедура заключается в воздействии углекислого газа на тело человека при отсутствии посторонних факторов: давления воды и температуры окружающей среды.
Косметические салоны и лечебные учреждения предлагают клиентам проведение необычных врачебных манипуляций:
- пневмопунктуру;
- карбокситерапию.
Под сложными терминами скрываются газовые уколы или инъекции углекислым газом. Такие процедуры можно отнести как к разновидностям мезотерапии, так и к методикам реабилитации после перенесенных тяжелых заболеваний.
Совет
Перед проведением этих процедур следует посетить лечащего врача для консультации и тщательной диагностики. Как и все методики терапии, уколы с углекислым газом имеют противопоказания к применению.
Полезные свойства двуокиси углерода используются в терапии сердечно-сосудистых заболеваний, артериальной гипертензии. А сухие ванны снижают содержание свободных радикалов в организме, обладают омолаживающим действием. Углекислый газ увеличивает сопротивляемость человека вирусным и бактериальным инфекциям, укрепляет иммунитет, повышает жизненный тонус.
Заправка баллонов углекислотой (CO2): какое давление, состав
Баллон для углекислоты является одной из самых распространенных тар для хранения, с которой сталкиваются сварщики. В особенности это проявляется для тех, кто работает с мобильными установками, так как эти емкости относительно легко перевозятся и переносятся. С другими вариантами зачастую невозможно куда-либо выехать вообще, так как они обладают большой массой или являются стационарными. Баллон с углекислым газом пригодится для многих вариантов работ по сварке металла, что делает его весьма востребованным для данной сферы.

Заправка баллонов с углекислотой из другого баллона
Баллон помогает сохранить вещество под давлением. Только так можно добиться пребывания его в жидком виде, так как при нормальных условиях диоксид углерода с твердого сразу переходит в газообразное состояние. Заправка баллонов углекислотой может проводиться неоднократно, что делает применение более выгодным, так как со временем все сводится к себестоимости самого газа и стоимости услуг заправки, не включая цену баллона. В то же время, емкости должны проходить проверку на соответствие требованиям техники безопасности раз в несколько лет.
Область применения баллонов с углекислым газом 
Заправка баллонов с углекислым газом является весьма распространенной услугой, так как сфера применения данных изделий достаточно широка. Основным направлением можно считать сварку. Это самая распространенная область, где встречается большой расход вещества. Углекислота, как правило, не применяется в виде самостоятельного газа. Для защиты сварочной ванны от внешней среды ее смешивают с аргоном и другими газами. К горелке подключается несколько баллонов. Также требуется обеспечивать ванну веществами, которые снимут негативное воздействие оксидов.
Помимо сварки баллоны можно встретить в пищевой области. Они служат для газирования жидкостей и разнообразных напитков. Это может использоваться как в различных заведениях и учреждениях, так и в частной области. Заправка пневматического оружия, аксессуаров к нему и прочих устройств также может осуществляться с одного большого баллона.
Преимущества 
Данная тара стала основным средством хранения газов, причем это касается не только углекислоты, но и прочих веществ. Все это стало возможным благодаря преимуществам, которыми обладает ее конструкция:
- Главным плюсом можно считать то, что емкость может использоваться многократно;
- Заправка баллонов СО2 не единственная процедура, которую можно проводить с баллонами, так как после этого внутрь можно заправлять и другие газы;
- Баллоны обладают достаточной крепостью и надежностью, чтобы выдерживать падения, воздействие высоких температур и длительный срок эксплуатации.
Недостатки 
- Для хранения изделий требуется отводить специальное место с хорошей вентиляцией, чтобы не скапливался газ, вызывающий удушье;
- Со временем изделия изнашиваются и приходят в непригодность;
- Даже относительно небольшие детали баллона могут привести к такой ситуации, что он начнет пропускать газ;
- Само изделие обладает немалой стоимостью, так что на первых порах его покупка обойдется недешево;
- При транспортировке и переноске нужно действовать крайне аккуратно, так как любая неосторожность может привести к несчастному случаю.
Химический состав 
Состав химического вещества, при помощи которого происходит сварка полуавтоматом, выглядит следующим образом:
| Название элемента | Химическая формула |
| Диоксид углерода | СО2 |
Способы заправки баллонов 
Заправка баллонов углекислотой может осуществляться переливом газа из одного баллона в другой. Для этого используется специальное оборудование и переходники. Здесь нужно внимательно отнестись к весу тары, так как взвешивание является единственным вариантом, чтобы точно узнать, насколько хорошо наполнено изделие и сколько в нем газа очутилось после заправки.
Также используются специальные установки для нагнетания газа при помощи компрессора. Это более надежный и эффективный метод, который обеспечивает точную заправку с минимальным количеством потерь. Чтобы определить степень заправки здесь также следует использовать взвешивание. Данные методы используются как в частной сфере, так и в учреждениях, где предоставляется услуга по заправке.
Инструкция 
Если вам требуется заправить баллон углекислотой, то сначала нужно перевернуть донор вниз, чтобы вентиль оказался ближе к полу. Далее к нему требуется прикрутить шланг высокого давления. Он будет проводником для газа. Далее нужно взять баллон, в который будет поступать газ. На него ставится переходник для шланга. Затем происходит взвешивание пустого изделия. Донор и приемник соединяются при помощи шланга. На приемнике открывается вентиль, а затем эта процедура повторяется на доноре.
«Важно!
Не стоит переживать, если появилось тихое посвистывание, так как это всего лишь значит, что газ пошел.»
Когда прекратиться звук и в шлангах станет тихо, то следует закрыть вентиль донора. Это случится, примерно, через несколько минут. После этого можно отсоединить заправляемый баллон. Чтобы определить, сколько газа залили внутрь, нужно снова взвесить изделие. После этого нужно снять переходник со шланга. На данном этапе процедура заправки таким способом окончена.
Вторым способом является задувка углекислоты. Здесь применяется жесткий металлический переходник. Благодаря такому переходнику можно заправлять баллоны одинакового размера, подключать различные типы вещей и так далее. К примеру, можно заправить баллон огнетушителя. Методика проведения процедуры задувки при помощи переходника во многом напоминает аналогичную с гибким шлангом.
Баллон должен быть предварительно охлажден. При заправке донор нужно перевернуть вентилем вниз. Далее происходит подключение по вышеуказанной схеме. Закачка осуществляется в течение нескольких минут. Отличие состоит не только в использовании иного инструмента, но и в возможности подключать манометр, как дополнительное устройство.
Нет большой разницы, где заправлять баллон углекислотой, в домашних условиях или в специализированных точках, если все проводится с учетом техники безопасности. В домашних условиях эту процедуру можно осуществлять когда угодно. В некоторых точках заправки выдвигаются требования, что заправка ведется только пустых емкостей. В таком случае нужно стравить газ на свежем воздухе перед заправкой. Но по факту, разницы между заправкой полного и пустого баллона нет. В домашних условиях его можно до заправлять когда угодно.
Заключение
Главной опасностью пользования услугами в точках заправки является то, что там могут элементарно «обвесить». В итоге с растратами на дорогу, стравливанием лишнего газа и прочими расходами. Все может получиться очень невыгодно. В домашних условиях человек подвергает себя большей опасности, как во время хранения, так и во время непосредственной заправки. В любом случае, каждый сварщик неоднократно в своей карьере сталкивается с этой операцией и нужно уметь правильно ее выполнять. На сварочных постах имеются станции по заправке, что существенно упрощает эту процедуру и минимизирует участие мастера в данном деле.
svarkaipayka.ru
Применение углекислого газа при сварке
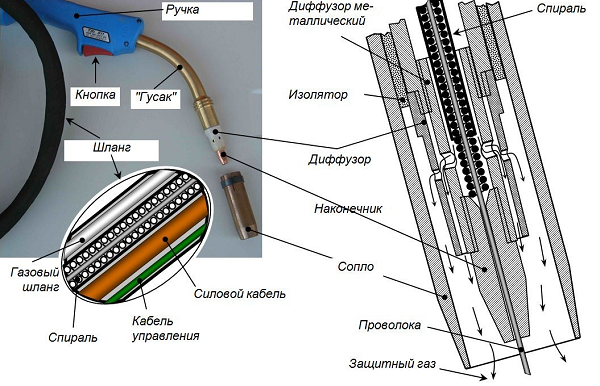
Углекислый газ нашел широкое применение в технологии сварки. Он применяется при различных сварочных технологиях. Его физические свойства позволяет использовать его в виде защитного газа, как при газовой, так и при электрической сварке. Углекислый газ бесцветный и не имеет запаха. Он может применяться при автоматической и полуавтоматической сварке. Для некоторых сварочных технологий не требуется применять углекислый газ в чистом виде, а в виде смеси с аргоном или кислородом.
Кроме сварки углекислый газ нашел применение и в пищевой промышленности. Он применяется в технологии консервации и изготовлении газированных напитков.
Углекислота широко применяется для тушения пожаров. Для этого существуют специальные углекислотные огнетушители.
Доставка углекислого газа.
В зависимости от объема сварочных работ, а также от временных или постоянных постов углекислый газ поставляется в виде:
— баллонов. Такие емкости сравнительно не большие. Они поставляются в основном на временные рабочие места. Баллоны являются многоразовыми емкостями, которые легко заправляются и перевозятся;
— транспортных емкостей. Такие емкости намного больше баллонов. Ими также могут снабжаться временные сварочные посты, но такие емкости не всегда могут быть доставлены непосредственно к рабочему месту. Для этого приходится использовать специальные трубопроводы или шланги;
— стационарного сосуда-накопителя. Такими сосудами обустраиваются постоянные сварочные посты с большими объемами сварочных работ;
— автономных станций. Такие станции снабжают постоянные сварочные посты с большим объемом работ. Углекислый газ поступает на рабочие места непосредственно от автономной станции, на которой он и производится. Таким образом, углекислый газ расходуется по мере его производства.
Автономная станция представляет собой отдельное производственное помещение, в котором получают диоксид углерода. На такой станции может вырабатываться газ не только для собственных нужд постоянных постов, но и для реализации другим цехам и участкам.
Преимущества углекислого газа:
— углекислый газ, по сравнению с другими видами газов сравнительно дешевый;
— он очень распространенный, его можно найти во многих местах;
— его удобно хранить и он не требует сложных мер безопасности;
— он прост в технологии и не требует выполнения сложных правил при его применении.
Недостатки углекислого газа:
— в процессе сварочных работ с применением газа выделяются оксиды, которые оказывают вредные действия на организм человека;
— необходимо применять меры для защиты от вредного воздействия оксидов.
Меры безопасности.
— углекислый газ не относится к взрывоопасным или токсичным веществам. Однако если его концентрация в закрытом пространстве превышает более 5%, то работники могут чувствовать нехватку кислорода, что приводит к затруднению дыхания. Поэтому хранить и применять газ необходимо в помещениях, оборудованных вентиляцией;
— газ в емкости находится в жидком состоянии. Если резко снижать давление он переходит в газообразное состояние. В процессе такого преобразования его температура снижается до минусовых отметок. Такая температура может обморозить открытые участки кожи.
svarkagid.com
Жидкая углекислота Википедия
| Диоксид углерода | |
| Диоксид углерода | |
| углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) | |
| CO2 | |
| бесцветный газ | |
| 44,01 г/моль | |
| газ (0 °C): 1,9768 кг/м³жидкость (0 °С, 35,5 ат): 925 кг/м³тв. (−78,5 °C): 1560 кг/м³ | |
| 8,5·10−5 Па·с (10°C, 5,7 МПа) | |
| 13,77±0,01 эВ[1] | |
| −78,5 °C | |
| −56,6 °C, 0,52 МПа | |
| 31,1 °C, 7,38 МПа | |
| 846 Дж/(кг·К) | |
| 25,13 кДж/моль | |
| 56,5±0,1 атм[1] | |
| 1,45 кг/м³ | |
| 124-38-9 | |
| 280 | |
| 204-696-9 | |
| E290 | |
| FF6400000 | |
| 16526 | |
| 1013 | |
| 274 | |
| 9 000 мг/м3 | |
| LC50: 90 000 мг/м3*5 мин (человек, ингаляция) | |
| Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. | |
| S9, S23, S36 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
Плотность при нормальных условиях 1,98 кг/м³ (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[2]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступают на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Свойства
Физические
Оксид углерода (IV) — углекислый газ, бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы:[3]:
2Mg+CO2→2MgO+C{\displaystyle {\mathsf {2Mg+CO_{2}\to 2MgO+C}}}Взаимодействие с оксидом активного металла:
CaO+CO2→CaCO3{\displaystyle {\mathsf {CaO+CO_{2}\to CaCO_{3}}}}При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
CO2+h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows H_{2}CO_{3}}}}Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
Ca(OH)2+CO2→CaCO3↓+h3O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\to CaCO_{3}\downarrow +H_{2}O}}} (качественная реакция на углекислый газ)KOH+CO2→KHCO3{\displaystyle {\mathsf {KOH+CO_{2}\to KHCO_{3}}}}Биологические
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[4].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[5].
Содержание углекислого газа в крови человека приблизительно таково:
| кПа | 5,5[6]—6,8[6] | 4,8 | 4,7[6]—6,0[6] |
| мм рт. ст. | 41—51 | 36 | 35[7]—45[7] |
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[8] при помощи реакции CO₂ + H₂O → H₂CO₃ → H⁺ + HCO₃⁻.
- Около 5—10 % углекислого газа растворено в плазме крови[8].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[8].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[8].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 40 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 322 дня]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[9] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО2, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа.[9]
CaCO3+2HCl⟶CaCl2+h3O+CO2↑{\displaystyle {\ce {CaCO3 + 2HCl -> CaCl2 + h3O + CO2 ^}}}
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[10]
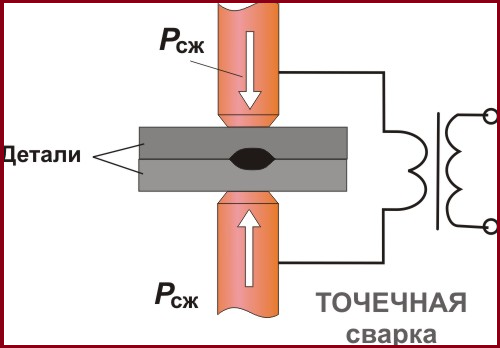
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[11].
Углекислый газ в природе
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан). Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[12].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Физиологическое действие
Углекислый газ нетоксичен, но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. По ГОСТу (ГОСТ 8050-85) углекислота относится к 4-му классу опасности.
Незначительные повышения концентрации, вплоть до 2—4 %, в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7—10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией[13].
Несмотря на то, что даже концентрация 5—7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO₂ существенно влияет на самочувствие человека.
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[14].
См. также
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0103.html
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Проверено 24 сентября 2013.
- ↑ А. С. Егоров. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ How much carbon dioxide do humans contribute through breathing?. Проверено 30 апреля 2009. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry. — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide. solarnavigator.net. Проверено 12 октября 2007.
- ↑ 1 2 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: "Himiâ", 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. ОПРЕДЕЛЕНИЕ СОСТАВА МЕТОДОМ ГАЗОВОЙ ХРОМАТОГРАФИИ С ОЦЕНКОЙ НЕОПРЕДЕЛЕННОСТИ. Часть 6. ОПРЕДЕЛЕНИЕ ВОДОРОДА, ГЕЛИЯ, КИСЛОРОДА, АЗОТА, ДИОКСИДА УГЛЕРОДА И УГЛЕВОДОРОДОВ C1 — C8 С ИСПОЛЬЗОВАНИЕМ ТРЕХ КАПИЛЛЯРНЫХ КОЛОНОК.
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. (1967). «Carbon Dioxide Tolerance Studies». Brooks AFB, TX School of Aerospace Medicine Technical Report SAM-TR-67-77. Проверено 2008-05-02.
Литература
- Вукалович М. П., Алтунин В. В. Теплофизические свойства двуокиси углерода. — М.: Атомиздат, 1965. — 456 с.
- Тезиков А. Д. Производство и применение сухого льда. — М.: Госторгиздат, 1960. — 86 с.
- Гродник М. Г., Величанский А. Я. Проектирование и эксплуатация углеслотных установок. — М.: Пищевая промышленность, 1966. — 275 с.
- Талянкер Ю. Е. Особенности хранения баллонов со сжиженным газом // Сварочное производство. — 1972. — № 11.
Ссылки
wikiredia.ru
Углекислый газ - это... Что такое Углекислый газ?
| Другие названия | углекислый газ, углекислота,сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.;771 кг/м³, жидкий;1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | 0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Оксиды | COC3O2C2OCO3 |
| Если не указано иное, данные даны дляматериалов при стандартных условиях (25 °C, 100 кПа)Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Не следует путать с Диоксин.Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
dikc.academic.ru
Углекислота - Википедия
| Диоксид углерода | |
| Диоксид углерода | |
| углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) | |
| CO2 | |
| бесцветный газ | |
| 44,01 г/моль | |
| газ 1,97680 кг/м³ж. 9250°С, 35,5 ат кг/м³тв. 1560-78,5 кг/м³ | |
| 8,5·10-5 Па·с (10°C; 5,7 МПа) | |
| 13,77±0,01 эВ[1] | |
| -78,5 °C | |
| -56,6°C; 0,52 МПа | |
| 31,1 °C; 7,38 МПа | |
| 846 Дж/(кг·К) | |
| 25,13 кДж/моль | |
| 56,5±0,1 атм[1] | |
| 1,45 кг/м³ | |
| 124-38-9 | |
| 280 | |
| 204-696-9 | |
| E290 | |
| FF6400000 | |
| 16526 | |
| 1013 | |
| 274 | |
| S9, S23, S36 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях) без запаха, с химической формулой CO2.
Плотность при нормальных условиях 1,98 кг/м³ (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[2]. Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Свойства[ | ]
Физические[ | ]
Оксид углерода (IV) — углекислый газ, газ без запаха и цвета, тяжелее воздуха, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации −78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (1 объём углекислого газа в одном объёме воды при 15 °С).
Химические[ | ]
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы:[3]:
2Mg+CO2→2MgO+C{\displaystyle {\mathsf {2Mg+CO_{2}\rightarrow 2MgO+C}}}Взаимодействие с оксидом активного металла:
CaO+CO2→CaCO3{\displaystyle {\mathsf {CaO+CO_{2}\rightarrow CaCO_{3}}}}При растворении в воде образует угольную кислоту:
CO2+h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows H_{2}CO_{3}}}}Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
Ca(OH)2+CO2→CaCO3↓+h3O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\rightarrow CaCO_{3}\downarrow +H_{2}O}}} (качественная реакция на углекислый газ) KOH+CO2→KHCO3{\displaystyle {\mathsf {KOH+CO_{2}\rightarrow KHCO_{3}}}}Биологические[ | ]
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[4].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, и уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[5].
Содержание углекислого газа в крови человека приблизительно таково:
| кПа | 5,5[6]—6,8[6] | 4,8 | 4,7[6]—6,0[6] |
| мм рт.ст. | 41—51 | 36 | 35[7]—45[7] |
Углекислый газ (CO2) транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Большая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[8], при помощи реакции CO2 + h3O → h3CO3 → H+ + HCO3-.
- Около 5 % — 10 % углекислого газа растворено в плазме крови[8].
- Около 5 % — 10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[8].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[8].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 40 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению). Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение[ | ]
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение[ | ]
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими[9].
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[10]
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31°С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31°С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа,— таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации[ | ]
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[11].
Углекислый газ в природе[ | ]
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[12].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность[ | ]
Углекислый газ нетоксичен, но по воздействию его повышенных концентраций в воздухе на воздуходышащие живые организмы его относят к удушающим газам (англ.). Незначительные повышения концентрации до 2—4 % в помещениях приводят к развитию у людей сонливости и слабости. Опасными концентрациями считаются уровни около 7—10 %, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), в зависимости от концентрации, в течение времени от нескольких минут до одного часа. При вдыхании воздуха с высокими концентрациями газа смерть наступает очень быстро от удушья[13].
Хотя, фактически, даже концентрация 5—7 % CO2 не смертельна, уже при концентрации 0,1 % (такое содержание углекислого газа наблюдается в воздухе мегаполисов) люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоких содержаниях кислорода большая концентрация CO2 сильно влияет на самочувствие.
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья и после удаления пострадавшего из загазованной атмосферы быстро наступает полное восстановление здоровья[14].
См. также[ | ]
Примечания[ | ]
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0103.html
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Проверено 24 сентября 2013.
- ↑ А. С. Егоров. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009
- ↑ How much carbon dioxide do humans contribute through breathing?. Проверено 30 апреля 2009. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry. — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм.рт.ст. с использованием коэффициента пересчёта 0.133322 кПа/мм.рт.ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide. solarnavigator.net. Проверено 12 октября 2007.
- ↑ Углекислотная установка для аквариума
- ↑ Большая Энциклопедия Нефти и Газа
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. ОПРЕДЕЛЕНИЕ СОСТАВА МЕТОДОМ ГАЗОВОЙ ХРОМАТОГРАФИИ С ОЦЕНКОЙ НЕОПРЕДЕЛЕННОСТИ. Часть 6. ОПРЕДЕЛЕНИЕ ВОДОРОДА, ГЕЛИЯ, КИСЛОРОДА, АЗОТА, ДИОКСИДА УГЛЕРОДА И УГЛЕВОДОРОДОВ C1 — C8 С ИСПОЛЬЗОВАНИЕМ ТРЕХ КАПИЛЛЯРНЫХ КОЛОНОК.
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. (1967). «Carbon Dioxide Tolerance Studies». Brooks AFB, TX School of Aerospace Medicine Technical Report SAM-TR-67-77. Проверено 2008-05-02.
Литература[ | ]
- Вукалович М. П., Алтунин В. В. Теплофизические свойства двуокиси углерода. — М.: Атомиздат, 1965. — 456 с.
- Тезиков А. Д. Производство и применение сухого льда. — М.: , 1960. — 86 с.
- Гродник М. Г., Величанский А. Я. Проектирование и эксплуатация углеслотных установок. — М.: , 1966. — 275 с.
- Талянкер Ю. Е. Особенности хранения баллонов со сжиженным газом // . — 1972. — № 11.
Ссылки[ | ]
encyclopaedia.bid
Углекислый газ — Циклопедия
| Углекислый газ | |
| Систематическоенаименование | Диоксид углерода |
| Традиционные названия | углекислый газ, двуокись углерода, сухой лёд (в твёрдом состоянии) |
| Химическая формула | CO2 |
| Состояние | бесцветный газ |
| Молярная масса | 44,01 г/моль |
| Плотность | газ 1,97680 кг/м³ж. 9250°С, 35,5 ат кг/м³тв. 1560-78,5 кг/м³ |
| Динамическая вязкость | 8,5·10-5 Па·с (10°C; 5,7 МПа) |
| Т. субл. | -78,5 °C |
| Тройная точка | -56,6°C; 0,52 МПа |
| Кр. точка | 31,1 °C; 7,38 МПа |
| Уд. теплоёмк. | 846 Дж/(кг·К) |
| Удельная теплота плавления | 25,13 кДж/моль |
| Растворимость в воде | 1,45 кг/м³ |
| Рег. номер CAS | 124-38-9 |
| RTECS | FF6400000 |
| S-фразы | S9, S23, S36 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Диоксид углерода (оксид углерода (IV), углекислый газ, CO2) — прочное химическое соединение, распространено в природных газах, содержащих его в количестве от нескольких процентов до практически чистого углекислого газа. Конечный продукт окисления углерода, не горит, не поддерживает горения и дыхания. Токсическое действие углекислого газа оказывается при его содержании в воздухе 3-4 % и заключается в раздражении дыхательных путей, головокружении, головной боли, шуме в ушах, психическом возбуждении, бессознательном состоянии.
Получение углекислого газа [3:20] Сухой лед - Удивительная подборка экспериментов с сухим льдом! (Химия) // Thoisoi [4:30]Удушающий газ, без цвета и запаха, является естественной составляющей атмосферы Земли. Углекислый газ является продуктом сжигания ископаемого топлива. Он способствует удержанию тепла на поверхности Земли и вносит основной вклад в глобальное потепление.
При температуре 20 °C в 1 объеме воды растворяется 0,88 объемов CO2. Водный раствор его имеет кисловатый вкус. В отличие от монооксида, диоксид углерода является солеобразующим оксидом — ангидридом угольной кислоты h3CO3.
Под давлением около 60 атм диоксид углерода при обычной температуре превращается в жидкость. В сжиженном состоянии в стальных баллонах его можно хранить и транспортировать. При сильном охлаждении он превращается в снегообразную массу (сухой лед), которая сублимирует (испаряется, не плавясь) при −78,5 °С.
Диоксид углерода не поддерживает дыхание и горение обычных видов топлива. Но некоторые активные металлы могут отнимать у него кислород. Так, например, зажженная свеча гаснет в атмосфере CO2, а зажженная магниевая лента продолжает гореть:
Незначительные количества CO2 безвредны для человека и животных, но при концентрации его в воздухе более 3 % по объему он становится вредным, а при 10 % и более — смертельным.
В народном хозяйстве диоксид углерода широко применяется в химической промышленности при производстве соды, мочевины и т. п., а также в производстве сахара, вина, пива, для изготовления газированной воды и т. д. Широко известны природные источники диоксида углерода в виде минеральных вод «Нарзан», «Боржоми» и другие. Спрессованный твердый CO2 под названием «сухой лед» применяют для охлаждения мяса, рыбы и других пищевых продуктов, которые быстро портятся. Сухой лед гораздо больше, чем обычный, снижает температуру и при испарении не оставляет никакой жидкости. В промышленности диоксид углерода получают разложением карбоната кальция:
В лабораторных условиях его обычно получают при действии соляной кислоты на мрамор:
- CaCO3 + 2HCl = CaCl2 + CO 2↑ + h3O
В природе диоксид углерода постоянно образуется при самых процессах: горении угля и других видов топлива, дыхании, брожении, гниении и т. п.
При выделении углекислого газа из почвы выработки и отсутствии активной струи воздуха в нижней её части могут образовываться застойные зоны с высокой концентрацией. В рудничной атмосфере углекислый газ присутствует всегда, потому что он образуется в большом количестве за счет биохимических и химических реакций окисления, протекающих в горных выработках. Конечно, выделения природного углекислого газа в горные выработки незначительны, исключением является выделение углекислого газа магматического происхождения в некоторых угольных и калийных месторождениях. Предельно допустимое содержание углекислого газа в шахтном воздухе 0,5-1 % (по объему). При 10 % наступает обморок, при 20-25 % — смертельное отравление. Первая помощь при отравлении заключается в вынесении пострадавшего на свежий воздух, проведении искусственного дыхания.
[править] Углекислый газ в атмосфере земли
По экспертной оценке ООН за 2016 год, содержание углекислоты в атмосфере выросло более чем на 45% по сравнению с доиндустриальным периодом[1].
По состоянию на 2018 год наибольшими источниками выбросов углекислого газа в атмосферу являются производственные предприятия, затем следует туристическая отрасль - выхлопы самолётов (до 10%), а так же предприятия общепита, рестораны и кафе[2].
[править] Концентрация углекислого газа в атмосфере Земли
Уровень углекислого газа в атмосфере[2]:
- XVIII—XIX век - не более 300 ppm (мл. на кубометр воздуха)
- 1958 год - 315 ppm
- 2018 год - 410 ppm
- Деркач Ф. А. Химия. — Львов: Львовский университет, 1968. — 312 с.
- Малая горная энциклопедия: в 3 т. / под ред. В. С. Белецкого. — Донецк: Донбасс, 2004.
cyclowiki.org