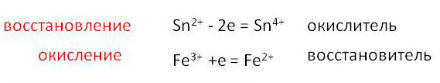С чем реагирует углекислый газ
что такое углекислый газ начинать это-
Углекислый газ — это вещество, существующее обычно в газообразном состоянии. Он может стать твердым, если немного охладится. В воздухе всегда содержится небольшое количество углекислого газа, около 1 литра в 2560 литрах воздуха. Большая часть углекислого газа поступает в воздух, когда животные и растительные ткани, состоящие из углерода, разлагаются. Топливо, состоящее из углерода, такое, как древесина или каменный уголь, дают большое количество двуокиси углерода при сгорании. Человеческому организму требуется для существования небольшое количество углекислого газа. Он контролирует скорость биения сердца и некоторые другие функции организма. Но перенасыщение организма углекислым газом может причинить вред и даже стать причиной смерти. Человек получает кислород из воздуха, которым дышит. Кислород поступает в кровь. Там он соединяется с пищей и превращается в результате химических реакций в углекислый газ. Углекислый газ возвращается в легкие и выдыхается. Деревья, в свою очередь, испытывают жизненную необходимость в углекислом газе. Зеленые растения поглощают углекислый газ из воздуха через поры в листьях. Он соединяется с водой, а затем с помощью солнечного света углекислый газ и вода превращаются в крахмал и другую пищу для растения. Растение при этом выделяет кислород. Итак, растения выделяют кислород и поглощают углекислый газ. Люди и животные вдыхают кислород, а выдыхают углекислый газ. Это поддерживает постоянное количество кислорода и углекислого газа в воздухе. Углекислый газ имеет и промышленное применение, самое из известное из которых — это газирование напитков.
углекислый газ Диоксид углерода — бесцветный газ, без запаха, со слегка кисловатым вкусом. Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. ..
Есть сведения по поводу того, что углекислый газ - неустойчивое соединение, и он не вступает в полной мере в реакцию с кислородом, и поэтому может быть разложен на составляющие механически, например капли дождя - именно поэтому воздух свежий после данного погодного явления
Класс молодец
touch.otvet.mail.ru
Взаимодействие - углекислый газ - Большая Энциклопедия Нефти и Газа, статья, страница 1
Взаимодействие - углекислый газ
Cтраница 1
Взаимодействие углекислого газа со щелочью хорошо наблюдать так. Большую круглодонную колбу заполняют углекислым газом, бросают в нее несколько кусочков щелочи и быстро закрывают резиновой пробкой. После того как пройдет реакция ( обратить внимание на капельки образующейся воды и выделение тепла), горло колбы опускают в сосуд с водой и открывают пробку. Почти вся колба заполняется водой. [2]
При взаимодействии углекислого газа с аммиаком выделяется тепло, которое поднимает температуру в аппарате выше 30, что, как нам уже известно, влечет разложение-кислой угленатриевой соли. [3]
Для процесса взаимодействия углекислого газа с водой с образованием углеводов и выделением кислорода, кроме подведения большого количества тепла, необходимо еще одно условие: присутствие веществ, стимулирующих осуществление реакции взаимодействия углекислого газа и воды. Такое вещество содержится в листьях растений - это хлорофилл. [4]
Получается она в результате взаимодействия углекислого газа с аммиаком при высоком давлении и температуре. [5]
Получается мочевина в результате взаимодействия углекислого газа и аммиака. Современная химическая промышленность с успехом связывает азот воздуха с водородом в аммиак, который взаимодействует с углекислым газом, образуя мочевину. [6]
Какие процессы происходят при взаимодействии углекислого газа с водой. Какие молекулы и ионы находятся в образующемся при этом растворе. [7]
Карбонат натрия, образующийся при взаимодействии углекислого газа, содержащегося в воздухе, с некоторым количеством присутствующей едкой щелочи, повидимому, не растворяется в метаноле. [8]
Приведенная реакция характеризует только конечный результат взаимодействия углекислого газа с растворенным аммиаком. В действительности процесс протекает гораздо сложнее, проходя через ряд промежуточных стадий. [9]
Получение гидрокарбоната калия основано на реакции взаимодействия углекислого газа с раствором карбоната калия. [11]
Схематически фотосинтез можно представить как окислительно-восстановительный процесс взаимодействия углекислого газа и воды, который идет при участии хлорофилла, поглотившего энергию солнечных лучей. [12]
Полученные удовлетворительные результаты могут быть объяснены образованием окиси углерода СО при взаимодействии углекислого газа с твердым углеродом. Окись углерода является весьма эффективным защитным газом, - она не растворима в металле, восстанавливает окислы и не влияет на углерод, содержащийся в металле. Достаточно небольшого содержания СО в газовой смеси, чтобы заметно улучшить качество наплавленного металла. Угольный электрод можно применять для сварки стали, чугуна, алюминия, меди, бронзы и других металлов. [13]
Ценность опыта заключается не только в том, что он - показывает взаимодействие углекислого газа со щелочью, но и в том, что при этом выделяется вода, реакция, сопровождается выделением теплоты. [14]
Страницы: 1 2 3
www.ngpedia.ru
Как распознать азот и углекислый газ
В атмосфере углекислого газа вспыхивает разогретый магний, т. к. СО2 - окислитель. А азот практически ни с чем при н. у. не реагирует.
N - азот, а CO2- углекислый газ
а у меня клитор нашёлся!! ! =)))))))))
спичками или на вкус!
От углекислого газа мутнеет известковая вода, а от азота - нет.
по запаху, крошка
Действительно, чтобы выявить, где находится углекислый газ, достаточно поджечь щепотку магния и опустить в сосуд с газом. Только сосуд должен быть закрыт в ходе эксперимента, чтобы исключить доступ кислорода извне. При этом кислород углекислого газа перейдёт в оксид магния по реакции: 2Mg + CO2 = 2MgO + C Обратите внимание, что в результате протекания реакции высвобождается атомарный углерод, который осядет на стенки сосуда в виде легкого налёта сажи, и Вы этот налёт увидите. Сродство магния к кислороду значительно выше, чем сродство углерода к кислороду. Вот магний и отбирает у СО2 кислород на правах сильного. Естетственно, в сосуде с азотом магний гореть не будет, потухнет и всего делов-то. Конечно, это не единственный способ, но единственно быстрый и подходящий для лабораторных работ. Современная техника позволяет просто опустить датчик газоанализатора в сосуд и через пару секунд получить результат, сколько какого газа в нём находится.
touch.otvet.mail.ru
Помогите пожалуйста!! Сходства и различия угарного газа от углекислого газа??
Оксид углерода (+2) СО - бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, быстро соединяется с гемоглобином, образуя очень прочное соединение карбоксигемоглобин, лишая тем самым возможности гемоглобин переносить кислород. При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива, вот почему так опасно преждевременное закрывание дымоходов. Оксид углерода (+2) относят к несолеобразующим оксидам; он должен реагировать со щелочами и основными оксидами с образованием соли и воды, но этого не наблюдается (потому что СО - оксид неметалла) . Хороший восстановитель. Сгорает в кислороде; способен отнимать кислород у оксидов металлов (т. е. восстанавливать металлы из их оксидов) . Оксид углерода (+4) СО2 - углекислый газ. Бесцветный, не имеющий запаха газ. В полтора раза тяжелее воздуха. Очень хорошо растворяется в воде. При испарении жидкого углекислого газа часть его превращается в твердую снегообразную массу, которую называют "сухой лед" (в нем хранят то же самое мороженное) . Типичный кислотный оксид. Взаимодействует со щелочами, с основными оксидами и водой. Не горит и не поддерживает горения. Применяется для тушения пожаров. Для человека не опасен.
Хим формула: СО и СО2, соответственно
CO угарный CO2 углекислый ничего сложного
touch.otvet.mail.ru
Персональный сайт - Каталог статей
Второй оксид углерода называется диоксидом его, или углекислым газом, и его формула известна каждому - СО2. Атомы углерода и кислорода образуют в ней двойные ковалентные полярные связи, но в целом молекула неполярная, так как симметрична:
О = С = О
Получение.
1) при горении угля и углеродсодержащих веществ:
С + О2 => CO2
Ch5 + 2O2 => CO2 + 2h3O
2)при разложении некоторых сложных веществ:
h3CO3 => CO2 + h3O
CaCO3 => CaO + CO2
2NaHCO3 => Na2CO3 + CO2 + h3O
3) при действии сильных кислот на карбонаты - соли угольной кислоты:
CaCO3 + 2HCl => CaCl2 + CO2 + h3O
K2CO3 + h3SO4 => K2SO4 + CO2 + h3O
Физические свойства.
СО2 - газ без цвета, вкуса и запаха, малорастворим в воде. Растворимость его повышается при увеличении давления. При высоком давлении он становится жидким, а при одновременном охлаждении - твердым ("сухой лёд")
Химические свойства.
1)СО2 - кислотный оксид. При растворении в воде он реагирует с ней и образует непрочную угольную кислоту:
СО2 + Н2О => h3CO3
2) взаимодействует с основными оксидами, образуя соли:
СО2 + СаО => CaCO3
CO2 + Na2O => Na2CO3
3) Углекислый газ реагирует с щелочами. Состав соли зависит от мольного соотношения реагирующих веществ:
CO2 + KOH => KHCO3 гидрокарбонат калия, кислая соль
CO2 + 2KOH => K2CO3 + h3O карбонат калия, средняя соль
4) Углекислый газ взаимодействует с известковой водой, вызывая ее помутнение - это его качественная реакция.
Ca(OH)2 + CO2 -> CaCO3 + h3O
5) Это вещество может быть окислителем для активных металлов:
CO2 + 2Mg => 2MgO + C
6) Углекислый газ не поддерживает горения и дыхания, так как сам он не способен окисляться. Причина этого - высшая степень окисления углерода в его молекуле (+4)
himi4ok.ucoz.ru