Благородные газы. Аргон благородный газ
Инертные газы Википедия
| ||||||
| ||||||
| ||||||
| ||||||
Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы[1]) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью[en]. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
В первых 6 периодах периодической таблицы химических элементов инертные газы относятся к последней, 18-й группе. Возможно, что из-за релятивистских эффектов элемент 7-го периода 14-й группы флеровий обладает некоторыми свойствами благородных газов[2]. Он может заменить в периодической таблице оганесон[3]. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях.
Характеристики благородных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов. При нормальном давлении температуры плавления и кипения у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале.
Неон, аргон, криптон и ксенон выделяют из воздуха специальными установками, используя при этом методы сжижения газов и фракционированной конденсации. Источником гелия являются месторождения природного газа с высокой концентрацией гелия, который отделяется с помощью методов криогенного разделения газов. Радон обычно получают как продукт радиоактивного распада радия из растворов соединений этого элемента.
Химические свойства
Неон, как и все благородные газы, имеет полную электронную оболочку. Все атомы благородных газов имеют на внешней орбите 8 электронов. Исключением является гелий (только 2 электрона)Благородные газы не имеют цвета, запаха, вкуса, а также не возгораются при нормальных условиях.
| 2 | гелий | 2 |
| 10 | неон | 2, 8 |
| 18 | аргон | 2, 8, 8 |
| 36 | криптон | 2, 8, 18, 8 |
| 54 | ксенон | 2, 8, 18, 18, 8 |
| 86 | радон | 2, 8, 18, 32, 18, 8 |
Соединения
Структура тетрафторида ксенона XeF4, одного из первых когда-либо обнаруженных соединений благородных газовИнертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность (по сравнению с лёгкими инертными газами), но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона.
Оганесон, несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твердом состоянии[4].
Физические свойства
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов и планет земной группы
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[5][6]. Известны случаи гибели людей при утечках инертных газов.
Вдыхание значительного количества радиоактивного радона может вызвать рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются по убыванию в следующем порядке (в сравнении приведены также азот и водород): Xe — Kr — Ar — N2 — h3 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа (2 атм), азот — свыше 0,6 МПа (6 атм), водород — свыше 2,0 МПа (20 атм). Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[7].
Применение
Благородные газы в вакуумных стеклянных колбах, через которые пропущен токИнертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Жидкий гелий, который кипит при 4,2 К (−268,95 °C), используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса. Жидкий неон, хотя его температура кипения (–246,03 °C) и не достигает таких низких значений как у жидкого гелия, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода.
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как азотное отравление.
Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[8][неавторитетный источник?] для подводного плавания.
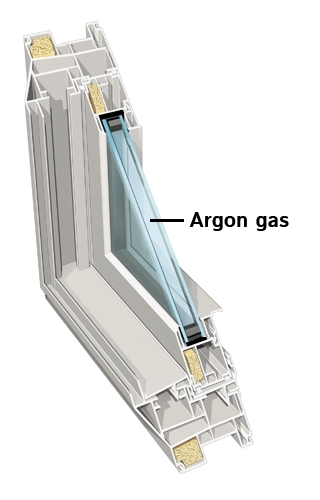
Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется при сварке в защитных газах, резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали. Аргон также применяется в люминесцентных лампах для предотвращения окисления разогретого вольфрамового электрода. Также, ввиду низкой теплопроводности, аргон (а также криптон) используют для заполнения стеклопакетов.
После крушения дирижабля «Гинденбург» в 1937 году огнеопасный водород был заменен негорючим гелием в качестве заполняющего газа в дирижаблях и воздушных шарах, несмотря на снижение плавучести на 8,6 % по сравнению с водородом. Несмотря на замену, катастрофа оказала непропорционально большое влияние на всю область герметичных летательных аппаратов легче воздуха и подорвала планы по расширению этой области авиации более чем на полвека. Они стали популярнее только в последнее время, с развитием нановолоконных тканей и альтернативной энергетики.
Цвета и спектры благородных газов
См. также
Примечания
Литература
- Беннетт, Питер. The Physiology and Medicine of Diving / Питер Беннетт, Эллиотт. — SPCK Publishing, 1998. — ISBN 0-7020-2410-4.
- Bobrow Test Preparation Services. CliffsAP Chemistry. — CliffsNotes, 2007-12-05. — ISBN 0-470-13500-X.
- Гринвуд, Н.Н. Chemistry of the Elements / Н.Н. Гринвуд, Ёрншо. — 2nd. — Oxford:Butterworth-Heinemann, 1997. — ISBN 0-7506-3365-4.
- Хардинг, Чарли Дж. Elements of the P Block / Чарли Дж. Хардинг, Джейнс. — Royal Society of Chemistry, 2002. — ISBN 0-85404-690-9.
- Холловэй, Джон. Noble-Gas Chemistry. — Лондон : Methuen Publishing, 1968. — ISBN 0-412-21100-9.
- Менделеев, Дмитрий. Основы Химии. — 7-е. — 1902–1903.
- Оджима, Минору. Noble Gas Geochemistry / Минору Оджима, Подосек. — Cambridge University Press, 2002. — ISBN 0-521-80366-7.
- Вайнхольд, Ф. Valency and bonding / Ф. Вайнхольд, Лэндис. — Cambridge University Press, 2005. — ISBN 0-521-83128-8.
- Скерри, Эрик. The Periodic Table, Its Story and Its Significance. — Oxford University Press, 2007. — ISBN 0-19-530573-6.
Ссылки
|
Благородный газ Википедия
| ||||||
| ||||||
| ||||||
| ||||||
Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы[1]) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью[en]. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
В первых 6 периодах периодической таблицы химических элементов инертные газы относятся к последней, 18-й группе. Возможно, что из-за релятивистских эффектов элемент 7-го периода 14-й группы флеровий обладает некоторыми свойствами благородных газов[2]. Он может заменить в периодической таблице оганесон[3]. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях.
Характеристики благородных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов. При нормальном давлении температуры плавления и кипения у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале.
Неон, аргон, криптон и ксенон выделяют из воздуха специальными установками, используя при этом методы сжижения газов и фракционированной конденсации. Источником гелия являются месторождения природного газа с высокой концентрацией гелия, который отделяется с помощью методов криогенного разделения газов. Радон обычно получают как продукт
ru-wiki.ru
Реферат - Благородные газы - Рефераты на репетирем.ру
Благородные газы
Общие сведения об открытиях благородных газов
К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон. По своим свойствам они не похожи ни на какие другие элементы и в периодической системе располагаются между типичными металлами и неметаллами.
История открытия инертных газов представляет большой интерес: во-первых, как триумф введённых Ломоносовым количественных методов химии(открытие аргона), а во-вторых, как триумф теоретического предвидения (открытие остальных инертных газов), опирающегося на величайшее обобщение химии – периодический закон Менделеева.
Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа – аргона – произошло в то время, когда построение периодической системы казалось завершённым и в ней оставалось лишь несколько пустых клеток.
Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал “Nature” обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин...
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. “Воздух при помощи раскалённой меди был лишён своего кислорода и затем нагрет с кусочками магния в трубочке. После того как значительное количество азота было поглощено магнием, была определена плотность остатка. Плотность оказалась в 15 раз больше плотности водорода, тогда как плотность азота только в 14 раз больше её. Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока не достигла 18. Этим было доказано, что воздух содержит газ, плотность которого больше плотности азота… Я получил 100 см 3 этого вещества и нашёл его плотность равной 19,9. Оно оказалось одноатомным газом.” Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную - почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое в переводе с греческого значит “недеятельный”.
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. “гелиос”, что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что a -частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
После этого открытия Рамзай пришёл к выводу, что существует целая группа химических элементов, которая располагается в периодической системе между щелочными металлами и галогенами. Пользуясь периодическим законом и методом Менделеева, было определено количество неизвестных благородных газов и их свойства, в частности их атомные массы. Это позволило осуществить и целенаправленные поиски благородных газов.
Вначале Рамзай и его сотрудники занялись минералами, природными водами, даже метеоритами. Результаты анализов неизменно оказывались отрицательными. Между тем—теперь мы это знаем—новый газ в них был. Но методами, существовавшими в конце прошлого века, эти “микроследы” не улавливались. Затем исследователи обратились к воздуху.
Всего за четыре последующих года было открыто четыре новых элемента, при этом неон, криптон и ксенон были выделены из воздуха.
Воздух, очищенный предварительно от углекислоты и влаги, сжижали, а затем начинали медленно испарять. Сначала “летят” более легкие газы. После испарения основной массы воздуха рассортировывают оставшиеся тяжелые инертные газы. Затем, полученные фракции исследовали. Одним из методов поиска был спектральный анализ: газ помещали в разрядную трубку, подключали ток и по линиям спектра определяли “кто есть кто”.
Когда в разрядную трубку поместили первую, самую легкую и низкокипящую фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и аргона были обнаружены новые линии, из них особенно яркими были красные и оранжевые. Они придавали свету в трубке огненную окраску. В момент, когда Рамзай наблюдал спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать “болельщиком” отцовых работ. Увидев необычное свечение, он воскликнул: “new one!” Так возникло название газа “неон”, по-древнегречески значит “новый”.
После того как были открыты гелий, неон и аргон, завершающие три первых периода таблицы Менделеева, уже не вызывало сомнений, что четвёртый, пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м 3 воздуха 9, 3 л аргона и всего лишь 0, 08 мл ксенона. Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон (“скрытый”). Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит “чужой”: в криптоновой фракции воздуха он действительно выглядел чужаком. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха; индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см 3 этого газа. Необычайная для того времени тонкость эксперимента! Хотя содержание ксенона в атмосфере крайне мало, именно воздух — практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый — потому, что почти весь ксенон возвращается в атмосферу.
Заслуга открытия высшего представителя инертных газов принадлежит тому же Рамзаю. При помощи весьма тонких технических приёмов он доказал, что радиоактивное истечение из радия – эманация радия – представляет собой газ, подчиняющийся всем законам обычных газов, химически инертный и обладающий характерным спектром. Его молекулярный вес – около 220 – был Рамзаем измерен по скорости диффузии. Если предположить, что ядро атома эманации радия – это остаток ядра радия после выбрасывания из него ядра атома гелия - a -частицы, то заряд его должен быть равен 88-2=86, т.е. новый элемент должен действительно быть инертным газом с атомным весом 226-4=222.
 Таким образом, после блестящих экспериментов 16 марта 1900 г. в Лондоне произошла встреча Менделеева и Рамзая, на которой было официально решено включить в периодическую систему новую группу химических элементов.
Таким образом, после блестящих экспериментов 16 марта 1900 г. в Лондоне произошла встреча Менделеева и Рамзая, на которой было официально решено включить в периодическую систему новую группу химических элементов.
Аргон
История открытия Аргона
В 1785 г. английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал “Nature” обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин...
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически.
Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную – почти процент!
Кстати, именно в этот день и час, 13 августа 1894 г., аргон и получил свое имя, которое в переводе с греческого значит “недеятельный”. Его предложил председательствовавший на собрании доктор Медан.
Между тем нет ничего удивительного в том, что аргон так долго ускользал от ученых. Ведь в природе он себя решительно ничем не проявлял! Напрашивается параллель с ядерной энергией: говоря о трудностях ее выявления, А. Эйнштейн заметил, что нелегко распознать богача, если он не тратит своих денег...
Скепсис ученых был быстро развеян экспериментальной проверкой и установлением физических констант аргона. Но не обошлось без моральных издержек: расстроенный нападками коллег (главным образом химиков) Рэлей оставил изучение аргона и химию вообще и сосредоточил свои интересы на физических проблемах. Большой ученый, он и в физике достиг выдающихся результатов, за что в 1904 г. был удостоен Нобелевской премии. Тогда в Стокгольме он вновь встретился с Рамзаем, который в тот же день получал Нобелевскую премию за открытие и исследование благородных газов, в том числе и аргона.
Обобщение истории открытия
Аргон был открыт как инертный газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась присутствием ничтожного количества более тяжелых инертных газов, преимущественно аргона. Этот элемент был первым из инертных газов, обнаруженных в природе на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.), причем его несколько больше над поверхностью больших водоемов, чем над сушей, так как азот и кислород более растворимы в воде. В электротехнической промышленности ежемесячно расходуется несколько тысяч кубических метров аргона для создания инертной среды в лампах накаливания: аргоновая среда позволяет снизить скорость испарения вольфрамовой нити и предотвращает ее окисление.
Строение Аргона
Аргон это газ с завершенным последним электронным уровнем
Ar 1S2 2S2 2P6 3S2 3P6
10 электронов
18 протонов
22 нейтрона
Физические свойства
Общие свойства инертных газов
Все благородные газы– бесцветные одноатомные газ без цвета и запаха
обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятсяНасыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Из подгруппы тяжелых инертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостью становится при – 185,9°C, затвердевает при – 189,4°C (в условиях нормального давления). В отличие от гелия и неона, он довольно хорошо адсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см 3 в 100 г воды при 20°C). Еще лучше растворяется аргон во многих органических жидкостях. Зато он практически нерастворим в металлах и не диффундирует сквозь них.
Как все инертные газы, аргон диамагнитен. Это значит, что его магнитная восприимчивость отрицательна, он оказывает большее противодействие магнитным силовым линиям, чем пустота. Это свойство аргона (как и многие другие) объясняется “замкнутостью” электронных оболочек его атомов.
Под действием электрического тока аргон ярко светится, сине-голубое свечение аргона широко используется в светотехнике.
Теперь о влиянии аргона на живой организм. При вдыхании смеси из 69% Ar, 11% азота и 20% кислорода под давлением 4 атм возникают явления наркоза, которые выражены гораздо сильнее, чем при вдыхании воздуха под тем же давлением. Наркоз мгновенно исчезает после прекращения подачи аргона. Причина – в неполярности молекул аргона, повышенное же давление усиливает растворимость аргона в нервных тканях.
Биологи нашли, что аргон благоприятствует росту растений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и ржи выкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящей из 98% аргона и только 2% кислорода.
Химические свойства
Химическая инертность аргона (как и других газов этой группы) и одноатомность его молекул объясняются прежде всего предельной насыщенностью электронных оболочек. Тем не менее разговор о химии аргона сегодня не беспредметен.
Есть основания считать, что исключительно нестойкое соединение Hg – Ar, образующееся в электрическом разряде, – это подлинно химическое (валентное) соединение. Не исключено, что будут получены валентные соединения аргона с фтором и кислородом, которые, скорее всего, будут неустойчивыми, Как нестойки и даже взрывоопасны окислы ксенона – газа, более тяжелого и явно более склонного к химическим реакциям, чем аргон.
Еще в конце прошлого века француз Вийяр, сжимая аргон под водой при 0°C, получил кристаллогидрат состава Аr · 6Н 2 О, а в 20...30-х годах XX столетия Б.А. Никитиным, Р.А. Франкраном и другими исследователями при повышенных давлениях и низких температурах были получены кристаллические клатратные соединения аргона с H 2 S, SO 2 , галогеноводородами, фенолами и некоторыми другими веществами. В 1976 г. появилось сообщение о синтезе гидрида аргона, но пока еще трудно сказать, является ли этот гидрид истинно химическим, валентным соединением.
Вот пока и все успехи химии...
Аргон на Земле и во Вселенной
На Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых. Его среднее содержание в земной коре (кларк) в 14 раз больше, чем гелия, и в 57 раз больше, чем неона. Есть аргон и в воде, до 0,3 см 3 в литре морской и до 0,55 см 3 в литре пресной воды. Любопытно, что в воздухе плавательного пузыря рыб аргона находят больше, чем в атмосферном воздухе. Это потому, что в воде аргон растворим лучше, чем азот...
Главное “хранилище” земного аргона – атмосфера. Его в ней (по весу) 1,286%, причем 99,6% атмосферного аргона – это самый тяжелый изотоп – аргон-40. Еще больше доля этого изотопа в аргоне земной коры. Между тем у подавляющего большинства легких элементов картина обратная – преобладают легкие изотопы.
Причина этой аномалии обнаружена в 1943 г. В земной коре находится мощный источник аргона-40 – радиоактивный изотоп калия 40 К. Этого изотопа на первый взгляд в недрах немного – всего 0,0119% от общего содержания калия. Однако абсолютное количество калия-40 велико, поскольку калий – один из самых распространенных на нашей планете элементов. В каждой тонне изверженных пород 3,1 г калия-40.
Радиоактивный распад атомных ядер калия-40 идет одновременно двумя путями. Примерно 88% калия-40 подвергается бета распаду и превращается в кальций-40. Но в 12 случаях из 100 (в среднем) ядра калия-40 не излучают, а, наоборот, захватывают по одному электрону с ближайшей к ядру К-орбиты (“К-захват”). Захваченный электрон соединяется с протоном – образуется новый нейтрон в ядре и излучается нейтрино. Атомный номер элемента уменьшается на единицу, а масса ядра остается практически неизменной. Так калий превращается в аргон.
Период полураспада 40 К достаточно велик – 1,3 млрд лет. Поэтому процесс образования 40 Аr в недрах Земли будет продолжаться еще долго, очень долго. Поэтому, хотя и чрезвычайно медленно, но неуклонно будет возрастать содержание аргона в земной коре и атмосфере, куда аргон “выдыхается” литосферой в результате вулканических процессов, выветривания и перекристаллизации горных пород, а также водными источниками.
Правда, за время существования Земли запас радиоактивного калия основательно истощился – он стал в 10 раз меньше (если возраст Земли считать равным 4,5 млрд лет.).
Соотношение изотопов 40 Аr: 40 К и 40 Ar: 36 Аr в горных породах легло в основу аргонного метода определения абсолютного возраста минералов. Очевидно, чем больше эти отношения, тем древнее порода. Аргонный метод считается наиболее надежным для определения возраста изверженных пород и большинства калийных минералов. За разработку этого метода профессор Э.К. Герлинг в 1963 году удостоен Ленинской премии.
Итак, весь или почти весь аргон-40 произошел на Земле от калия-40. Поэтому тяжелый изотоп и доминирует в земном аргоне.
Этим фактором объясняется, кстати, одна из аномалий периодической системы. Вопреки первоначальному принципу ее построения – принципу атомных весов – аргон поставлен в таблице впереди калия. Если бы в аргоне, как и в соседних элементах, преобладали легкие изотопы (как это, по-видимому, имеет место в космосе), то атомный вес аргона был бы на две-три единицы меньше...
Теперь о легких изотопах.
Откуда берутся 36 Аr и 38 Аr? Не исключено, что какая-то часть этих атомов реликтового происхождения, т.е. часть легкого аргона пришла в земную атмосферу из космоса при формировании нашей планеты и ее атмосферы. Но большая часть легких изотопов аргона родилась на Земле в результате ядерных процессов.
Вероятно, еще не все такие процессы обнаружены. Скорее всего некоторые из них давно прекратились, так как исчерпались короткоживущие атомы-“родители”, но есть и поныне протекающие ядерные процессы, в которых рождаются аргон-36 и аргон-38. Это бета-распад хлора-36, обстрел альфа-частицами (в урановых минералах) серы-33 и хлора-35:
36
17 Cl β– → 36 18 Ar + 0 –1 e + ν.33
16 S + 4 2 He → 36 18 Ar + 1 0 n .35
17 Cl + 4 2 He → 38 18 Ar + 1 0 n + 0 +1 e .В материи Вселенной аргон представлен еще обильнее, чем на нашей планете. Особенно много его в веществе горячих звезд и планетарных туманностей. Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия – элементов, весьма распространенных на Земле.
В космическом аргоне главенствуют изотопы 36 Аr и 38 Аr, аргона-40 во Вселенной очень мало. На это указывает масс-спектральный анализ аргона из метеоритов. В том же убеждают подсчеты распространенности калия. Оказывается, в космосе калия примерно в 50 тыс. раз меньше, чем аргона, в то время как на Земле их соотношение явно в пользу калия – 660 : 1. А раз мало калия, то откуда же взяться аргону-40?!
Применение
Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса
Как добывают аргон
Земная атмосфера содержит 66 · 1013 т аргона. Этот источник аргона неисчерпаем, тем более что практически весь аргон рано или поздно возвращается в атмосферу, поскольку при использовании он не претерпевает никаких физических или химических изменений. Исключение составляют весьма незначительные количества изотопов аргона, расходуемые на получение в ядерных реакциях новых элементов и изотопов.
Получают аргон как побочный продукт при разделении воздуха на кислород и азот. Обычно используют воздухоразделительные аппараты двукратной ректификации, состоящие из нижней колонны высокого давления (предварительное разделение), верхней колонны низкого давления и промежуточного конденсатора-испарителя. В конечном счете азот отводится сверху, а кислород – из пространства над конденсатором.
Летучесть аргона больше, чем кислорода, но меньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейся примерно на трети высоты верхней колонны, и отводят в специальную колонну. Состав аргонной фракции: 10...12% аргона, до 0,5% азота, остальное – кислород. В “аргонной” колонне, присоединенной к основному аппарату, получают аргон с примесью 3...10% кислорода и 3...5% азота. Дальше следует очистка “сырого” аргона от кислорода (химическим путем или адсорбцией) и от азота (ректификацией). В промышленных масштабах ныне получают аргон до 99,99%-ной чистоты. Аргон извлекают также из отходов аммиачного производства – из азота, оставшегося после того, как большую его часть связали водородом.
Аргон хранят и транспортируют в баллонах емкостью 40 л, окрашенных в серый цвет с зеленой полосой и зеленой надписью. Давление в них 150 атм. Более экономична перевозка сжиженного аргона, для чего используют сосуды Дюара и специальные цистерны.
Искусственные радиоизотопы аргона получены при облучении некоторых стабильных и радиоактивных изотопов ( 37 Cl, 36 Аr, 40 Аr, 40 Са) протонами и дейтонами, а также при облучении нейтронами продуктов, образовавшихся в ядерных реакторах при распаде урана. Изотопы 37 Аr и 41 Аr используются как радиоактивные индикаторы: первый – в медицине и фармакологии, второй – при исследовании газовых потоков, эффективности спетом вентиляции и в разнообразных научных исследованиях. Но, конечно, не эти применения аргона самые важные.
referat.store
Благородные газы — Знаешь как
Содержание статьи
Общая характеристика элементов главной подгруппы VIII группы
В состав главной подгруппы VIII группы периодической системы элементов Д. И. Менделеева входит семейство так называемых благородных газов — гелий Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе, радон Rn. Эти элементы известны также под названием инертные газы, так как в начале их изучении не было экспериментальных доказательств, свидетельствующих о способности этих элементов образовывать химические соединения. В настоящее время уже известны их многочисленные соединения, поэтому название «инертные» более правильно заменить словом «благородные».
| Энергетические уровни | Радиус атома, Å | ||||||||
| 1,22 1,60 1,91 2,01 2,20 2,31 | |||||||||
Атомы благородных газов, как видно из табл. 16, имеют завершенную структуру внешнего электронного слоя, что затрудняет образование ими соединений. Этим объясняется и то, что в отличие от других простых газов благородные газы имеют одноатомные молекулы.
Легче всего соединения благородных газов образуются по донорно-акцепторному типу связи, однако известны и ковалентные соединения, но весьма неустойчивые, например XeF6, который легко взрывается при ударе, XeF4, ХеO4 и др. Эти соединения могут образовывать лишь «возбужденные» атомы благородного газа. «Возбуждение» атома, т. е. «распаривание» электронов внешнего слоя для образования химической связи, может произойти лишь в том случае, если это энергетически выгодно, т. е. когда на том же внешнем уровне имеются свободные орбитали, на которые могут перейти электроны. Например, атом неона имеет второй полностью завершенный энергетический уровень L.

Свободных орбиталей на этом уровне нет. Возбудить атом неона — значит перевести часть его электронов на другой, более высокий уровень М, что энергетически весьма невыгодно. Поэтому ковалентные связи у неона обнаружить не удается. У атома аргона распределение электронов на внешнем-(третьем) уровне следующее

Как показывает схема, у атома аргона в невозбужденном состоянии третий энергетический уровень М имеет 5 незанятых d-орбиталей, на которые при возбуждении атома могут переходить электроны. Это орбитали одного и того же уровня, поэтому для возбуждения атома аргона требуется меньше энергии, чем для атома неона. Еще легче возбуждаются и, следовательно, вступают в химические реакции атомы криптона, ксенона, радона. С увеличением радиуса атома уменьшается затрата энергии, необходимой для его возбуждения и, следовательно, увеличивается реакционная способность элемента. Другими словами, реакционная способность благородных газов увеличивается от гелия к радону. Устойчивость соединений этих элементов возрастает в том же направлении.
■ 1 . Чем объяснить первоначальное размещение благородных газов в нулевой группе периодической системы, а затем последующее их перенесение в VIII группу? (См. Ответ) 2. Почему атом криптона легче возбудить, чем атом неона? 3. Почему молекула хлора двухатомна, а неона — одноатомна? 4. Почему гелий и неон не образуют соединений с ковалентной связью? 5. Как зависит реакционная способность благородных газов от радиуса атома? (См. Ответ)
Свойства благородных газов
Физические свойства благородных газов приведены в табл. 17.
| Порядковый номер | Атомный вес, у. е. | Плотность, г/л | Температура кипения, °С | Температура плавления, °С | |
| Гелий Не Неон Ne | 4,026 20,179 38,948 83,80 131,3 222 | 0,17848 0,899 1,7837 3,736 5,851 9,96 | —268,9 —245,9 — 185,87 —153,2 —107,1 —65 | —272,6 —248,6 —189,3 —156,6 —111,8 —71 |
Благородные газы не имеют запаха, вкуса, бесцветны во всех агрегатных состояниях. Из всех благородных газов уникальными свойствами обладает гелий. Он в 7 раз легче воздуха, особенно трудно сжижается, крайне мало растворим в воде (в 100 объемах воды при нормальных условиях растворяется 1 объем гелия). В жидком состоянии гелий обладает сверхпроводимостью и сверхтекучестью. Растворимость остальных газов повышается с возрастанием атомного веса и у радона достигает 50 объемов в 100 объемах воды. Остальные благородные газы также хорошо проводят электрический ток.
О химических свойствах благородных газов уже говорилось выше (§90). Наиболее полно изучены химические свойства ксенона, его фториды, оксиды и соединения с металлами платиновой группы. Однако есть данные о соединениях криптона и радона. Следует заметить, что благородные газы имеют очень характерные спектры. Это позволяет легко обнаруживать их и различать между собой, что и используется для их аналитического определения.
■ 6. Чем объяснить то, что название «инертные» газы пришлось изменить на «благородные»? (См. Ответ)
Применение и получение благородных газов
Применение благородных газов связано с особенностью их свойств. Легкость и негорючесть гелия позволили использовать его первоначально в воздухоплавании при строительстве дирижаблей. Низкая растворимость его в воде привела к использованию этого газа для изготовления газовой смеси для дыхания при кессонных и водолазных работах. Широко применяются благородные газы в светотехнике. В газосветных разрядных лампах они светятся разными цветами: неон — розовым, аргон — синим, криптон — зеленым. Это позволяет использовать их в световых рекламах, а неон — и на маяках. Наполняемые аргоном электрические лампочки накаливания долговечнее, чем наполняемые азотом. При заполнении ламп криптоном или ксеноном возрастает светоотдача, а колбы таких ламп можно делать значительно меньше. В люминесцентные лампы также добавляют немного аргона или криптона для лучшей их работы. Благородные газы используются и в телевизионной аппаратуре.
В связи с химической инертностью благородные газы, главным образом аргон и гелий, используют для работы в их атмосфере с некоторыми металлами, к которым предъявляются требования особой чистоты и точности обработки. Гелий имеет очень большое значение для получения сверхнизких температур. Ксенон и радон нашли применение в медицине: ксенон — при рентгеноскопии головного мозга, радон — в физиотерапии (радоновые ванны). Смесь криптона с кислородом оказывает наркотизирующее действие.
■ 7. Начертите в тетради_и заполните приведенную ниже таблицу. (См. Ответ)
| Название газа | Свойство, определяющее применение | |
8. Имеется 3 цилиндра. В одном из них находится кислород, в другом — азот, в третьем — аргон. Как распознать, в каком цилиндре какой газ? Каким реактивом при этом следует воспользоваться? Подтвердите свой ответ уравнениями реакций. Благородные газы — неон, аргон, криптон и ксенон — получают из воздуха. Для их полной очистки от примесей азота пользуются многократной фракционной перегонкой, пропусканием при нагревании над металлическим литием и пылевидным титаном. Разделение смеси благородных газов можно произвести при помощи активированного угля. Чем больше атомный вес газа, тем выше его поглощаемость углем. Благородные газы содержатся в небольших количествах в земной атмосфере. Больше всего (0,9% по объему) в ней содержится аргона. Аргон поступает в атмосферу из земной коры при радиоактивном распаде изотопа калия 40 К. Гелий встречается в составе залежей природных газов или впитывается рыхлыми горными породами, из которых его можно извлекать. Огромное количество гелия обнаружено на солнце. Он и открыт был именно при спектроскопическом исследовании солнечного света. Радон встречается в воде минеральных источников в растворенном виде (Цхалтубо).
■ 9. Рассчитайте, сколько весит при нормальных условиях 1 м3-газовой смеси, состоящей на 30% из водорода и на 70% из гелия по объему. (См. Ответ) 10. Какие из благородных газов легче воздуха? 11. Какова плотность аргона по водороду? 12. Каков молекулярный вес криптона, если его плотность по водороду равна 42? (См. Ответ)
30
29 31
znaesh-kak.com
Благородные газы - Википедия
| ||||||
| ||||||
| ||||||
| ||||||
Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы[1]) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета и запаха с очень низкой [en]. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
В первых 6 периодах периодической таблицы химических элементов инертные газы относятся к последней, 18-й группе. Возможно, что из-за релятивистских эффектов элемент 7-го периода 14-й группы флеровий обладает некоторыми свойствами благородных газов[2]. Он может заменить в периодической таблице оганесон[3]. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях.
Характеристики благородных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов. При нормальном давлении температуры плавления и кипения у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале.
Неон, аргон, криптон и ксенон выделяют из воздуха специальными установками, используя при этом методы сжижения газов и фракционированной конденсации. Источником гелия являются месторождения природного газа с высокой концентрацией гелия, который отделяется с помощью методов . Радон обычно получают как продукт радиоактивного распада радия из растворов соединений этого элемента.
Химические свойства[ | ]
Неон, как и все благородные газы, имеет полную электронную оболочку. Все атомы благородных газов имеют на внешней орбите 8 электронов. Исключением является гелий (только 2 электрона)Благородные газы не имеют цвета, запаха, вкуса, а также не возгораются при нормальных условиях.
| 2 | гелий | 2 |
| 10 | неон | 2, 8 |
| 18 | аргон | 2, 8, 8 |
| 36 | криптон | 2, 8, 18, 8 |
| 54 | ксенон | 2, 8, 18, 18, 8 |
| 86 | радон | 2, 8, 18, 32, 18, 8 |
Соединения[ | ]
Структура тетрафторида ксенона XeF4, одного из первых когда-либо обнаруженных соединений благородных газовИнертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность (по сравнению с лёгкими инертными газами), но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона.
Оганесон, несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твердом состоянии[4].
Физические свойства[ | ]
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов и планет земной группы
Биологическое действие[ | ]
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[5][6]. Известны случаи гибели людей при утечках аргона.
Вдыхание значительного количества радиоактивного радона может вызвать рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются по убыванию в следующем порядке (в сравнении приведены также азот и водород): Xe — Кr — Ar — N2 — h3 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа (2 атм), азот — свыше 0,6 МПа (6 атм), водород — свыше 2,0 МПа (20 атм). Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[7].
Применение[ | ]
Благородные газы в вакуумных стеклянных колбах, через которые пропущен токИнертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Жидкий гелий, который кипит при 4,2 К (−268,95 °C), используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса. Жидкий неон, хотя и не достигает таких низких температур как жидкий гелий, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода.
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как азотное отравление.
Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[8][неавторитетный источник?] для подводного плавания.
Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется при сварке в защитных газах, резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали. Аргон также применяется в люминесцентных лампах для предотвращения окисления разогретого вольфрамового электрода. Также, ввиду низкой теплопроводности, аргон (а также криптон) используют для заполнения стеклопакетов.
После крушения дирижабля «Гинденбург» в 1937 году негорючий гелий заменил огнеопасный водород в качестве заполняющего газа в дирижаблях и воздушных шарах, несмотря на снижение плавучести на 8,6 % по сравнению с водородом. Несмотря на замену, катастрофа оказала непропорционально большое влияние на всю область герметичных летательных аппаратов легче воздуха и подорвала планы по расширению этой области авиации более чем на полвека. Они стали популярнее только в последнее время, с развитием нановолоконных тканей и альтернативной энергетики.
Цвета и спектры благородных газов[ | ]
См. также[ | ]
Примечания[ | ]
Литература[ | ]
Ссылки[ | ]
|
encyclopaedia.bid
Благородные газы — WiKi
| ||||||
| ||||||
| ||||||
| ||||||
Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы[1]) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью[en]. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
В первых 6 периодах периодической таблицы химических элементов инертные газы относятся к последней, 18-й группе. Возможно, что из-за релятивистских эффектов элемент 7-го периода 14-й группы флеровий обладает некоторыми свойствами благородных газов[2]. Он может заменить в периодической таблице оганесон[3]. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях.
Характеристики благородных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов. При нормальном давлении температуры плавления и кипения у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале.
Неон, аргон, криптон и ксенон выделяют из воздуха специальными установками, используя при этом методы сжижения газов и фракционированной конденсации. Источником гелия являются месторождения природного газа с высокой концентрацией гелия, который отделяется с помощью методов криогенного разделения газов. Радон обычно получают как продукт радиоактивного распада радия из растворов соединений этого элемента.
Химические свойства
Неон, как и все благородные газы, имеет полную электронную оболочку. Все атомы благородных газов имеют на внешней орбите 8 электронов. Исключением является гелий (только 2 электрона)Благородные газы не имеют цвета, запаха, вкуса, а также не возгораются при нормальных условиях.
| 2 | гелий | 2 |
| 10 | неон | 2, 8 |
| 18 | аргон | 2, 8, 8 |
| 36 | криптон | 2, 8, 18, 8 |
| 54 | ксенон | 2, 8, 18, 18, 8 |
| 86 | радон | 2, 8, 18, 32, 18, 8 |
Соединения
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность (по сравнению с лёгкими инертными газами), но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона.
Оганесон, несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твердом состоянии[4].
Физические свойства
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[5][6]. Известны случаи гибели людей при утечках инертных газов.
Вдыхание значительного количества радиоактивного радона может вызвать рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются по убыванию в следующем порядке (в сравнении приведены также азот и водород): Xe — Kr — Ar — N2 — h3 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа (2 атм), азот — свыше 0,6 МПа (6 атм), водород — свыше 2,0 МПа (20 атм). Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[7].
Применение
Благородные газы в вакуумных стеклянных колбах, через которые пропущен токИнертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Жидкий гелий, который кипит при 4,2 К (−268,95 °C), используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса. Жидкий неон, хотя его температура кипения (–246,03 °C) и не достигает таких низких значений как у жидкого гелия, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода.
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как азотное отравление.
Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[8][неавторитетный источник?] для подводного плавания.
Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется при сварке в защитных газах, резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали. Аргон также применяется в люминесцентных лампах для предотвращения окисления разогретого вольфрамового электрода. Также, ввиду низкой теплопроводности, аргон (а также криптон) используют для заполнения стеклопакетов.
После крушения дирижабля «Гинденбург» в 1937 году огнеопасный водород был заменен негорючим гелием в качестве заполняющего газа в дирижаблях и воздушных шарах, несмотря на снижение плавучести на 8,6 % по сравнению с водородом. Несмотря на замену, катастрофа оказала непропорционально большое влияние на всю область герметичных летательных аппаратов легче воздуха и подорвала планы по расширению этой области авиации более чем на полвека. Они стали популярнее только в последнее время, с развитием нановолоконных тканей и альтернативной энергетики.
Цвета и спектры благородных газов
См. также
Примечания
Литература
- Беннетт, Питер. The Physiology and Medicine of Diving / Питер Беннетт, Эллиотт. — SPCK Publishing, 1998. — ISBN 0-7020-2410-4.
- Bobrow Test Preparation Services. CliffsAP Chemistry. — CliffsNotes, 2007-12-05. — ISBN 0-470-13500-X.
- Гринвуд, Н.Н. Chemistry of the Elements / Н.Н. Гринвуд, Ёрншо. — 2nd. — Oxford:Butterworth-Heinemann, 1997. — ISBN 0-7506-3365-4.
- Хардинг, Чарли Дж. Elements of the P Block / Чарли Дж. Хардинг, Джейнс. — Royal Society of Chemistry, 2002. — ISBN 0-85404-690-9.
- Холловэй, Джон. Noble-Gas Chemistry. — Лондон : Methuen Publishing, 1968. — ISBN 0-412-21100-9.
- Менделеев, Дмитрий. Основы Химии. — 7-е. — 1902–1903.
- Оджима, Минору. Noble Gas Geochemistry / Минору Оджима, Подосек. — Cambridge University Press, 2002. — ISBN 0-521-80366-7.
- Вайнхольд, Ф. Valency and bonding / Ф. Вайнхольд, Лэндис. — Cambridge University Press, 2005. — ISBN 0-521-83128-8.
- Скерри, Эрик. The Periodic Table, Its Story and Its Significance. — Oxford University Press, 2007. — ISBN 0-19-530573-6.
Ссылки
ru-wiki.org
Благородный газ - это... Что такое Благородный газ?
Ине́ртные или благоро́дные газы — химические элементы главной подгруппы VIII группы, у которых s- и p- оболочки полностью заполнены. К ним относятся:
Инертные газы отличаются крайне низкой химической активностью (отсюда и название). Тем не менее, все они при определенных условиях могут образовывать соединения (особенно охотно со фтором). Наиболее "инертны" неон и гелий: чтобы заставить их вступить в реакцию, нужно очень постараться, искусственно ионизируя каждый атом. Ксенон же наоборот слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8).
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах.
Инертные газы не ядовиты. Тем не менее, в атмосфере чистого инертного газа человек жить не может из-за отсутствия кислорода. Известны случаи гибели людей при утечках аргона. Вдыхание радиоактивного радона может вызвать рак.
Ссылки
Химия инертных газов
Wikimedia Foundation. 2010.
- Благородный восьмеричный Путь
- Благосветлов Григорий Евлампиевич
Смотреть что такое "Благородный газ" в других словарях:
благородный газ — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN rare gas … Справочник технического переводчика
благородный газ — inertinės dujos statusas T sritis Standartizacija ir metrologija apibrėžtis Dujinės būsenos inertiniai elementai He, Ne, Ar, Kr, Xe, Rn. atitikmenys: angl. inactive gas; inert gas; noble gas; rare gas vok. Edelgas, n; inertes Gas, n; Inertgas, n… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
благородный газ — inertinės dujos statusas T sritis chemija apibrėžtis He, Ne, Ar, Kr, Xe, Rn. atitikmenys: angl. inert elements; inert gas; noble gas; rare gas rus. благородный газ; инертные элементы; инертный газ ryšiai: sinonimas – inertiniai elementai … Chemijos terminų aiškinamasis žodynas
благородный газ — inertinės dujos statusas T sritis fizika atitikmenys: angl. inert gas; noble gas; rare gas vok. Edelgas, n; inertes Gas, n; Inertgas, n rus. благородный газ, m; инертный газ, m pranc. gaz inerte, m; gaz noble, m; gaz rare, m … Fizikos terminų žodynas
инертный газ — inertinės dujos statusas T sritis Standartizacija ir metrologija apibrėžtis Dujinės būsenos inertiniai elementai He, Ne, Ar, Kr, Xe, Rn. atitikmenys: angl. inactive gas; inert gas; noble gas; rare gas vok. Edelgas, n; inertes Gas, n; Inertgas, n… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
редкий газ — inertinės dujos statusas T sritis Standartizacija ir metrologija apibrėžtis Dujinės būsenos inertiniai elementai He, Ne, Ar, Kr, Xe, Rn. atitikmenys: angl. inactive gas; inert gas; noble gas; rare gas vok. Edelgas, n; inertes Gas, n; Inertgas, n… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
ИНЕРТНЫЙ ГАЗ — ИНЕРТНЫЙ ГАЗ, см. БЛАГОРОДНЫЙ ГАЗ … Научно-технический энциклопедический словарь
инертный газ — inertinės dujos statusas T sritis chemija apibrėžtis He, Ne, Ar, Kr, Xe, Rn. atitikmenys: angl. inert elements; inert gas; noble gas; rare gas rus. благородный газ; инертные элементы; инертный газ ryšiai: sinonimas – inertiniai elementai … Chemijos terminų aiškinamasis žodynas
инертный газ — inertinės dujos statusas T sritis fizika atitikmenys: angl. inert gas; noble gas; rare gas vok. Edelgas, n; inertes Gas, n; Inertgas, n rus. благородный газ, m; инертный газ, m pranc. gaz inerte, m; gaz noble, m; gaz rare, m … Fizikos terminų žodynas
инертный [благородный, редкий] газ — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN inert gas … Справочник технического переводчика
dic.academic.ru